骨肉瘤组织miR-133b表达变化及意义
林琰杰,于嘉智,魏传银
(1淄博市第一医院,山东淄博255200;2济南市儿童医院)
骨肉瘤组织miR-133b表达变化及意义
林琰杰1,于嘉智2,魏传银1
(1淄博市第一医院,山东淄博255200;2济南市儿童医院)
目的 探讨微小RNA-133b(miR-133b)在骨肉瘤发生、发展中的作用。方法收集32例行骨肉瘤切除术患者的骨肉瘤组织及肉瘤旁正常骨组织(简称正常骨组织),采用荧光定量PCR法检测其miR-133b、miR-451、miR-15a、miR-646、miR-218、miR-449a相对表达量,Western blotting法检测细胞增殖相关蛋白(p21、p27、PCNA、Ki67)和Krppel样因子4(KLF-4)蛋白相对表达量。采用Spearman相关分析法分析骨肉瘤组织中miR-133b与KLF4表达之间的关系。结果骨肉瘤组织miR-133b相对表达量低于正常骨组织(P<0.01);两种组织miR-451、miR-15a、miR-646、miR-218、miR-449a相对表达量比较差异均无统计学意义(P均>0.05)。骨肉瘤组织p21、p27蛋白相对表达量均低于正常骨组织,PCNA、Ki67、KLF-4蛋白相对表达量均高于正常骨组织(P均<0.01)。Spearman相关分析结果显示,骨肉瘤组织中miR-133b与KLF-4表达呈负相关(r=-0.344,P<0.01)。结论骨肉瘤组织miR-133b表达降低; miR-133b可能通过下调KLF-4表达而参与骨肉瘤的发生、发展。
骨肉瘤;微小RNA-133b;Kruppel样因子4;细胞增殖
骨肉瘤是儿童和青少年常见的原发恶性骨肿瘤,具有转移早、预后差、生存率低等特点。虽然近几年辅助化疗和新辅助化疗的应用大大提高了患者的生存率,但是现有化疗药物的毒副作用使许多患者无法坚持化疗,最终发生肿瘤转移或者复发。因此,寻求一种有效的抗骨肉瘤细胞增殖的靶向药物对于改善患者预后具有重要意义。研究证实,微小RNA(miRNAs)对离体骨肉瘤细胞的增殖和侵袭具有重要的调控作用[1],其中研究较多的miRNAs包括miR-133b、miR-451、miR-15a、miR-646、miR-218、miR-449a[2~7]。但是目前为止,这6种miRNAs在骨肉瘤领域的研究都局限于细胞实验,在人体骨肉瘤组织中的表达情况及其作用机制尚未阐明。为此,我们于2013年1月~2015年12月进行了如下研究。
1 资料与方法
1.1 临床资料 选择淄博市第一医院行骨肉瘤切除术患者的骨肉瘤组织及肉瘤旁正常骨组织(简称正常骨组织)各32例份,均经病理证实。患者男20例、女12例,年龄12~43(23.0±4.6)岁。本研究通过医院伦理委员会审核,患者及其监护人均签署知情同意书。
1.2 组织miRNAs检测 采用荧光定量PCR法。取骨肉瘤组织及正常骨组织,研磨后加入裂解液,TRIzol试剂提取组织中的总RNA,并逆转录合成cDNA。反应体系20 μL,反应条件:16 ℃、30 min,45 ℃、30 min,85 ℃、5 min。采用SYBR Green荧光定量PCR法检测miR-133b、miR-451、miR-15a、miR-646、miR-218、miR-449a表达,引物序列均由上海吉凯生物公司设计合成。PCR反应条件:94 ℃、15 min,94 ℃、30 s,60 ℃、30 s,72 ℃、30 s,共循环40次;最后72 ℃延伸8 min。每组样品重复3次,试验重复3次。以GAPDH为内参,采用2-ΔΔCt法计算上述miRNAs相对表达量。
1.3 组织中增殖相关蛋白及Kruppel样因子4(KLF-4)表达检测 采用Western blotting法。取骨肉瘤组织及正常骨组织,提取总蛋白,BCA法进行蛋白定量。进行SDS-PAGE电泳,每孔加入30 μL样品,70 V、30 min进行蛋白浓缩,100 V、2 h进行蛋白电泳。用孔径为0.45 μm的PVDF膜进行转膜,常温下TBST洗膜3次、封闭1 h,分别加入兔(鼠)抗人p21一抗(或抗p27、PCNA、Ki67、KLF-4、GAPDH一抗,工作液浓度均为1∶1 000,英国Abcam公司),4 ℃孵育过夜。常温下TBST洗膜3次,加入辣根过氧化物酶标记羊抗兔(鼠)二抗(美国Jackson公司),孵育后进行ECL化学发光。柯达胶片暗室显影,采用Quantity One软件分析各条带灰度值。以GAPDH为内参,采用目的蛋白与GAPDH灰度值的比值计算其蛋白相对表达量。

2 结果
2.1 骨肉瘤组织及正常骨组织miRNAs表达比较 见表1。
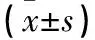
表1 骨肉瘤组织及正常骨组织miRNAs相对表达量比较
注:与正常骨组织比较,*P<0.01。
2.2 骨肉瘤组织及正常骨组织细胞增殖相关蛋白及KLF-4蛋白表达比较 见表2。
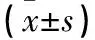
表2 骨肉瘤组织及正常骨组织细胞增殖相关蛋白及KLF-4蛋白相对表达量比较
注:与正常骨组织比较,*P<0.01。
2.3 骨肉瘤组织miR-133b与KLF-4表达的关系 Spearman相关分析结果显示,骨肉瘤组织中miR-133b与KLF-4表达呈负相关(r=-0.344,P<0.01)。
3 讨论
恶性肿瘤的基本生物学特征是增殖和转移,不仅与肿瘤细胞的侵袭性增强、黏附能力下降有关,还与肿瘤血管生成、细胞外基质降解及间质重构等密切相关[8]。因此,抑制肿瘤细胞增殖对其治疗有重要意义。miRNAs是一类高度保守的非编码小分子单链RNA,越来越多的证据显示其参与了对肿瘤细胞迁移、侵袭和细胞表型的调控[9]。Yuan等[3]研究发现,miR-451可以抑制骨肉瘤细胞的增殖和迁移;Tian等[4]研究发现,miR-15a是通过抑制TNFAIP1的表达而发挥抑制骨肉瘤细胞增殖、迁移的作用;最近Sun等[5]研究发现,miR-646可以通过下调成纤维细胞生长因子2(FGF-2)的表达而抑制骨肉瘤细胞的侵袭。miR-133b已被证实是一种抑癌miRNAs,可调节多种与肿瘤生长、转移、侵袭有关的抑癌基因或蛋白,从而发挥抑制肿瘤进展的作用[10,11]。Duan等[12]检测了31例份结肠癌组织和癌旁正常结肠组织中几种miRNAs表达,发现miR-133b在结肠癌组织中表达降低。最近研究证实,miR-133b可以调控卵巢癌细胞、恶性胶质瘤细胞的增殖和侵袭,并与患者预后密切相关[13]。Guo等[14]研究发现,miR-133b可以通过下调FSCN1而抑制胃癌细胞的增殖和侵袭。p21和p27是与细胞周期有关的抑癌基因,p21、p27表达减少可以导致细胞的增殖能力增强;PCNA、Ki67是与细胞增殖有关的蛋白,其表达升高可导致细胞增殖能力增强。本研究结果显示,骨肉瘤组织miR-133b表达明显低于正常骨组织,其p21、p27表达均降低,PCNA、Ki67表达均升高;说明miR-133b表达异常与骨肉瘤细胞的增殖有关。
KLF-4是真核锌指蛋白转录因子,在细胞增殖分化、血管生成和肿瘤转移进展等多种生理、病理过程中具有重要作用[15]。研究显示,在肺癌、前列腺癌、结肠癌和胃癌等上皮源性肿瘤中KLF-4表达升高,表明KLF-4表达异常与多种肿瘤的发生有关;且KLF-4表达与患者的预后相关,可作为肿瘤靶向治疗的一个靶位点[16]。Chang等[17]研究显示,miR-7是通过抑制KLF-4/PI3K/AKT/P21信号通路而抑制前列腺癌细胞的增殖。本研究结果显示,骨肉瘤组织KLF-4蛋白表达升高,与miR-133b的表达呈负相关,推测miR-133b可能通过抑制KLF-4的表达而抑制骨肉瘤细胞的增殖。
综上所述,骨肉瘤组织miR-133b表达降低;miR-133b可能通过下调KLF-4表达而参与骨肉瘤的发生、发展。KLF-4是否是miR-133b的靶基因及其具体调控机制仍需进一步研究。
[1] Song JH, Meltzer SJ. MicroRNAs in pathogenesis, diagnosis, and treatment of gastroesophageal cancers[J]. Gastroenterology, 2012,143(1):35-47.
[2] Novello C, Pazzaglia L, Cingolani C, et al. miRNA expression profile in human osteosarcoma: role of miR-1 and miR-133b in proliferation and cell cycle control[J]. Int J Oncol, 2013,42(2):667-675.
[3] Yuan J, Lang J, Liu C, et al. The expression and function of miRNA-451 in osteosarcoma[J]. Med Oncol, 2015,32(1):324.
[4] Tian X, Zhang J, Yan L, et al. MiRNA-15a inhibits proliferation, migration and invasion by targeting TNFAIP1 in human osteosarcoma cells[J]. Int J Clin Exp Pathol, 2015,8(6):6442-6449.
[5] Sun XH, Geng XL, Zhang J, et al. miRNA-646 suppresses osteosarcoma cell metastasis by downregulating fibroblast growth factor 2 (FGF2)[J]. Tumour Biol, 2015,36(3):2127-2134.
[6] Jin J, Cai L, Liu ZM, et al. miRNA-218 inhibits osteosarcoma cell migration and invasion by down-regulating of TIAM1, MMP2 and MMP9[J]. Asian Pac J Cancer Prev, 2013,14(6):3681-3684.
[7] Chen J, Zhou J, Chen X, et al. miRNA-449a is downregulated in osteosarcoma and promotes cell apoptosis by targeting BCL2[J]. Tumour Biol, 2015;36(10):8221-8229.
[8] Yio X, Diamond M, Zhang JY, et al. Trefoil factor family-1 mutations enhance gastric cancer cell invasion through distinct signaling pathways[J]. Gastroenterology, 2006,130(6):1696-1706.
[9] Zhao Y, Samal E, Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature, 2005,436(7048):214-220.
[10] Yao C, Sun M, Yuan Q, et al. MiRNA-133b promotes the proliferation of human Sertoli cells through targeting GLI3[J]. Oncotarget, 2016,7(3):2201-2219.
[11] Lv LV, Zhou J, Lin C, et al. DNA methylation is involved in the aberrant expression of miR-133b in colorectal cancer cells[J]. Oncol Lett, 2015,10(2):907-912.
[12] Duan FT, Qian F, Fang K, et al. miR-133b, a muscle-specific microRNA, is a novel prognostic marker that participates in the progression of human colorectal cancer via regulation of CXCR4 expression[J]. Mol Cancer, 2013,12:164.
[13] Chang L, Lei X, Qin YU, et al. MicroRNA-133b inhibits cell migration and invasion by targeting matrix metalloproteinase 14 in glioblastoma[J]. Oncol Lett, 2015,10(5):2781-2786.
[14] Guo L, Bai H, Zou D, et al. The role of microRNA-133b and its target gene FSCN1 in gastric cancer[J]. J Exp Clin Cancer Res, 2014,33:99.
[15] Liao X, Zhang R, Lu Y, et al. Kruppel-like factor 4 is critical for transcriptional control of cardiac mitochondrial homeostasis[J]. J Clin Invest, 2015,125(9):3461-3476.
[16] Mao Q, Quan T, Luo B, et al. MiR-375 targets KLF4 and impacts the proliferation of colorectal carcinoma[J]. Tumour Biol, 2016,37(1):463-471 .
[17] Chang YL, Zhou PJ, Wei L, et al. MicroRNA-7 inhibits the stemness of prostate cancer stem-like cells and tumorigenesis by repressing KLF4/PI3K/Akt/p21 pathway[J]. Oncotarget, 2015,6(27):24017-24031.
魏传银(E-mail: weichuanyin1967@163.com)
10.3969/j.issn.1002-266X.2016.48.021
R738.3
B
1002-266X(2016)48-0063-03

