猪链球菌2型实时荧光定量PCR检测方法的建立与应用
李建达,于 江,张玉玉,任素芳,陈 蕾,郭立辉,孙文博,陈 智,王 淞1,,刘俊珍,杜以军,李 俊,杨灵芝,王金宝1,*,吴家强*
(1.青岛农业大学动物科技学院,青岛266109;2.山东省农业科学院畜牧兽医研究所,济南250100;3.山东滨州沃华生物工程有限公司,滨州256600)
猪链球菌2型实时荧光定量PCR检测方法的建立与应用
李建达1,2§,于 江2§,张玉玉2,任素芳2,陈 蕾2,郭立辉2,孙文博2,陈 智2,王 淞1,2,刘俊珍2,杜以军2,李 俊2,杨灵芝3,王金宝1,2*,吴家强2*
(1.青岛农业大学动物科技学院,青岛266109;2.山东省农业科学院畜牧兽医研究所,济南250100;3.山东滨州沃华生物工程有限公司,滨州256600)
摘 要:试验根据猪链球菌2型荚膜多糖(CPS)抗原设计CPS2J基因特异性引物,建立猪链球菌2型实时荧光定量PCR检测方法。结果显示,该方法的标准曲线为y=-3.073x+36.87,r=0.995,熔解曲线只有单一的特异峰。敏感性试验显示,该方法可以检测出模板最低浓度为1.0×101拷贝/μL,是普通PCR的10倍;特异性试验显示,对猪链球菌2型具有良好的特异性,能够区分其他血清型猪链球菌和其他细菌;重复性试验变异系数为0.37%~0.63%,均低于2.5%。临床检测显示该方法的敏感性明显高于常规PCR方法和细菌分离的方法。以上结果表明,本研究建立的方法敏感性高、特异性强、重复性好,有利于对猪链球菌2型的快速检测。
关键词:猪链球菌2型;实时荧光定量PCR;敏感性;特异性;重复性
猪链球菌(Streptococcussuis)是一种危害严重的人兽共患病病原菌,临床上以引起猪脑膜炎、关节炎、心内膜炎、败血症和突发死亡等症状为主。至今,已鉴定出35个血清型(1~34型及1/2型)[1]。引起猪发病的主要血清型是1、2、7、9型,其中2型不仅致病性强,而且流行较为广泛。1991年中国广东省首次报道了猪链球菌2型病的发生;1998—1999年夏季江苏省部分猪群暴发此病,严重威胁人畜健康[2];2005年7月四川资阳暴发猪链球菌2型病并引起人员死亡[3]。目前,常规的细菌分离、抗体检测不易区分猪链球菌的血清型。普通PCR无法对病料细菌进行定量检测,而且会出现假阳性。实时荧光定量PCR不仅敏感性高、特异性强、易于操作,而且结果准确、直观,并具有实时定量性,已经广泛用于病原微生物的检测[4]。荚膜多糖(CPS)是猪链球菌的毒力因子[5-6],CPS对猪链球菌2型的侵袭力有决定性作用,可以在未免疫动物体内产生具有抗吞噬活性的抗体,保护细菌不被巨噬细胞吞噬[7-8]。CPS2J是猪链球菌2型CPS中一段高度保守的序列,本试验以CPS2J基因为靶基因设计引物,建立猪链球菌2型SYBR GreenⅠ实时荧光定量PCR检测方法,为实现对猪链球菌2型的快速诊断和定量分析提供科学方法。
1 材料与方法
1.1菌株
猪链球菌2型、猪链球菌7型、副猪嗜血杆菌、猪巴氏杆菌、猪传染性胸膜肺炎杆菌、金黄色葡萄球菌菌株均由山东省农业科学院畜牧研究所实验室分离鉴定保存;马兽疫链球菌菌株购自中国兽医微生物菌种保藏管理中心(CVCC)。
1.2主要试剂及仪器
SYBR?Premix ExTaqTMⅡ、TaqDNA聚合酶、dNTP、DL2000DNA Marker、pMD18-T载体等均购自宝生物工程(大连)有限公司;Trans-T1感受态细胞购自北京全式金生物技术有限公司;PCR产物回收纯化试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司。NanoDrop2000超微量分光光度计购自Thermo Fisher Scientific公司;Light-Cycler?480Ⅱ购自Roche公司。
1.3引物设计与合成
根据猪链球菌2型荚膜抗原基因簇CPS2J基因(GenBank登录号:AF118389)序列,利用Primer Premier 5.0软件设计引物,引物序列为:CPS2J(P1):5′-GAAAAAGTCAGCATTATTGTACCTATT-3′;CPS2J(P2):5′-CTGAAGAACCGTCATCTATCAAAAG-3′,预计扩增目的片段为124bp。引物由上海生工生物工程技术服务有限公司合成。
1.4常规PCR扩增
采用直接煮沸法提取猪链球菌2型DNA,PCR反应体系25μL:10×Buffer(含Mg2+)2.5μL,dNTP 2μL,上、下游引物各1μL,TaqDNA聚合酶0.5μL,DNA模板2μL,ddH2O 16μL。PCR反应程序:95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸45s,34个循环;72℃再延伸10min。反应结束后,用5μL PCR产物进行1.5%琼脂糖凝胶电泳检测。
1.5质粒标准阳性模板的制备
1.5.1PCR产物的纯化回收及克隆鉴定 将鉴定正确的PCR产物用PCR产物回收试剂盒纯化提取目的片段。将目的片段连接pMD18-T载体,转化Trans-T1感受态细胞,在LB培养基(含Amp,100μg/mL)中培养,而后挑取阳性菌落进行单克隆培养,提取质粒进行PCR、酶切鉴定,并将阳性质粒送于上海生工生物工程技术服务有限公司测序。
1.5.2重组质粒浓度测定与标准样品的制备用紫外分光光度计测定阳性质粒的浓度,计算拷贝数,并将质粒浓度稀释到1.0×1010拷贝/μL,再倍比稀释至1.0×105拷贝/μL,用以上稀释度作为标准样品模板,-20℃保存备用。
1.6实时荧光定量PCR方法的建立
PCR反应体系为20μL:SYBR Premix ExTaqⅡ用量范围为8~12μL,引物范围为0.5~1μL,模板用量范围为1~2μL。退火温度选用范围为58~60℃。对SYBR Premix Ex TaqⅡ、引物和模板的浓度进行筛选,优化反应条件。
1.7标准曲线的建立
分别以1.0×105~1.0×1010拷贝/μL 10倍倍比稀释的阳性质粒作为模板,进行实时荧光定量PCR,得出各自动力学曲线,通过仪器软件建立标准曲线。
1.8敏感性试验
分别以1.0×100~1.0×107拷贝/μL倍比稀释的样品作为模板,进行实时荧光定量PCR检测,同时用常规PCR进行检测,比较两种方法的敏感性。
1.9特异性试验
用建立的实时荧光定量PCR反应体系检测猪链球菌7型、马兽疫链球菌、副猪嗜血杆菌、猪巴氏杆菌、传染性胸膜肺炎杆菌、金黄色葡萄球菌,确定该方法的特异性。
1.10重复性试验
取1.0×108、1.0×105、1.0×103拷贝/μL的标准样品,每组重复3次,进行实时荧光定量PCR检测,并计算每个稀释度的变异系数。
1.11临床样品检测
对24头临床症状疑似猪链球菌2型的病猪,采集关节液、心包液、肺脏、肝脏、心血,分别用细菌分离培养、常规PCR、实时荧光定量PCR检测,并对试验结果进行比较。
2 结果与分析
2.1目的片段的克隆及鉴定
将回收的PCR产物与pMD18-T载体连接,获得重组质粒,进行常规PCR扩增,得到一条124bp的条带(图1),与目的片段大小一致。重组质粒测序结果与目的片段序列完全一致。
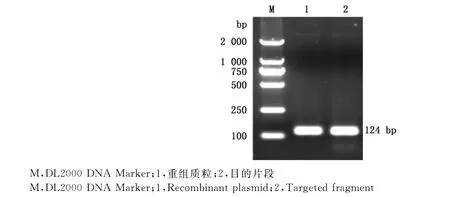
图1 PCR扩增目的片段Fig.1 PCR amplification of targeted fragment
2.2实时荧光定量PCR方法的建立
优化后的实时荧光定量PCR反应体系为20μL:SYBR Premix Ex TaqⅡ10μL,上、下游引物各1μL,模板2μL,ddH2O 6μL。实时荧光定量PCR反应条件:95℃预变性30s;95℃变性5s,60℃退火20s,72℃延伸30s,40个循环。熔解曲线见图2。由图2可知,所有阳性质粒只出现一种荧光峰,峰型单一,没有杂峰,说明引物设计合理。
2.3标准曲线的建立
以标准品拷贝数对数值为横坐标,Ct值为纵坐标建立标准曲线,结果见图3。由图3可知,标准曲线方程为:y=-3.073x+36.87,r=0.995,表明相关程度极高且呈正相关。
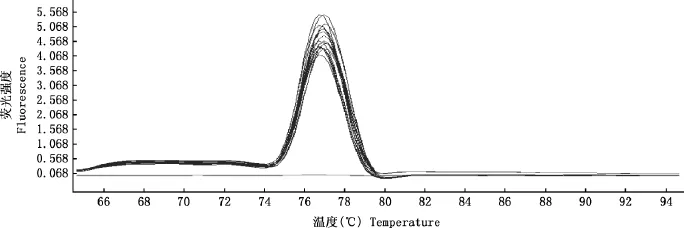
图2 熔解曲线Fig.2 Melting curve

图3 标准曲线Fig.3 Standard curve
2.4敏感性试验
将阳性质粒依次倍比稀释作为模板,一般认为Ct值>35时计为阴性,实时荧光定量PCR反应结果见图4,常规PCR扩增结果见图5。由图4可知,此方法可检测出模板最低浓度为1.0×101拷贝/μL,而常规PCR可以检测出模板最低浓度为1.0×102拷贝/μL(图5),说明实时荧光定量PCR的敏感性比常规PCR高10倍。
2.5特异性试验
以马兽疫链球菌、猪链球菌7型、副猪嗜血杆菌、猪巴氏杆菌、猪传染性胸膜肺炎杆菌、金黄色葡萄球菌为模板进行实时荧光定量PCR,检测结果(Ct值>35时,计为阴性)均为阴性(图6),表明本试验方法具有较高的特异性。
2.6重复性试验
由表1可知,1.0×108、1.0×105、1.0×103拷贝/μL的标准样品的变异系数分别为0.63%、0.37%和0.59%,均低于2.5%,说明该方法具有良好的稳定性和重复性。
2.7临床样品检测
对24头临床症状疑似猪链球菌2型的病猪分别进行细菌分离、常规PCR、实时荧光定量PCR检测,结果见表2。由表2可知,实时荧光定量PCR的敏感性高于常规PCR,且明显高于细菌分离方法。所得检测结果经国标法(GB 19915.7—2005)复检,实时荧光定量PCR检测与国标法的检测结果一致率达100%。

图4 实时荧光定量PCR敏感性试验Fig.4 Sensibility tests of quantitative Real-time PCR

图5 常规PCR敏感性试验Fig.5 Sensibility tests of PCR

图6 实时荧光定量PCR特异性试验Fig.6 Specialty tests of quantitative Real-time PCR

表1 实时荧光定量PCR重复性试验Table 1 Repeatability test of quantitative Real-time PCR

表2 临床样品检测Table 2 The test of clinical samples
3 讨 论
猪链球菌2型是猪链球菌中毒力最强、危害最严重、流行最广泛的血清型之一[9-10]。猪链球菌可定植于健康猪的扁桃体内,带菌率高达42.6%[11],而随着猪繁殖与呼吸综合征(PRRS)和猪圆环病毒病(PCV)等免疫抑制性疾病的流行,导致猪链球菌2型感染率明显上升[12-14]。
目前,检测该菌的方法主要是细菌分离鉴定和常规PCR检测,细菌分离鉴定方法不仅耗时、易污染,而且不易区分猪链球菌的血清型[14]。常规PCR方法虽然能够检测出猪链球菌2型,具有较高的特异性,但操作时间长、操作繁琐、敏感性低,而且存在假阳性的可能[15]。本试验建立了猪链球菌2型实时荧光定量PCR检测方法,不仅操作简单快速、不易出现假阳性,而且可以对样品进行定量分析[16],对临床的诊断和检测具有指导性意义。
CPS是唯一被证明的猪链球菌2型主要的毒力因子,在细菌致病过程中起着重要作用,有研究表明,缺失CPS基因的变异株完全丧失毒力,能很快被清除[17-19]。CPS对猪链球菌2型的侵入有决定性作用,可以在未免疫动物体内产生具有抗吞噬活性功能的抗体,保护细菌不被吞噬[20]。荚膜的存在降低了猪链球菌被吞噬的程度,有研究表明缺失荚膜多糖的菌株疏水性增强,更容易被吞噬[21-22]。CPS2J基因是猪链球菌2型荚膜抗原基因簇,序列高度保守,与其他血清型同源性低。本试验选取CPS2J为靶基因设计引物,通过构建质粒,将倍比稀释的阳性质粒作为实时荧光定量PCR模板,建立了猪链球菌2型实时荧光定量PCR检测方法。利用建立的方法对其他不同血清型的猪链球菌和其他细菌进行检测,结果显示,只有猪链球菌2型有扩增曲线,表明该方法具有较高的特异性;重复性试验结果表明,3组变异系数均低于2.5%,说明该方法具有较好的重复性。该方法可以检测出最低浓度为1×101拷贝/μL,敏感性优于普通PCR。
4 结 论
本试验通过优化荧光定量PCR反应体系,建立了重复性较好的标准曲线,成功建立了猪链球菌2型实时荧光定量PCR检测方法,该方法有较高的特异性、重复性和敏感性,对猪链球菌2型的快速检测及猪链球菌防控有重要意义。
参考文献:
[1] Wang K,Fan W,Cai L,et al.Genetic analysis of the capsular polysaccharide synthesis locus in 15Streptococcussuisserotypes[J].MolMicrobiol,2011,79(6):1670-1683.
[2] Choi S M,Cho B H,Choi K H,et al.Meningitis caused byStreptococcussuis:Case report and review of the literature[J].ClinNeurol,2012,8:79-82.
[3] 张超颖,徐玉花,蒋春燕.2型猪链球菌病的研究进展[J].畜禽业,2015,3:20-22.
[4] Tang Y,Zhang X,Wu W,et al.Inactivation of thesodagene ofStreptococcussuistype 2encoding superoxide dismutase leads to reduced virulence to mice[J].VetMicrobiol,2012,158(3-4):360-366.
[5] Srinivasan V,McGee L,Njanpop-Lafourcade B M,et al.Species-specific real-time PCR assay for the detection ofStreptococcussuisfrom clinical specimens[J].DiagnMicrobiolInfectDis,2016,85(2):131-132.
[6] Madsen L W,Svensmark B,Elvestad K,et al.Streptococcussuisserotype 2infection in pigs:New diagnostic and pathogenetic aspects[J].ComparativePathology,2002,126(1):57-65.
[7] Ju Y,Hao H J,Xiong G H,et al.Development of colloidal gold-based immunochromatographic assay for rapid detection ofStreptococcussuisserotype 2[J].VetImmunolImmunopathol,2010,133(2-4):207-211.
[8] Calzas C,Lemire P,Auray G,et al.Antibody response specific to the capsular polysaccharide is impaired inStreptococcussuisserotype 2-infected animals[J].InfectImmun,2015,83(1):441-453.
[9] Liu Z,Zheng H,Gottschalk M,et al.Development of multiplex PCR assays for the identification of the 33 serotypes ofStreptococcussuis[J].PLoSOne,2013,8(8):e72070.
[10] 王楷宬,赵 峡,陆承平,等.猪链球菌1、2、14、1/2型荚膜多糖的单糖组成比较[J].微生物学报,2014,6:656-662.
[11] Sriskandan S,Slater J.Invasive disease and toxic shock due to zoonoticStreptococcussuis:An emerging infection in the east[J].PLoSMed,2006,3(5):e187.
[12] Shen X,Zhong Q,Zhao Y,et al.Proteome analysis of the two-component SalK/SalR system in epidemicStreptococcussuisserotype 2[J].CurrMicrobiol,2013,67:118-122.
[13] 郎需龙,冉会玲,王秀然,等.猪链球菌2型分解代谢控制蛋白A经NF-κB/MAPK通路对巨噬细胞RAW264.7影响的研究[J].中国畜牧兽医,2013,40(7):21-24.
[14] 高 巍,韩文瑜,雷连成,等.猪链球菌2型的分离与鉴定[J].中国生物制品学杂志,2007,6:447-449.
[15] 李逢慧,罗 超,程天印.猪链球菌2型CPS2J基因PCR检测技术研究进展[J].动物医学进展,2008,7:79-81.
[16] Huggett J F,Novak T,Garson J A,et al.Differential susceptibility of PCR reactions to inhibitors:An important and unrecognised phenomenon[J].BMCRes Notes,2008,1:70.
[17] Goyette-Desjardins G,Calzas C,Shiao T C,et al.Protection againststreptococcussuisserotype 2infection using a capsular polysaccharide glycoconjugate vaccine[J].InfectionandImmunity,2016:84(7):2059-2075.
[18] Liu J,Tian Z Y,Xiao Y C,et al.The role of porcine monocyte derived dendritic cells(MoDC)in the inflammation storm caused byStreptococcussuisserotype 2infection[J].PLoSOne,2016,11(3):e0151256.
[19] Gao T,Tan M,Liu W,et al.GidA,a tRNA modification enzyme,contributes to the growth,and virulence ofStreptococcussuisserotype 2[J].FrontCellInfect,2016,6:44.
[20] 梅京京,汪 洋,易 力,等.OCT蛋白对猪链球菌生物被膜形成和细胞黏附的影响[J].中国兽医科学,2016,2:192-197.
[21] Zhang Y,Ding D,Liu M,et al.Effect of the glycosyltransferases on the capsular polysaccharide synthesis ofStreptococcussuisserotype 2[J].Microbiological Research,2016,185:45-54.
[22] Bai X,Liu Z,Ji S,et al.Simultaneous detection of 33Streptococcussuisserotypes using the luminex xTAG?assayTM[J].MicrobiologicalMethods,2015,117:95-99.
(责任编辑 姚倩倩)
中图分类号:S858.28
文献标识码:A
文章编号:1671-7236(2016)12-3107-07
doi:10.16431/j.cnki.1671-7236.2016.12.004
收稿日期:2016-05-18
基金项目:泰山学者特聘专家工程经费;山东省现代农业产业技术体系(SDAIT);山东省农业科学院重大科技成果培育计划(2014CGPY04);山东省农业重大应用技术创新项目;山东省自然科学基金(ZR2015YL078);山东省农业科学院青年科研基金(2015YQN51);山东省农业科学院农业科技创新工程项目(CXGC2016B14)
作者简介:李建达(1992-),男,山东济南人,硕士生,研究方向:动物微生物与免疫学,E-mail:ljd4453@163.com于 江(1985-),女,山东莱州人,博士,研究方向:动物微生物与免疫学,E-mail:yujiang_2213@163.com李建达和于江对本文具有同等贡献,并列为第一作者
通信作者:*王金宝(1962-),男,山东昌邑人,教授,博士生导师,研究方向:动物病原学与免疫学,E-mail:wangjb@saas.ac.cn吴家强(1975-),男,山东诸城人,博士,研究员,研究方向:动物病原学与免疫学,E-mail:wujiaqiang2000@sina.com
Establishment and Application of Quantitative Real-time PCR Method to DetectStreptococcussuisSerotype 2
LI Jian-da1,2§,YU Jiang2§,ZHANG Yu-yu2,REN Su-fang2.CHEN Lei2,GUO Li-hui2,SUN Wen-bo2,CHEN Zhi2,WANG Song1,2,LIU Jun-zhen3,DU Yi-jun2,LI Jun2,YANG Ling-zhi3,WANG Jin-bao1,2*,WU Jia-qiang2*
(1.CollegeofAnimalScienceandTechnology,QingdaoAgriculturalUniversity,Qingdao266109,China;2.InstituteofAnimalScienceandVeterinaryMedicine,ShandongAcademyofAgriculturalSciences,Jinan250100,China;3.WohuaBiotechCo.,Ltd.,Binzhou256600,China)
Abstract:In this study,aquantitative Real-time PCR method using the specific primers according toCPS2Jgene was established to detectStreptococcussuisserotype 2.The result showed that the equation of standard curve was y=-3.073x+36.87,r=0.995,which demonstrated that the assay had good linear relationship.The melting curve analysis showed that there was only specific peak.Sensitivity test showed that the method could detect the template at the lowest concentration of 1.0×101copies/μL,which was 10times higher than the ordinary PCR.The specific tests showed that this method could able to detectStreptococcussuisserotype 2specially and had nocross-reaction with other serotypes or other bacteria from swine.The CV of repeatability test was 0.37%to 0.63%,lower than 2.5%.The clinical diagnosis showed this assay was more sensitive than ordinary PCR and bacteria isolation.All the results showed that the established method was sensitive,specific and reproducible,which could be used for the rapid diagnosis and quantitative detection ofStreptococcussuisserotype 2.
Key words:Streptococcussuisserotype 2;quantitative Real-time PCR;sensibility;specificity;repeatability

