化工热力学在化工工艺课程设计中的应用
王菊 吴现力 杜春华

摘要:化工热力学是化学工程的重要组成部分。如何使学生真正理解和掌握化工热力学模型在解决化工过程实际问题中的应用一直是化工热力学教学过程中的难题。将化工热力学的教学与后续的化工工艺课程设计结合起来,通过课程设计的训练强化热力学模型的应用,使学生真正体会到化工热力学对解决工程问题的指导意义。
关键词:化工热力学;化工工艺课程设计;模型应用
中图分类号:G424.1 文献标志码:A 文章编号:1674-9324(2016)08-0203-02
化工热力学是化学工程学的一个重要分支,是化学工程与工艺专业必修的专业课程。化工热力学上接物理化学中的热力学部分,下连化工工艺学、分离工程、反应工程、化工设计等课程,是化工过程研究、开发与设计的理论基础,是一门理论性与应用性均较强的课程,其重要性不言而喻。然而,化工热力学理论概念严谨、抽象,涉及到的公式纷繁复杂,学生很容易“淹没”在烦琐的公式推导及计算过程中,不能真正理解化工热力学对解决工程问题的重要性。
化工工艺课程设计是化学工程与工艺专业本科生在修完化工工艺学后进行的一次综合设计训练,是培养学生独立完成某一化工产品设计的基本技能,分析和解决实际问题能力的重要教学环节[1]。
将化工热力学的相关知识综合应用到化工工艺课程设计中,不仅能让学生真正理解和掌握热力学研究和处理问题的基本方法,还能培养学生运用所学知识解决实际问题的能力,培养学生的工程意识,提高设计质量。笔者认为在化工工艺课程设计中可强化以下几方面的应用。
一、流体的p-V-T关系
流体的p-V-T关系是化工热力学的基石,利用流体的p-V-T数据和基本关系式可计算不能直接从实验测得的其他性质,如焓、内能、熵、自由焓等。此外,流体的p-V-T关系可直接用于设计。
1.利用流体的p-V-T关系计算物料密度。在化工工艺课程设计中经常涉及到管道直径的选取和间歇反应釜体积的估算,这些计算都需要所处理物料的密度。对于常规物质,如水、空气、氨和氟利昂等的p-V-T数据可直接通过查手册获得。对于不常见的物质以及高温高压下的体系,数据的查找就比较困难了。而热力学提供了多种计算流体的p-V-T关系的方法,如状态方程和普遍化关系式。
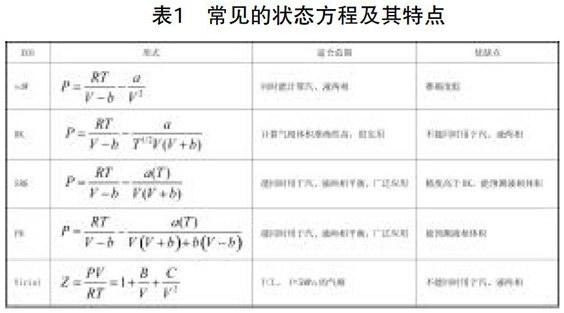
利用状态方程可精确地代表相当广范围内的p-V-T数据。每一个状态方程都有它的特点和应用范围。在进行设计时,要根据处理物系的特点,如温度、压力、极性等以及所要求的计算精度选择适合的方程进行计算。常见的状态方程及其特点见表1。
若计算气体体积,SRK和PR是大多数流体的首选。无论压力、温度、极性如何,它们能基本满足精度要求,在工业上已广泛使用。在没有计算软件又需要快速估算的情况下,可以使用普遍化方程。
若只是计算液体体积,直接用修正的Rackett方程既简单精度又高,不需要用立方型状态方程来计算。
在化工生产中,更常见的物系是多组分的混合物。在处理混合物时要根据采用的计算方法选用适当的混合规则。
2.利用流体的p-V-T关系计算焓、熵。热量衡算是化工设计中极其重要的组成部分。通过热量衡算可以确定过程中需要供给或移走的热量,从而为换热器的设计提供依据,同时也为反应器、结晶器、塔式设备、分离设备及各种控制仪表提供参数,并确定单位产品的能耗指标等[2]。焓是热量衡算的关键数据,熵主要用于衡量过程的能量有效利用率。利用流体的p-V-T数据,结合理想气体的热容模型CPig,可通过热力学基本关系式计算焓和熵。
焓的基本关系式:dH=C dT+V-T ?摇 dp
熵的基本关系式:dS=C - dP
理想气体的热容:C =a+bT+cT +dT
a、b、c、d为物性常数,可通过查手册获得。理想气体的CPig-T关联式,可用于低压下的真实气体,不能用于压力较高的真实气体。
计算真实气体的焓变和熵变需要引入剩余性质HR和SR,如下图所示。
ΔH=-H +ΔH +H =-H + (T -T )+H
ΔS=-S +ΔS +S =-S + ln -Rln +S
其中: = ?摇 =
剩余性质可用状态方程进行计算,也可根据Tr、Pr和ω用普遍化关系式进行估算。学生在完成课程设计时,考虑到课程设计时间紧、任务重,可用普遍化关系式估算。
二、相平衡
在所有化工热力学的研究内容中,相平衡占有无法比拟的重要地位。从某种意义上来说,在化工热力学的研究内容中,对“能量”和“组成”的研究是最为重要的部分,而所谓对于“组成”的研究,实质上就是指相平衡和化学平衡,尤以相平衡占有更重要的地位[3]。
相平衡包括很多具体的类型,仅常见的两相平衡就有汽液平衡、气液平衡、液液平衡和固液平衡。这些相平衡理论是化工生产中广泛采用的分离技术,如精馏、吸收、萃取、结晶等的理论和设计基础[4]。由于相平衡计算量较大,学生不可能通过手算完成。在教学中仅仅要求学生能够定性选择适用的方法。因此在课程结束以后,学生对于相平衡计算模型的印象不深,而且不可能全部理解。化工工艺课程设计是一个很好的利用相平衡模型进行应用计算的机会。以下以汽液平衡为例,介绍其在化工工艺课程设计中的应用。
汽液平衡是精馏过程分析和设计计算的重要依据。在化工工艺课程设计中经常涉及到精馏塔的设计计算,如二甲醚生产工艺设计中甲醇回收塔的设计计算。
对常压下操作的精馏塔,汽相可视为理想气体。甲醇—水体系液相为非理想溶液。汽液平衡关系式为:py =γ x p
在设计中可引导学生利用Wilson方程计算液相的活度系数,再利用操作压力和液相组成计算出相应的泡点温度和汽相组成,从而得出常压下甲醇—水体系的汽液平衡数据。根据汽液平衡数据绘出常压下的x-y图,为图解法计算理论塔板数提供依据。计算中需试差求解,可利用MathCAD[5]或Matlab[6]进行计算。
上述计算属于汽液平衡计算中已知体系的压力p与液相组成xi,求泡点温度T和汽相组成yi这一类型。在确定塔温时,可对汽液平衡计算进行反复练习,如根据操作压力和塔顶产品组成(塔顶采用全凝器)确定塔顶温度,属于已知体系的压力p与汽相组成yi,求露点温度T和液相组成xi这一类型。
又如二甲醚生产工艺设计中二甲醚精馏塔操作压力的计算。二甲醚在常压下的沸点是-24.9℃,如果想用普通冷却水冷凝塔顶产品,需要加压操作。先将塔顶温度设为45℃,根据塔顶温度和塔顶产品组成确定操作压力,属于已知体系的温度T与汽相组成yi,求露点压力p和液相组成xi这一类型。二甲醚精馏塔涉及二甲醚、水、甲醇三个组分,三组分为互溶体系,可用Wilson方程计算活度系数。由于是加压操作,需要对汽相进行校正,可用SRK或PR方程计算逸度系数。
通过以上训练,学生对汽液平衡计算的类型以及计算中涉及到的逸度和活度系数模型都有了深刻认识。
化工热力学是化工专业重要的专业基础课程之一。化工热力学给出的原理和方法在化工从业人员的整个职业生涯中,发挥了重要的指导作用,是深入理解化工过程实质的关键。化工热力学知识的教学是一个系统工程,仅通过一门课程的讲解是难以取得良好效果的。将化工热力学的相关知识应用于化工工艺课程设计中,为学生提供了一个很好的训练机会,帮助他们掌握了热力学重要模型的应用。
参考文献:
[1]朱佳媚,周敏,孟献梁,程相林,王月伦.提高《化工工艺学》课程设计教学质量的探讨[J].化工时刊,2013,27(1):47-49.
[2]陈声宗.化工设计[M].第1版.化学工业出版社,2001.
[3]陈明鸣,马沛生,夏淑倩,常贺英,李永红.相平衡——本科生化工热力学课程的核心内容[J].化学工业与工程,2005,22(11):17-19.
[4]陈钟秀,顾飞燕,胡望明.化工热力学[M].第3版.化学工业出版社,2011.
[5]吴选军.MathCAD在相平衡计算中的应用[J].化工高等教育,2009,(1):50-54.
[6]李克娥,苏铁军.Matlab在处理化工热力学数据中的应用[J].重庆科技学院学报(自然科学版),2005,7(3):100-102.

