乳腺实性乳头状癌临床病理分析
刘媛媛,张 伟,齐殿军,杨恩东,张学义
(1.抚顺矿务局总医院(中国医科大学第七临床医院) 病理科,辽宁 抚顺113008;
2.中国医科大学附属第一医院 全科医学科,辽宁 沈阳110001)
乳腺实性乳头状癌临床病理分析
刘媛媛1,张伟1,齐殿军2,杨恩东1,张学义1
(1.抚顺矿务局总医院(中国医科大学第七临床医院) 病理科,辽宁 抚顺113008;
2.中国医科大学附属第一医院 全科医学科,辽宁 沈阳110001)
(ChinJLabDiagn,2016,20:0060)
实性乳头状癌(Solid papillary carcinoma,SPC)由Maluf and Koerner等人命名[1],WHO将这组肿瘤列为导管内乳头状癌的实体变型,将其列为“导管内乳头状病变”中的一种独立的类型[2],并定义为:乳头状癌的独特类型,以致密排列、膨胀性生长、富于细胞的结节为特征,可见经典的浸润性生长,常伴有粘液和(或)神经内分泌特征,分原位/浸润两种类型,ICD-O编码分别为8509/2和8509/3。病理诊断时需要与具有和SPC相似的组织学特征的普通型导管上皮增生、包裹性乳头状癌及低级别导管原位癌等相鉴别[3]。我们收集了13例SPC通过进行常规组织学、免疫组化并结合文献分析其病理特点、鉴别诊断,以加深对该肿瘤的认识。
1材料与方法
1.1病例资料收集抚顺矿务局总医院病理科及中国医科大学附属第一院病理科2012年1月至2014年12月间确诊为乳腺实性乳头状癌的病例13例。13例乳腺SPC的患者均为女性,年龄50-80岁,平均63.7岁。肿物直径0.5-3 cm(平均1.5 cm),9例位于左乳,3例位于右乳,1例为双乳肿物。其中4例以乳头溢液为症状就诊,9例因体检发现或触及乳腺包块为症状就诊,没有患者出现类癌综合征或内分泌高活性异常。本组13例中6例行肿瘤完整切除,4例行乳腺单纯切除,3例行乳腺改良根治术,5例行腋窝淋巴结清扫术,淋巴结均未见转移。术后随访时间1-34个月(平均12个月),13例患者无瘤生存,均未见肿瘤复发及转移。
1.2方法①组织病理学观察:手术切除标本经10%福尔马林固定,石蜡包埋,4 μm厚连续切片,做HE和免疫组化染色,OLYMPUS BX51观察。②免疫组化检测:采用S-P法,高温高压抗原修复,DAB显色。选用ER、PR、C-erbB-2、Syn、CgA、CD56、E-cadherin、P63、SMA、CK5/6和Ki67等11种标记物染色,试剂均购自福州迈新生物技术开发有限公司。其中CgA、Syn、SMA、CK5/6阳性定位于胞质,CD56、C-erbB-2、E-cadherin阳性定位于胞膜,ER、PR、P63、Ki67阳性定位于胞核。Ki67的阳性指数的评估参照2011年乳腺癌Ki-67国际工作组推荐评估指南[4]:肿瘤细胞中阳性细胞分布较均匀的随机选取5个高倍视野(400×),肿瘤细胞中阳性细胞分布不均匀的,如肿瘤组织边缘与正常组织交界处出现高表达区则选取边缘区域高表达区的5个高倍视野,若高表达区域在肿瘤组织内则选取包括高表达区在内的5个高倍视野,每个视野下计数100个瘤细胞,阳性细胞百分比的平均值即阳性指数。
2结果
2.1大体肿瘤呈实性结节,边界较清晰,直径0.5-3 cm(平均1.5 cm),质地软的颜色暗红或黄褐色、质地中等稍韧的颜色灰白。其中一例伴有囊肿形成,囊内可见暗红色液体。
2.2镜检本组13例均可见肿瘤细胞在导管内呈实性膨胀性生长,形成边界较清晰的结节。实性区域内可见纤细的纤维血管轴心,细胞呈栅栏状排列,围绕血管轴心形成假菊形团样结构。瘤细胞多角形、卵圆形、梭形或印戒样,胞浆嗜酸性,细胞核居中或偏位,淡染,核仁小有时不明显。肿瘤细胞核轻度或中度非典型性,核分裂象<5个/10HPF。其中4例伴有细胞外粘液分泌,3例导管内可见肿瘤细胞Paget样扩散,1例出现浸润癌(乳腺浸润性导管癌Ⅱ级),2例伴微浸润可见病变纤维被膜外不规则成角的细胞巢。见图1-4。免疫组化结果见表1。
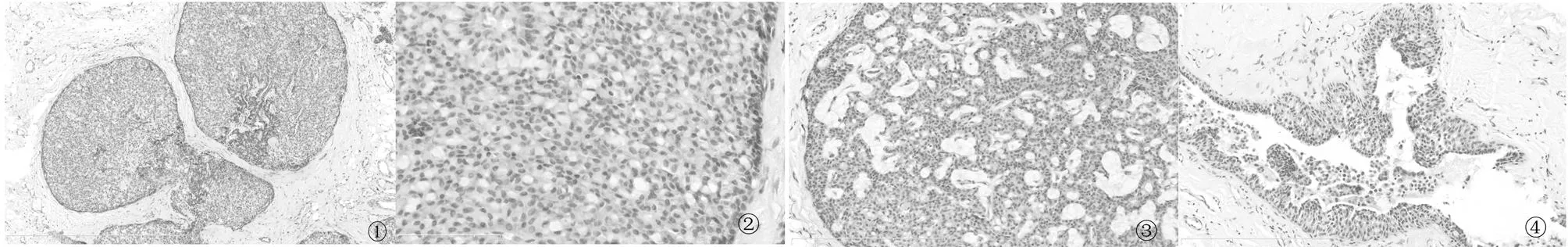
图1瘤细胞在导管内呈膨胀性图2实性区域内可见纤细的 图3肿瘤细胞间可见粘液分泌。 图4导管内可见肿瘤细胞
生长,充填整个导管腔,使纤维血管轴心,细胞呈栅HE×200Paget样扩散。HE×200
病变导管扩张形成圆形或栏状排列,围绕血管轴心
不规则形界限清楚的实性形成假菊形团样结构。
结节。HE×100肿瘤细胞内含有粘液,呈
印戒样改变。HE×400
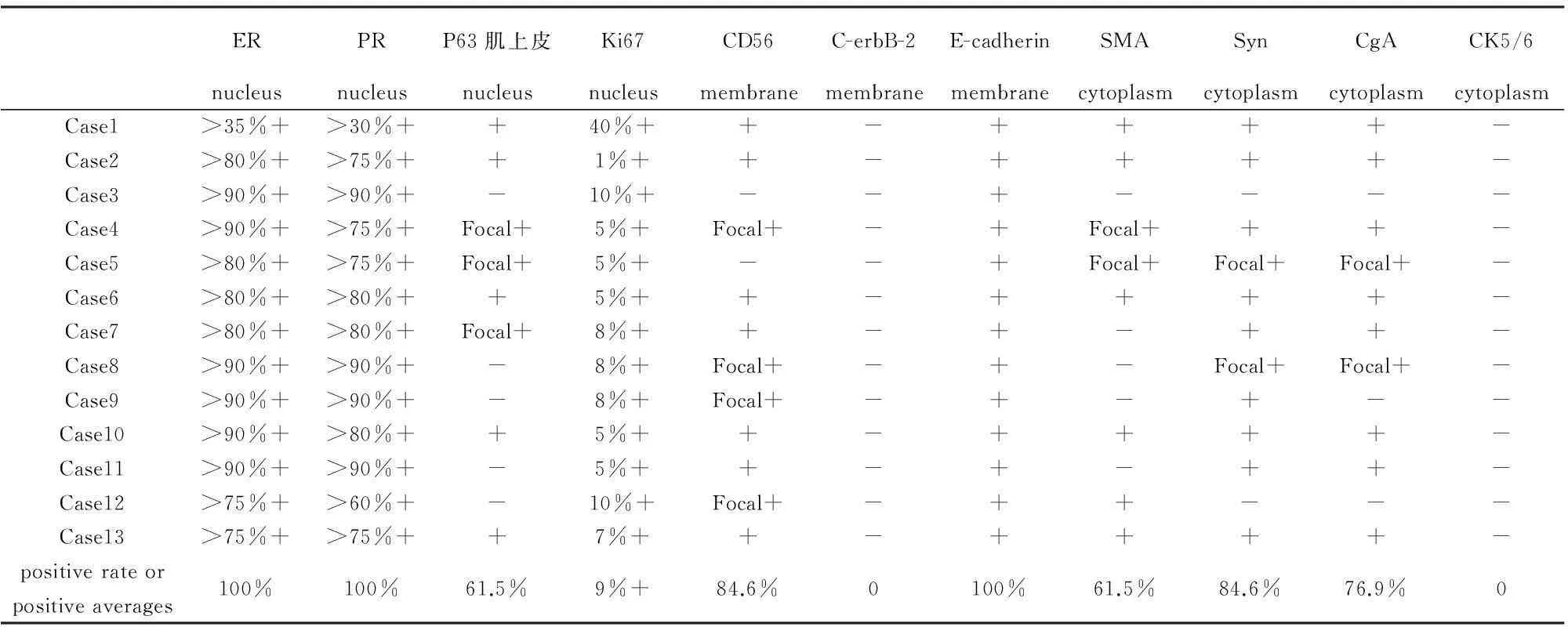
表1 免疫组化结果
3讨论
SPC是一种少见的特殊类型的乳腺癌,它仅占所有乳腺癌中的1.1-1.7%[5-7],通常发生于70岁以上的老年妇女[8],偶尔可发生在50岁以下的女性,极少数情况下也可发生于男性患者[9]。约80%左右SPC表达神经内分泌标记,部分SPC可伴发神经内分泌癌及粘液癌,是否提示其为神经内分泌癌及粘液癌的前驱病变,目前尚无定论。关于SPC的组织来源问题由于正常乳腺导管上皮是否存在神经内分泌细胞仍有争议,多数学者认为乳腺组织中没有神经内分泌细胞,推测SPC的组织来源是乳腺上皮干细胞发生恶性转化后出现神经内分泌分化。现将SPC的临床病理特征总结如下。
3.1临床表现患者多为绝经期后妇女,根据肿物的大小可出现乳腺X线异常或可触及乳腺包块,约有20-25%的病例可出现乳头血性溢液[2],SPC一般是无痛的,伴发浸润癌的时候除外[7]。本组13例患者中有4例出现乳头溢液但是没有血性溢液,13例患者均没有疼痛症状。多数肿瘤位于乳腺的中央区域,接近95%的SPC是单侧的[10],双乳SPC很少见,本组13例中仅有1例为双乳SPC 。彩超检查可以提供在一个扩张的导管内存在复杂囊内病变或均匀实性病变的建议,是评价乳腺乳头状病变最敏感的方法[3]。SPC的影像学特征目前尚未明确[11]。
3.2病理学特点大体上SPC呈膨胀性长,形成实性结节,与周围组织界限较清晰,文献中报道的肿瘤大小多样,可小于1 cm也能大到15 cm,有研究发现当肿瘤大小在1.7-3.2 cm时与浸润癌的存在可能有关系[9],肿物颜色灰白或黄褐色,质地柔软或软稍韧。镜下导管内实性增生区域可见纤细的纤维血管间隔分隔,细胞栅栏状排列围绕血管轴心形成假菊形团样结构是SPC常见的特征[11,12],细胞形态可呈多角形、浆样、印戒样或梭形等,胞质含有嗜酸性的小颗粒,细胞间或纤维血管间隔可见粘液聚集,细胞核单一较小,部分核偏位,核淡染、核仁不明显,具有轻至中度非典型性,可见核分裂象,坏死少见,乳腺导管内常见肿瘤细胞Paget样扩散。本组13例患者镜下表现具备SPC的基本形态学特点,符合SPC诊断标准。几乎半数的SPC病例伴有浸润癌,浸润癌的成分包括黏液腺癌、神经内分泌样癌、浸润性导管癌或很少的小叶或小管癌[5,6,13]。本组13例患者中有1例伴有浸润性导管癌(Ⅱ级)。明确区分原位与浸润性SPC很困难,当出现下列证据:①局部出现生长方式的改变(不规则成角的细胞巢、筛状结构、粘液样结构、小管癌结构)②这种生长方式明确地出现于病变的纤维被膜之外③疏松的粘液样间质④如果呈现地图状、锯齿状边缘,并且缺乏肌上皮细胞时考虑为浸润性癌。本组13例中有2例伴有微浸润。
3.3免疫表型大多数SPC积极表达ER、PR而C-erbB-2为阴性[5,6,11],本组13例患者除1例ER、PR阳性百分比稍低,其余12例患者ER、PR均呈强阳性表达,而13例患者C-erbB-2均为阴性,若C-erbB-2高表达则提示乳腺癌恶性程度高且预后差[14]。SPC的增值指数低[3],Ki67阳性指数作为评估肿瘤细胞增殖活性的重要指标在SPC的病例中也多呈现低表达,Ki67若高表达则是预后不良的标志之一,本组13例患者Ki67阳性指数范围1%-40%,除1例较高为40%外,其余各例均≤10%,阳性指数平均值为9%。本组13例患者ER、PR高阳性表达率、低Ki67阳性指数和不表达C-erbB-2的免疫组化结果符合SPC是一种低度恶性且预后较好的肿瘤的特点。SPC的肿瘤细胞表达神经内分泌标记物,如:Syn、CgA[5,6,11,12],神经内分泌标记阳性是SPC的重要特点,有助于SPC的诊断,但不是必须的。本组13例患者Syn和CgA的阳性率较高分别为84.6%和74.9%,此外本组还做了CD56的染色也有较高的阳性表达率。SPC肿瘤细胞积极表达E-cadherin而小叶病变为阴性[11],有助于和小叶病变相鉴别,本组13例患者E-cadherin均呈阳性表达。此外SPC的肿瘤细胞不表达CK5/6、34βE12、SMA和P63等,本组13例患者CK5/6均为阴性。WHO在确定SPC的诊断中没有明确肌上皮细胞的存留范围,因此SMA、P63肌上皮可以不表达、可以呈灶状或分散非完整性阳性,也可呈连续完整阳性表达。许多作者指出大多数SPC的病例缺乏周围的肌上皮细胞,但是由于绝大多数SPC病变都有基底膜包绕,肿瘤周围缺乏免疫组化显示的肌上皮细胞仍可以保持光滑的外周轮廓[3],因此单纯的免疫组化肌上皮的缺失不能作为区分是原位还是浸润SPC的确切依据。本组13例患者中实性结节周围SMA、P63肌上皮完整表达的5例,缺失的8例,最终确诊伴浸润的SPC只有3例。
3.4鉴别诊断①普通型导管上皮增生(Usual ductal hyperplasia,UDH):与SPC的细胞形态很相似,导管外周均可见不规则的腺样腔隙,也可出现细胞内和细胞间质粘液分泌。但SPC所具有的Paget样扩散的特征在UDH中很少见,此外免疫组化神内分泌标记物Syn、CgA等在SPC阳性,在UDH中并不表达,SPC中不表达的CK5/6、34βE12和可能不表达的肌上皮标记P63、SMA在UDH中均呈阳性表达,另外UDH有时可伴有大汗腺化生而这在SPC中很少见。②导管内乳头状瘤:SPC与伴有普通型增生的导管内乳头状瘤两者具有一些相似的特征,如导管上皮呈实性生长、瘤细胞可呈梭形或流水样排列、细胞异型性不大等,当出现特别长的梭形细胞,纤细的纤维血管轴心,漩涡状结构;明显的栅栏状排列、分裂像易见,嗜酸性胞质颗粒、Paget样扩散;基底型CK(CK5/6)阴性而神经内分泌标记阳性;ER均质性表达时支持SPC的诊断。③乳腺肌上皮肿瘤:瘤细胞可呈梭形、透明细胞型和浆细胞样型,常缺乏细胞外粘液,肿瘤细胞34βE12、p63和SMA等肌上皮标记物阳性,ER、PR阴性,与SPC正好相反。④小叶瘤变:呈实片状改变具有浆细胞样和印戒样细胞的小叶瘤变与SPC形态学相似,但其缺乏血管轴心和细胞外粘液、不表达E-cadherin,有助于和SPC相鉴别。⑤包裹性乳头状癌(Encapsulated papillary carcinoma,EPC):也好发于老年女性,肿瘤缺乏周围肌上皮,瘤细胞可排列成实性、筛状等,但其具有纤细血管茎的真性乳头,肿瘤细胞核异型性大,Syn、CgA等神经内分泌标记的检测有助于鉴别。⑥低级别导管内癌:呈拱形、微乳头、筛状或实性生长,与SPC相似,需要同SPC,特别是穿刺时的标本相鉴别。低级别导管内癌的瘤细胞异型性小,核分裂罕见,瘤细胞巢周围的肌上皮完全表达,少见梭形或浆细胞样细胞,缺乏纤维血管轴心和细胞外黏液,不表达Syn、CgA等神经内分泌标记物。⑦黏液表皮样癌:可有细胞内外粘液,且中间型细胞与SPC非常相似,但其缺乏纤维血管轴心,免疫组化ER、PR和E-cadherin阴性有助于两者的鉴别。
3.5治疗及预后SPC是一种具有惰性临床经过、预后较好的低度恶性肿瘤,病变完全切除或乳腺部分/全部切除是治疗SPC的首选方法[3]。关于SPC术后放疗和内分泌治疗的作用目前仍存在争议[15]。无粘液外漏和微浸润的单纯SPC通常不发生转移[11],预后良好,仅有极少数单纯性SPC局部复发的报道[16]。SPC在伴发浸润癌的情况下,预后情况依赖于浸润癌的成分,在这种情况下也可出现没有腋窝淋巴结转移的远处转移[9]。本组13例患者,10例原位SPC,2例伴有微浸润,1例伴发浸润性导管癌(Ⅱ级),术后情况良好,目前为止均未发现复发和转移。
参考文献:
[1]Maluf HM, Koerner FC.Solid papillary carcinoma of the breast.A form of intraductal carcinoma with endocrine differentiation frequently associated with mucinous carcinoma[J].Am J Surg Pathol,1995,19:1237.
[2]Sunil R,Ellis IO,Stuart J. WHO classification of tumors. The classification of tumors of the breast [M]. Lyon:IARC Press,2012:92-93,108-109.
[3]Saremian J1, Rosa M.Solid papillary carcinoma of the breast:a pathologically and clinically distinct breast tumor[J].Arch Pathol Lab Med,2012,136(10):1308.
[4]Dowselt M,Nielsen TO,A’Hem R,et al.Assessment of Ki67 in breast cancer:recommendations fi'om the International Ki67 in Breast Cancer working group[J].J Natl Cancer Inst,2011,103(22):1656.
[5]Kuroda N1, Fujishima N, Inoue K,et al.Solid papillary carcinoma of the breast:imprint cytological and histological findings[J].Med Mol Morphol,2010,43(1):48.
[6]Jach R1, Piskorz T, Przeszlakowski D,et,al.Solid papillary carcinoma of the breast with neuroendocrine features in a pregnant woman:a case report[J].Neuro Endocrinol Lett,2011,32(4):405.
[7]J B L1, Kini RG,Amber S.Invasive (solid) Papillary Carcinoma of the Breast:A Report of Two Cases[J].J Clin Diagn Res,2013,7(6):1150.
[8]Länger F1,Hille-Betz U,Kreipe HH.[Papillary lesions of the breast][J].Pathologe,2014,35(1):36.
[9]Nassar H, Qureshi H, Volkanadsay N,et,al.Clinicopathologic analysis of solid papillary carcinoma of the breast and associated invasive carcinomas[J].Am J Surg Pathol,2006,30(4):501.
[10]Yamada M, Otsuki Y,Shimizu S,et,al.Cytological study of 20 cases of solid-papillary carcinoma of the breast[J].Diagn Cytopathol,2007,35(7):417.
[11]Nassar H.Solid papillary carcinoma of the breast[J].Pathol Case Rev,2009,14(4):157.
[12]Rosen PP,ed.Rosen’s Breast Pathology.3rd ed[M].Philadelphia,PA:LWW,2009:433-437.
[13]Koerner F.Papilloma and papillary carcinoma[J].Semin Diagn Pathol,2010,27(1):13.
[14]Goldhirsch A,Glick JH,Celber RD,et al.Meeting highlights:international expert consensus on the primary therapy of early breast cancer 2005.[J].Ann Oneol, 2005,16(10):1569.
[15]Fayanju OM,Ritter J, Gillanders WE, et al.Therapeutic management of intracystic papillary carcinoma of the breast:the roles of radiation and endocrine therapy [J].Am J Surg,2007,194(4):497.
[16]Otsuki Y, Yamada M,,Shimizu S, et al.Solid-papillary carcinoma of the breast:clinicopathological study of 20 cases[J].Pathol Int,2007,57(7):421.
摘要:目的探讨乳腺实性乳头状癌(Solid papillary carcinoma,SPC)临床病理特点、诊断及其鉴别诊断。方法对13例SPC病例进行组织形态学观察及免疫组化标记, 总结其临床资料和组织病理特征, 选用抗体包括Syn、CgA、CD56等。结果本组13例均为女性患者,发病平均年龄63.7岁,肿瘤直径0.5 cm-3 cm(平均1.5 cm),镜下可见肿瘤细胞在导管内实性膨胀生长,形成假菊形团样结构,导管内可见肿瘤细胞Paget样扩散,细胞核轻至中度异型,核分裂象<5个/10HPF。免疫组化显示瘤细胞弥漫表达ER、PR、Syn等, Ki67平均阳性指数为9%。结论SPC具有较独特的病理组织学改变和免疫表型,诊断依靠形态学特征,免疫组化标记有助于与普通型导管上皮增生、小叶瘤变及低级别导管原位癌等相鉴别。
关键词:乳腺;实性乳头状癌;神经内分泌
Clinicopathological analysis of solid papillary carcinoma of breastLIUYuan-yuan,ZHANGWei,QIDian-jun,etal.(Departmentofpathology,theGeneralHospitalofFushunMiningGroup,Fushun113008,China)
Abstract:ObjectiveThe aim of the study is to explore the clinicopathological features, diagnosis and differential diagnosis of breast solid papillary carcinoma (SPC).MethodsHistopathological observation and immunohistochemical labeling were applied to 13 SPC cases.Clinical data and histopathological features were summarized by using the antibodiesof Syn,CgA,CD56,etc.ResultsThirteen female patients were recruited in the study, and the average age of onset was 63.7 years.The diameter of the tumors was 0.5-3 cm (average 1.5 cm).The intraductal tumor cells grew in solid expansion style, forming false chrysanthemum-like structure.The tumor cells were diffusing in Paget like type in the duct,and the nuclei exhibited mild to moderate atypia, mitoses <5/10HPF.Immunohistochemical staining showed that the tumor cells diffusely expressed ER,PR,and Syn etc., and average positive index for Ki67 was 9%.The diagnosis relies on morphological features, and the immunohistochemical markers are helpful in the differential diagnosis of ductal epithelial hyperplasia, lobular neoplasia and low grade ductal carcinoma in situ.
Key words:Breast;Solid papillary carcinoma;Neuroendocrine
(收稿日期:2015-02-26)
作者简介:刘媛媛(1980-),女,辽宁沈阳人,学工学位,主治医师,主要从事临床病理诊断工作及研究。
中图分类号:R737.9
文献标识码:A

