产D-海因酶微生物的筛选及其催化特性
李 磊, 许国超, 韩瑞枝, 倪 晔*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
产D-海因酶微生物的筛选及其催化特性
李 磊1,2, 许国超1,2, 韩瑞枝1,2, 倪 晔*1,2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
为获得高活性和立体选择性海因酶生产菌株,首先采用氨基酸关环法合成了数种5'-单取代海因衍生物及N-氨甲酰-氨基酸,建立了相关液相色谱检测方法。然后以实验室保藏的野生菌株出发,利用底物诱导的方法筛选到6株具有D-海因酶活性的野生菌,其中荧光假单胞菌产生的D-海因酶具有较好的底物谱,较高的活性和立体选择性。经优化后,其最适产酶温度为30℃,培养时间为12 h,发酵活力达到92.1 U/L。该菌催化D-海因水解的最适反应温度为60℃,pH 8.5。在50 mL体系中,利用0.25 g菌体(干重)可对映选择性水解20 mmol/L对羟基苯海因底物,反应3 h转化率达到98%。
D-海因酶;D-氨基酸;荧光假单胞菌;5'-单取代海因
D-氨基酸是一类重要的非天然氨基酸,广泛分布在自然界中,如细菌细胞壁的肽聚糖[1],抗菌肽[2]。此外,动物体内也存在游离态D-氨基酸,且具有一定的生理功能,如老鼠大脑中含有D-丝氨酸[3]。D-氨基酸及其衍生物是医药、农药、和食品等精细化工中的重要原料,例如:D-对羟基苯甘氨酸是β-内酰胺类抗生素的重要手性中间体,D-缬氨酸可应用于合成杀虫剂,而D-丙氨酸是生产人造甜味剂—阿斯巴甜的重要原料[4]。鉴于D-氨基酸的重要作用,目前已有报道采用化学法、发酵法以及海因酶/氨甲酰酶、己内酰胺酶、酯酶、氨基转移酶、酮酸脱氢酶等酶催化方法用于D-氨基酸的合成,而海因酶法也是用于制备光学纯手性氨基酸最高效和广泛应用的方法之一。
D-海因酶(D-hydantoinase,EC3.5.2.2),又称乙内酰脲酶,多数为金属离子依赖酶,一般为同源二聚体或四聚体,广泛分布在微生物、动物和植物中[5-6],见图1。它可以催化海因及5′-单取代海因中内酰胺键开环生成N-氨甲酰氨基酸,再经去氨甲酰作用得到相应的D-氨基酸。近年来,国内市场对D-氨基酸,尤其是生产β-内酰胺类抗生素所需的D-对羟基氨基苯甘氨酸和D-苯甘氨酸需求量很大,而目前主要依赖进口。由于发酵法或微生物转化法具有周期短、效率高、成本低等优点备受关注。通过筛选具有高对映选择性和催化活性的D-海因酶产生菌株,构建用于D-氨基酸生产的高效生物转化体系意义深远。已有文献报道农杆菌、假单胞菌、节杆菌和芽孢杆菌等菌属[7-8]的微生物可以产生D-海因酶。
化学法合成5′-单取代海因衍生物的方法有多种,常用的有Suzuki法、缩合加氢法和氨基酸关环法[9]。虽然氨基酸关环法以氨基酸为初始底物,生产成本较高,然而其具有操作简单、反应物无毒、产物易分离、收率高等优点,目前仍然是高效合成5′-单取代海因衍生物方法之一。
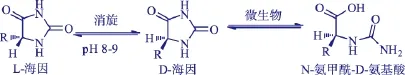
图1 微生物催化海因底物的对映选择性水解Fig.1 Enantioselective resolution of D,L-hydantoin into N-carbamyl-D-amino acid catalyzed by microorganism
作者利用氨基酸关环法合成了数种海因衍生物及其中间物质N-氨甲酰氨基酸,然后以对羟基苯海因和异丁基海因不对称拆分反应为靶向反应,对作者所在实验室保存的23株野生菌进行酶活筛选,以期得到高对映选择性和催化活性的D-海因酶生产菌。最终成功筛选到6株可水解5′-单取代海因底物的野生菌株,其中荧光假单胞菌表现出最高的催化活性和对映选择性,并对其发酵产酶及催化反应条件进行了优化。
1 材料与方法
1.1 材料
1.1.1 菌株 作者所在实验室保存的23株野生菌。
1.1.2 培养基及溶液
1)Luria-Bertani(LB)培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,pH 7.2,固体培养基加入2 g/dL琼脂。
2)营养肉汤(NB)培养基:蛋白胨10 g/L,牛肉粉3 g/L,氯化钠5 g/L,pH 7.2,固体培养基加入2 g/dL琼脂。
3)底物诱导溶液:异丁基海因母液(100 mmol/L异丁基海因,溶于pH 8.5、100 mmol/L磷酸盐缓冲液);对羟基海因母液(100 mmol/L对羟基苯海因的乙醇悬浊液)。
4)底物转化反应体系I:20 mmol/L异丁基海因,溶于pH 8.5、100 mmol/L磷酸盐缓冲液。
5)底物转化反应体系II:10 mmol/L对羟基苯海因,溶于pH 8.5、100 mmol/L磷酸盐缓冲液。
1.1.3 主要仪器 日立Chromaster高效液相色谱仪;Waters sunfireTMC18色谱柱(250 mm×4.6 mm,5 μm);安捷伦1200高效液相色谱仪;Waters Xbridge C18色谱柱 (250 mm×4.6 mm,5 μm);大赛璐CHARALCEL○ROD-H色谱柱 (250 mm×4.6 mm,5 μm);Thermo-TSQ QUANTUM ULTRA质谱仪;Thermo SCIENTIFIC Hypersil GOLD column(250mm×4.6 mm,5 μm);AVANCE III 400 MHz全数字化核磁共振谱仪。
1.1.4 5’-单取代海因底物 对羟基苯海因(≥98%):上海岚克医药科技发展有限公司;异丁基海因,异丙基海因,苯甲基海因,吲哚甲基海因,邻氯苯海因:均为作者所在实验室合成。
1.2 实验方法
1.2.1 氨基酸关环法合成5’-单取代海因[10-11]按摩尔比1.5~1.75∶1称取NaCNO及氨基酸(D/L-Val,D/L-Ile,D/L-Phe,D/L-Trp,D/L-邻氯苯甘氨酸,LVal,L-Trp)至250 mL圆底烧瓶,按每克氨基酸添加15~20 mL去离子水溶解以上化合物,于80℃油浴中搅拌反应2 h。待冷却至60℃后,加入浓盐酸调pH至2~3,此时溶液由澄清立即变为悬浊液。等悬浊液冷却至室温,抽滤,并用去离子水洗涤,将固体在50℃恒温箱中烘干,此时获得的物质为N-氨甲酰氨基酸。同时将滤液和洗涤液的N-氨甲酰氨基酸收集,于60℃减压蒸馏将液体蒸发至有固体析出,冷却、抽滤、洗涤、烘干。
取N-氨甲酰氨基酸加入到250 mL烧瓶中,按每克N-氨甲酰氨基酸加入15~20 mL蒸馏水,每摩尔反应物加入2 mol浓硫酸,于105℃油浴条件下搅拌反应3 h。反应结束后于4℃冷却结晶,将固体抽滤并用去离子水洗涤。为进一步获得纯度较高的5′-单取代海因,将所得固体再加入适量去离子水加热溶解后抽滤,滤液于4℃结晶,再经抽滤、烘干即为5′-单取代海因。因滤液中仍有少量产物,将每次抽滤后的液体旋转减压蒸馏再次结晶。
取10 mg左右的合成产物加入到干净的离心管中,加入1mL氘带二甲基亚砜振荡溶解,取适量转移至核磁管中。用AVANCE III 400MHz全数字化核磁共振谱仪分析鉴定。
1.2.2 5’-单取代海因、N-氨甲酰氨基酸及D-氨基酸的分析方法
1)D-海因酶活性检测:取100 μL反应液加入等体积显色剂(10%对二甲氨基苯甲醛(PDAB),溶于6 mol/L盐酸)进行颜色反应,出现黄色的菌株为阳性菌株。
2)反相HPLC:采用配有Waters SunfireTMC18色谱柱的Chromaster高效液相色谱仪分析海因及N-氨甲酰氨基酸,流动相中甲醇比例如表1所示。流速为1 mL/min,柱温30℃,检测波长为210 nm,保留时间见表2。
3)正相手性HPLC:采用OD-H色谱柱分析外消旋的N-氨甲酰氨基酸,流动相为异丙醇∶正己烷∶三氟乙酸=15∶85∶0.1,流速0.8 mL/min,柱温30℃,检测波长UV210 nm。
4)氨基酸检测:准确称取50 mg邻苯二甲醛(OPA),溶解于4.5 mL甲醇中,加入50 μL β-巯基乙醇,500 μL 0.1 mmol/L四硼酸钠,混匀后即得OPA衍生化试剂,于-4℃保存备用。按2 μL样品、5 μL 0.1 mmol/L四硼酸钠,3 μL OPA衍生化试剂的比例进行柱前衍生化,采用Xbridge C18色谱柱进行分析,柱温为30℃,流速1 mL/min,检测器波长为UV338 nm。
5)LC-MS:采用 Hypersil GOLD column(250 mm×4.6 mm,5 μm)色谱柱,流动相为20%~35%甲醇梯度洗脱10 min,流速0.2 mL/min,进入Thermo-TSQ QUANTUM ULTRA质谱仪,在负离子模式检测。
1.2.3 酶活测定 取5 mL菌液离心获得菌体,向菌体中加入1 mL底物转化溶液,在90 r/min、37℃下反应10 min后加入1 mL 10%三氯乙酸终止反应,12 000 r/min离心10 min,上清液经0.22 μm滤膜过滤后,用反相HPLC法检测。酶活力定义:1 min内催化底物生成1 μmol N-氨甲酰氨基酸所需的菌体量为一个活力单位(U)。
1.2.4 立体选择性分析 取等体积10%三氯乙酸溶液加入到菌体转化液中,静置30 min,12 000 r/min离心10 min除去细胞,取出上清液加入到50 mL圆底烧瓶中,低压状态下经旋转蒸发装置去除液体,固体于50℃干燥除去残留水分,加入异丙醇溶解,于12 000 r/min离心10 min,经0.22 μm滤膜过滤后,取10 μL样品采用正相手性HPLC法进行立体选择性分析。
1.2.5 N-氨甲酰氨基酸酰胺水解酶活性验证 以分析反应体系中是否有D-氨基酸的生成为指标,检测菌株是否含有N-氨甲酰氨基酸酰胺水解酶的活性。从反应体系中取样,经0.22 μm滤膜过滤后,按上述氨基酸检测方法分析是否有氨基酸生成。
2 结果与分析
2.1 5’-单取代海因的合成
氨基酸关环法合成5′-单取代海因共分两步,首先α-氨基酸与氰酸钠于80℃反应生成N-氨甲酰氨基酸,第二步N-氨甲酰氨基酸在酸性条件下于105℃分子内失去一分子水缩合生成5′-单取代海因。另外在合成过程中,具有还原性的氨基酸很容易被氧化,曾尝试通过对羟基苯甘氨酸合成相应的海因物质,最终检测发现合成的物质不是目标物质,经分析鉴定发现与苯环相连的羟基被氧化。所有产物经1H-NMR验证,与目标物质相符。
反应过程中,为提高氨基酸的转化率,将氨基酸与氰酸钠的摩尔比控制为1∶1.5~1.7。反应2 h,转化率可达到97%以上。由于中间物N-氨甲酰氨基酸在酸性环境下的溶解度很低,加入浓盐酸调pH至2~3后即产生白色沉淀N-氨甲酰氨基酸。而此时氰酸钾的溶解度很高,通过简单的抽滤分离可获得纯度较高的N-氨甲酰氨基酸。最终N-氨甲酰氨基酸纯度大于98%,摩尔回收率可达97%。
提纯后的N-氨甲酰氨基酸在高温条件下经硫酸的催化作用,分子内缩合失去一分子水得到最终产物5′-单取代海因。为提高产物收率和后期分离效率,将反应时间延长到3 h,中间物的转化率大大提高,最终产物的摩尔收率均为94%以上。海因衍生物在高温下溶解度较高,而温度降低时物质在中性环境下的溶解度下降显著。在分离纯化过程中,采用了固体加热溶解再结晶的方法。反应结束后液体冷却,将固体经抽滤分离后,加入一定量的去离子水,经加热溶解过滤后滤液在4℃重结晶即得纯品。经纯化后产物的纯度能够达到98%以上。不同5′-单取代海因的合成效率见表1。
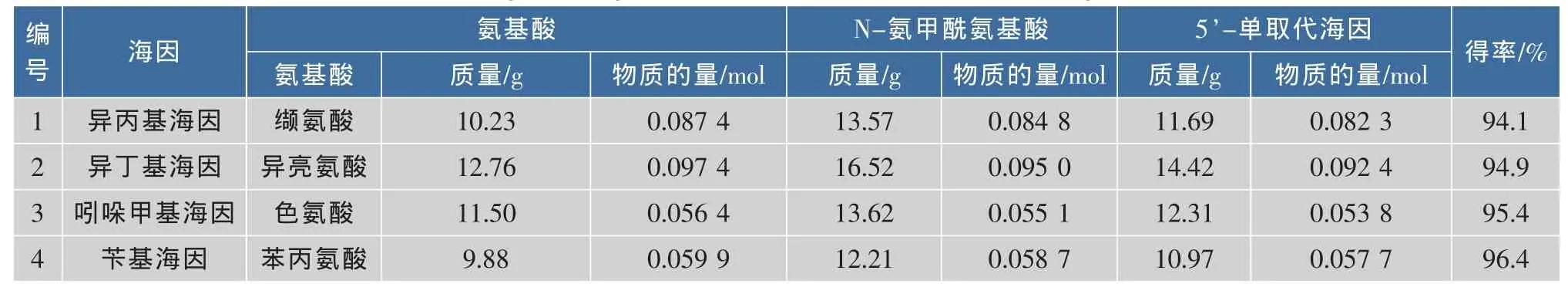
表1 不同5’-单取代海因的合成效率Table 1 Synthetic yield of various 5’-monosubstituted hydantoins
2.2 底物及中间物质的液相色谱检测条件
由于5'-单取代海及相应的N-氨甲酰氨基酸均为水溶性且具有紫外吸收,因此采用反相HPLC进行分析。选用Waters SunfireTMC18色谱柱,流动相组成见表2。以确保海因衍生物与其对应的N-氨甲酰氨基酸的分离度R>1.5,各物质的保留时间见表2。

表2 5’-单取代海因及其水解产物N-氨甲酰氨基酸的色谱分析条件Table 2 HPLC analysis of 5’-monosubstituted-hydantoins and corresponding N-carbomyl-amino acids
2.3 D-海因酶活性菌株的筛选
常用的海因酶产生菌筛选方法有3种[12-13]:一是利用海因衍生物为惟一氮源或碳源法,二是双层平板法,三是微孔板筛选法。但是此3种方法均具有一定的局限性,第一种策略由于营养苛刻,因而易漏筛,第二、三种方法易受菌株本身产生的颜色和副产物影响。作者选择了摇瓶培养法,即:培养基中加入适量的酵母膏和胰蛋白胨等营养物质,为菌体的生长提供保障;同时在培养过程中加入底物对其诱导产酶,培养结束后将离心洗涤后的菌体用于底物转化。由于产物N-氨甲酰氨基酸可以与显色剂4-二甲氨基苯甲醛(Ehrlich’s reagent)在酸性条件下反应生成黄色物质,可用于检测阳性菌株,反应原理见图2。
在选择诱导剂时,考虑到不同菌株来源的海因酶底物谱范围和最适底物不同,因而选择了烃链衍生族的异丁基海因和芳香族的对羟基苯海因分别作为诱导剂诱导细胞表达海因酶。经过活性检测得到6株阳性菌株分别为:荧光假单胞菌CGMCC1.1802,洋葱伯克霍尔德CGMCC1.1813,恶臭假单胞菌901,恶臭假单胞菌KT2440,铜绿假单胞菌1-3,土壤农杆菌F1。

图2 D-海因酶活性筛选的颜色反应原理Fig.2 Mechanism of chromogenic reaction in screening of D-hydantoinase activity
为了考察6株活性菌株是否具有进一步将N-氨甲酰氨基酸水解为氨基酸的N-氨甲酰水解酶活性,利用液相柱前邻苯二甲醛(OPA)衍生法测定是否有氨基酸生成。样品经HPLC分析后得到的色谱图与标样比较,所有样品在相应的保留时间处没有产生特征峰,即所筛选的菌株中不含有N-氨甲酰氨基酸酰胺水解酶。
利用LC-MS对阳性菌株的催化产物进行分析,以验证其催化海因水解后产物为N-氨甲酰氨基酸。首先,用菌体催化异丁基海因,转化液经离心过滤后,进入超高效液相分离后经质谱检测,在负离子状态下测定分子及其碎片大小,因为无机盐对质谱仪的损害较大,所以从第2分钟开始检测。6株菌的测定结果显示,产物均为相应的N-氨甲酰氨基酸。图3为荧光假单胞菌CGMCC1.1802转化产物的LC-MS图谱。异丁基海因经D-海因酶转化为N-氨甲酰基-异亮氨酸,相对分子质量由156变为174.1。可以看到相对分子质量175.10为带一个H+的N-氨甲酰基-异亮氨酸,而196.87的峰为产物带一个Na+,均可以证明产物为N-氨甲酰异亮氨酸。
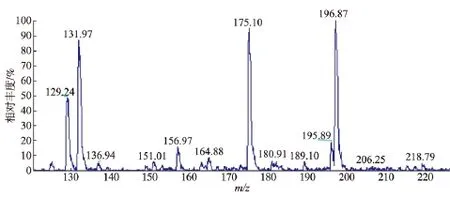
图3 荧光假单胞菌转化液的LC-MS图Fig.3 LC-MS result of Pseudomonas fluorescens CGMCC1.1802 catalyzed reaction
对筛选到的海因酶阳性菌株进一步诱导培养,分别测定利用所得菌体对烃基海因 (20 mmol/L异丁基海因)和芳香族海因(10 mmol/L对羟基海因)的初速度及选择性,见表3。结果显示:恶臭假单胞菌KT2440对对羟基苯海因和异丁基海因的酶活分别为8.43 U/L和53.9 U/L,且催化产生D-型产物,产物的ee值分别为98.2%和97.9%;土壤农杆菌F1对异丁基海因的酶活力为23.5 U/L,对羟基苯海因的酶活力仅为8.00 U/L,产物的立体选择性均低于96%;而荧光假单胞菌CGMCC1.1802对异丁基海因和对羟基苯海因的酶活分别为23.4 U/L和20.4 U/ L,立体选择性均大于98%,对两种类型底物均表现出很好的催化性能,尤其是对于芳香族海因类底物。因此,对荧光假单胞菌产D-海因酶的条件及反应体系进行了进一步优化。
2.4 荧光假单胞菌产D-海因酶发酵条件优化
为获得更高的酶产量以满足催化反应的需要,对荧光假单胞菌的诱导产酶条件进行了研究。首先考察了诱导时间的影响,将种子液以2%的接种体积分数转接于新鲜的LB培养基中,加入终浓度为2 mmol/L异丁基海因,于30℃诱导培养,间隔一定时间取样测定酶活力及OD600。发现在12 h时酶活达到最大值,约为92.1 U/L。由图4可知,在培养前期,酶产量与菌浓平行增长;当菌体生长进入稳定期后,OD600不再继续增加,而酶活力下降严重。此海因酶为胞内组成型表达酶,随菌体的增多而增加,当菌体进入稳定期后,培养基中的营养消耗殆尽,细胞老化,胞内的氧化性自由基增多,使海因酶氧化失活。

表3 阳性菌株对海因底物的催化活力及立体选择性Table 3 Enzymatic activity and enantioselectivity of hydantoin resolution catalyzed by selected strains
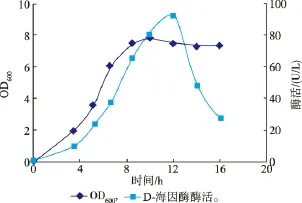
图4 荧光假单胞菌菌体生长和产酶曲线Fig.4 Time course of cell growth and D-hydantoinase production of P.fluorescens
对菌株诱导产酶的温度进行了考察,同样按2%的接种体积分数将种子液转接于新鲜的LB培养基中,分别于25、30、35、37℃下诱导培养12 h后测定菌体酶活。在30℃下培养的菌体具有最高的酶活,对异丁基海因底物的活力为92.1 U/L,见图5。该温度与菌体生长的最适温度一致,在最适生长温度下有利于细胞增殖和蛋白质的正常合成,因此在此温度下表现出最高酶活力。
基于以上对荧光假单胞菌产酶和催化条件的优化,将该菌株于30℃诱导培养12 h(OD600约为7.5),测得其对20 mmol/L的不同海因底物(包括:异丁基海因、异丙基海因和对羟基苯海因)的单位发酵液酶活力分别为92.1、82.4、85.3 U/L。

图5 温度对荧光假单胞菌产D-海因酶的影响Fig.5 Influence of induction temperature on D-hydantoinase production of P.fluorescens
2.5 荧光假单胞菌D-海因酶的性质研究
利用上述发酵制备的D-海因酶产生菌体,对羟基苯海因作为模型底物,对其酶学性质进行了研究。考察了它们在不同pH下海因酶酶活力高低的变化。数据显示,酶活随pH的升高先增加后降低,最适pH偏碱性,为8.5左右(图6a)。同时研究了在不同温度下保温30 min后酶活的变化,结果显示该酶催化反应的最适温度为60℃(图6b)。海因衍生物在碱性和高温条件下,溶解度升高,外消旋速率加快,有利于加速反应进程,达到更高的转化率和收率[14]。然而当温度超过50℃时,底物易分解变质。因此在接下来的选择性水解海因制备D-氨甲酰氨基酸的反应中采用pH 8.5和50℃的最适催化条件。
为了更好探究该D-海因酶产生菌的催化潜力以有助于指导在D-氨甲酰氨基酸合成中的应用,对其底物特异性进行了进一步考察。分别测定了荧光假单胞菌菌体对不同5′-单取代海因底物(10 mmol/L,溶于磷酸钠缓冲液(pH 8.5,100 mmol/L))水解反应的初速度,结果见表4。可以看出,此海因酶对异丙基海因、异丁基海因和对羟基苯海因具有很高的催化活力,而对疏水性较强和侧链较大的苄基海因、邻氯苯海因和吲哚甲基海因催化活性较低,相对酶活<10%,由于这些底物的侧链具有较大的苯基、苄基等,空间位阻较大,不利于底物进入活性口袋。对映选择性分析发现,与侧链较小的异丙基海因相比,该酶对侧链较大的对羟基苯海因和异丁基海因具有更好的立体选择性,原因可能是D-海因酶的催化口袋与异丙基海因的侧链不完全匹配[15]。

图6 不同pH和温度对荧光假单胞菌海因酶酶活的影响Fig.6 Effect of pH and temperature on enzymatic activity of D-hydantoinase produced by Pseudomonas fluorescens
100 mL菌液离心可得约0.25 g细胞(干重),以其为催化剂考察在海因衍生物水解反应中的效果。分别加入50 mL、100 mmol/L异丁基海因和50 mL、20 mmol/L对羟基苯海因,于50°C转化,定时取样,向样品中加入等体积的10%三氯乙酸以终止反应,利用反相HPLC测定产物含量并计算转化率。菌体在催化异丁基海因时,反应4 h后转化率为36%,6 h后转化率达到49.3%,并保持不变。这是由于异丁基海因在溶液中自身的消旋能力非常弱,外消旋异丁基海因底物不能被完全转化,只有D-异丁基海因被水解,因此最大转化率仅为50%。在催化对羟基苯海因时,由于其溶解度较低,所以选择了20 mmol/L底物浓度,反应1 h转化率达到40%,3 h时转化率达到98%。这是由于对羟基苯海因可以通过烯醇互变异构体由L-构型转变为D-构型[14],从而实现自发消旋,因此外消旋对羟基苯海因的最大转化率可达到100%。
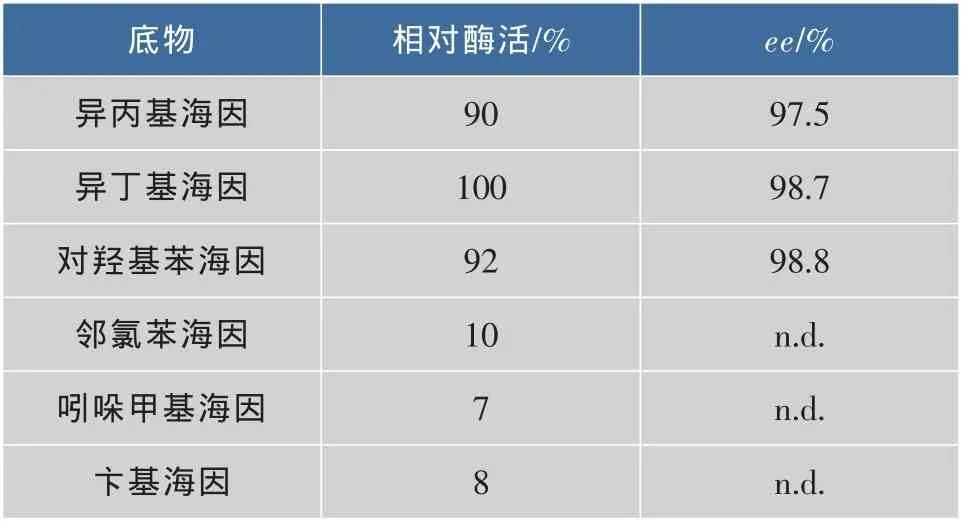
表4 D-海因酶对不同5′-单取代海因底物的催化活性Table 4 Substrate specificity of D-hydantoinase from Pseudomonas fluorescens
3 结语
D-海因酶是生产D-氨基酸的重要酶制剂,已被应用于生产D-对羟基苯甘氨酸和D-苯甘氨酸。从作者所在实验室保藏的微生物出发,筛选到6株具有D-海因酶活性的菌株。其中,荧光假单胞菌来源的D-海因酶具有较宽的底物谱,该D-海因酶对短侧链的异丁基海因和异丙基海因以及芳香基团的对羟基苯海因的催化活力较高,单位发酵液酶活分别为92.1、82.4、85.3 U/L,对映选择性(ee)分别为98.7%,97.5%和98.8%。该菌株催化反应的最适pH为8.5,最适温度为60℃。在该反应条件有利于提高底物的溶解度和外消旋速率,进而增加酶的催化速率和产物收率。与同类文献报道相比[16],本研究的D-海因产生菌荧光假单胞菌具有优越的催化性能,对其中的D-海因酶进行异源高表达后在不对称水解海因制备D-氨基酸方面将会具有更大的潜力。
参考文献:
[1]SCHLEIFER K H,KANDLER O.Peptidoglycan types of bacterial cell walls and their taxonomic implications[J].Bacteriological Reviews,1972,36(4):407-477.
[2]LATACZ G,Kiec-Kononowicz K.Biotransformation of new racemic(R,S)-5-benzylhydantoin derivatives by D-hydantoinases from adzuki bean[J].Biocatalysis and Biotransformation,2014,32(2):117-124.
[3]MOTHET J P,SNYDER S H.Brain d-amino acids:a novel class of neuromodulators[J].Amino Acids,2012,43(5):1809-1810. [4]HERAS-VAZQUEZ F J L,Clemente-Jimenez J M,Martinez-Rodriguez S,et al.Optically pure α-amino acids production by the“Hydantoinase Process”[J].Recent Patents on Biotechnology,2008,2(1):35-46.
[5]KO Y M,CHEN C I,CHANG H C,et al.Exploring the complex effects of metal ions on d-hydantoinase purification with an immobilized metal affinity membrane[J].Journal of the Taiwan Institute of Chemical Engineers,2011,42(5):735-740.
[6]董妍玲,郑月,潘学武,等.豆类来源D-海因酶的提取及特性研究[J].化学与生物工程,2010,27(5):59-61. DONG Yanling,ZHENG Yue,PAN Xuewu,et al.Extraction and analysis of D-hydantoinase from beans[J].Chemistry and Bioengineering,2010,27(5):59-61.(in Chinese)
[7]DURR R,VIELHAUER O,BURTON S G,et al.Distribution of hydantoinase activity in bacterial isolates from geographically distinct environmental sources[J].Journal of Molecular Catalysis B:Enzymatic,2006,39(1):160-165.
[8]ZHANG J,CAI Z.Efficient and cost-effective production of D-p-hydroxyphenylglycine by whole-cell bioconversion[J]. Biotechnology and Bioprocess Engineering,2014,19(1):76-82.
[9]于荣华,谭娇颖,乔浩,等.化学酶法制备D-丝氨酸[J].精细化工,2013,30(5):510-512. YU Ronghua,TAN Jiaoying,QIAO Hao,et al.Chemo-enzymatic synthesis of D-serine[J].Fine Chemicals,2013,30(5):510-512.(in Chinese)
[10]WARE E.The chemistry of the hydantoins[J].Chemical Reviews,1950,46(3):403-470.
[11]韦萍.D-氨基酸的制备研究[D].南京:南京工业大学,2002.
[12]孙婧.D-海因酶产生菌的筛选、性质及固定化研究[D].上海:上海师范大学,2010.
[13]王培,曹建华,宋德贵,等.一株产海因酶菌种的筛选与鉴定[J].广西师范大学学报:自然科学版,2013,31(1):119-124. WANG Pei,CAO Jianhua,SONG Zonggui,et al.Screening and identification of a strain of hydantoinase-producing microorganism[J].Journal of Guangxi Normal University:Natural Science Edition,2013,31(1):119-124.(in Chinese)
[14]LAZARUS R A.Chemical racemization of 5-benzylhydantoin[J].The Journal of Organic Chemistry,1990,55(15):4755-4757.
[15]MARTINEZ-RODRIGUEZ S,MARTINEZ-GOMEZ A I,Clemente-Jiménez J M,et al.Structure of dihydropyrimidinase from Sinorhizobium meliloti CECT4114:New features in an amidohydrolase family member[J].Journal of Structural Biology,2010,169(2):200-208.
[16]李隽,余江河.化学酶法制备D-苯甘氨酸[J].中国药科大学学报,2000,31(4):294-296. LI Jun,YU Jianghe.Chemoenzymatic synthesis of D-phenylglycine[J].Journal of China Pharmaceutical University,2000,31(4):294-296.(in Chinese)
Screening of D-Hydantoinase-Producing Microorganism and Its Catalytic Properties
LI Lei1,2, XU Guochao1,2, HAN Ruizhi1,2, NI Ye*1,2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
Hydantoinases are important enzymes with industrial potential in producing D-amino acids.In this study,6 strains with hydantoinase activity were selected from 23 wildtype microbial strains using 5'-monosubstituted hydantoin derivatives as induce substrates.Four 5'-monosubstituted hydantoins were chemically synthesized and verified with 1H-NMR.From 6 hydantoinase-producing strains,strain Pseudomonas fluorescenswas successfully identified with the highest enantioselectivity,desired substrate specificity and high activity in the hydrolysis of 5'-monosubstituted hydantoins andwas selected for further study.After induction with hydantoin substrates at 30℃for 12 h,the D-hydantoinase activity could reach 92.1 U/L.The reaction condition was optimized to be 60℃and pH 8.5,which was in favor of the spontaneous racemization of substrate.In a 50 mL whole-cell biocatalytic system,20 mmol/L D,L-p-hydroxyphenyl hydantoin was enantioselectively hydrolyzed by 0.25 g dry cells with a conversion ratioof 98%within 3 hours.
D-hydantoinase,D-amino acid,Pseudomonas fluorescens,5'-monosubstituted hydantoin
Q 93
A
1673—1689(2016)12—1292—08
2014-11-22
国家自然科学基金项目(21276112);国家973计划项目(2011CB710800);教育部新世纪优秀人才计划项目(NCET-11-0658)。
*通信作者:倪 晔(1975—),女,江苏无锡人,理学博士,教授,博士研究生导师,主要从事生物催化和酶工程方面的研究。E-mail:yni@jiangnan.edu.cn

