红枣叶中三萜皂苷的提取工艺和含量测定研究
刘子祯,姜蕊,刘伟锐,沈蒙,谢梦,徐冠玲,颜承,宋燕,张霞,杨悦,折改梅,*(.北京中医药大学中药学院,北京000;.宁夏医科大学药学院,宁夏银川750004)
红枣叶中三萜皂苷的提取工艺和含量测定研究
刘子祯1,姜蕊1,刘伟锐1,沈蒙1,谢梦1,徐冠玲1,颜承1,宋燕2,张霞1,杨悦1,折改梅1,*
(1.北京中医药大学中药学院,北京100102;2.宁夏医科大学药学院,宁夏银川750004)
摘要:研究红枣叶三萜皂苷的提取工艺和含量测定方法。最佳提取工艺为50 %乙醇水溶液,液料比10∶1(mL/g),回流提取1.5h;枣叶三萜皂苷含量为9.208%,RSD=2.26%。
关键词:红枣叶;三萜皂苷;提取工艺;含量测定
红枣叶为鼠李科枣属(Ziziphus)植物枣(Ziziphus jujube Mill.)的干燥树叶,性温、味甘,清热解毒,主治小儿壮热,疮疖等[1-2]。枣叶极具营养价值和药用价值,富含皂苷类活性成分[3-4],在减肥[5-6]、降血糖[7]和宁心安神方面具有独特功效[8]。另外,目前市售的甜味抑制剂都是通过化学合成的,然而枣叶中三萜皂苷如酸枣仁皂苷B、jujubasaponins、ziziphin皂草苷等具有突出的甜味抑制作用[9-10],其通过竞争味觉受体来阻断人的甜味反应[11],有望开发成月饼、糖果等甜食中的天然甜味抑制。然而,每年收获红枣时,大量枣叶被视作废物丢弃或烧毁,造成资源浪费和环境污染[6]。本研究对枣叶三萜皂苷进行了提取工艺考察,建立了三萜皂苷含量测定方法,对今后枣叶的开发利用具有重要意义。
本研究首次采用正交设计考察枣叶皂苷提取工艺并进行统计分析,确定了最佳提取工艺;优化了香草醛-冰乙酸比色法的显色条件;建立了红枣叶中三萜皂苷含量测定的方法,为合理利用枣叶资源奠定了基础。
1材料与方法
1.1材料与试剂
红枣叶采自陕西省榆林市,经笔者鉴定为枣(Ziziphus jujube Mill.)的干燥树叶。人参皂苷Re对照品(含量以98 %计):购自北京鑫科奥商贸有限公司;乙醇、冰乙酸、香草醛和高氯酸均为分析纯。
TU-1810紫外可见分光光度计:北京普析通用有限责任公司;AL204和XS205精密电子分析天平:梅特勒-托利多仪器有限公司,瑞士;DK-S24型电热恒温水浴锅:上海精宏实验设备有限公司;移液器:德国Eppendorf公司。
1.2方法
1.2.1供试品溶液制备
精密称取干燥枣叶10.001 4 g,用50 %乙醇按液料比10∶1(mL/g)回流提取1.5 h,过滤,稀释1倍,即得供试品溶液。
1.2.2对照品溶液的制备
精密称取人参皂苷Re对照品2.32 mg于10 mL的量瓶溶解,定容至刻度,摇匀,即对照品溶液。
1.2.3测定波长的选择
精密吸取供试品溶液30 μL,对照品溶液1.0 mL,挥干溶剂,分别加入的50 g/L香草醛-冰乙酸溶液0.2 mL,高氯酸0.8 mL,混匀,60℃水浴加热30 min,冷却至室温;分别加入冰乙酸5.0 mL,摇匀,静置40 min。在450 nm~600 nm范围进行全波长扫描,结果供试品和对照品均在532.0 nm处有最大吸收。因此,最大吸收波长为532.0 nm。结果见图1。
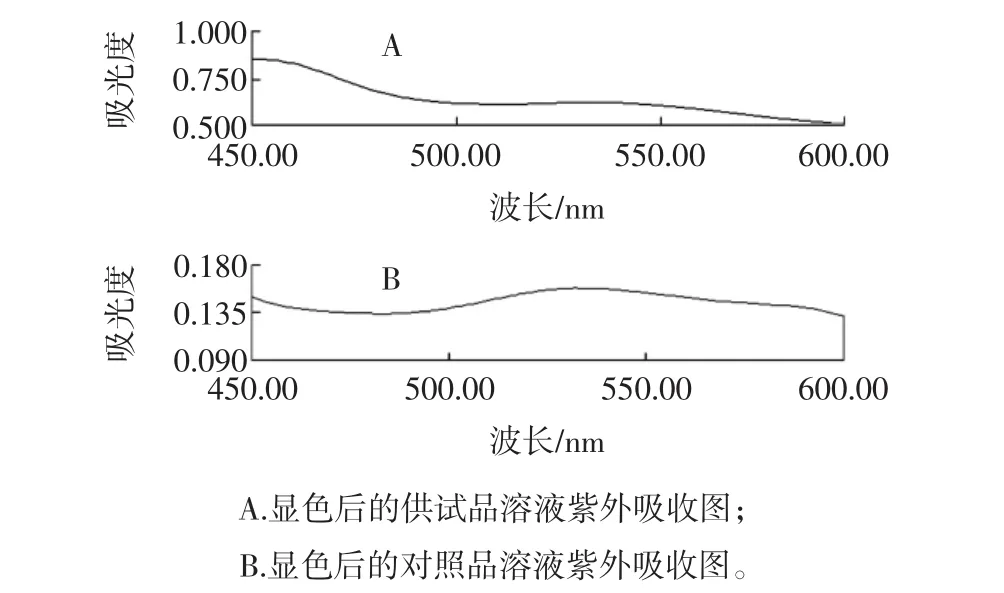
图1供试品溶液和对照品溶液显色后的紫外吸收图Fig.1 The UV graphs of test solution and reference solution after adding color-developing agent
1.2.4标准曲线的制作
精密吸取0.0、0.2、0.4、0.6、0.8、1.0 mL对照品溶液,挥干溶剂,分别加入50 g/L香草醛-冰乙酸0.2 mL和高氯酸0.8 mL,摇匀;于60℃恒温水浴加热30 min,取出冷却,分别加入5 mL冰乙酸,摇匀,静置40 min,以空白为对照,在532.0 nm下测定吸光度。以吸光度值为纵坐标y,对照品溶液的浓度为横坐标x做标准曲线,得回归方程:y = 20.393x + 0.0047,r = 0.999 3(n = 6),线性范围为9.6 μg/mL~34.1 μg/mL。
1.2.5显色条件的选择
1.2.5.1显色剂50 g/L香草醛-冰乙酸用量的考察
精密移取供试品溶液5份,每份30 μL,按1.2.4项的方法操作,香草醛-冰乙酸的加入量分别为0.1、0.2、0.3、0.4、0.5 mL。在532.0 nm处测定吸光度,结果依次为0.451、0.472、0.458、0.462、0.447。故50 g/L香草醛-冰乙酸的最佳用量为0.2 mL。
1.2.5.2显色剂高氯酸用量的考察
精密移取供试品溶液5份,每份30 μL,按1.2.4项的方法操作,高氯酸的加入量分别为0.6、0.8、1.0、1.2、1.4 mL。在532.0 nm处测定吸光度。结果依次为0.416、0.470、0.461、0.453、0.406。故高氯酸的最佳用量为0.8 mL。
1.2.5.3显色温度的考察
精密移取供试品溶液4份,每份30 μL,按1.2.4项的方法操作,水浴温度分别为50、60、70、80℃。结果发现被测样品吸光度值与水浴加热温度呈正相关,并且当温度超过60℃后,空白溶液逐渐变黄,且在532.0 nm附近无最大吸收,故选60℃为最佳水浴温度。
1.3方法学考察
1.3.1精密度
精密移取供试品溶液5份,每份30 μL,按1.2.4项的方法操作,在532.0 nm处测定吸光度,其值依次为0.470、0.471、0.472、0.472、0.473。可得RSD = 0.24 % (n = 5),说明精密度良好。
1.3.2显色稳定性
精密移取供试品溶液30 μL,按1.2.4项的方法操作,在显色后0~120 min内每隔10 min测定吸光度值。结果表明供试品在显色后的40 min~120 min内稳定,RSD = 1.13 %。
1.3.3重复性
精密称取干枣叶5份,每份约10.0 g,按2.1项方法制备供试品溶液,分别取30 μL,按1.2.4项方法操作,在532.0 nm波长处测定吸光度,其值依次为0.475、0.489、0.482、0.483、0.461、0.467,RSD = 2.22 %(n = 6),说明重复性良好。
1.3.4加样回收率
精密移取5份已知含量的供试品溶液,每份30 μL(皂苷含量138.12 μg),再分别加入0.232 mg/mL人参皂苷Re对照品溶液250 μL,按1.2.4项方法操作,在532.0 nm处测定吸光度。结果显示平均加样回收率为100.36 %,RSD = 2.55 %(n = 5),说明该方法测定结果准确可靠。结果见表1。
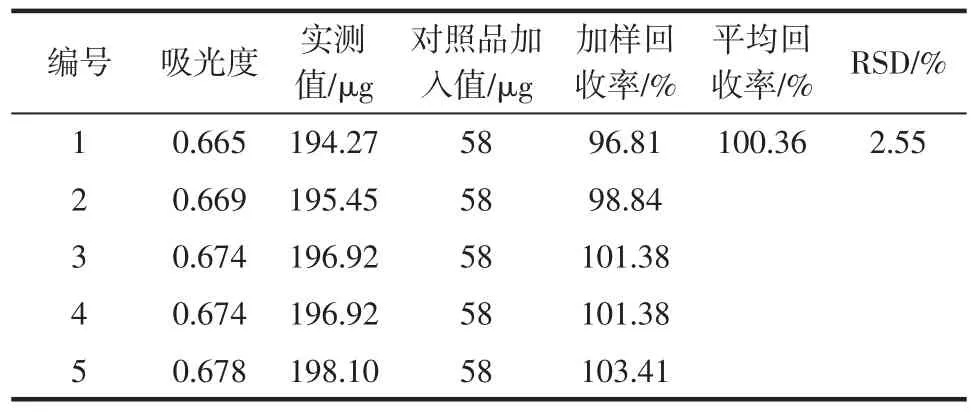
表1加样回收率试验结果Table 1 Results of recovery test
2结果与分析
2.1提取工艺正交试验设计及方差分析
枣叶皂苷提取工艺正交试验结果见表2。
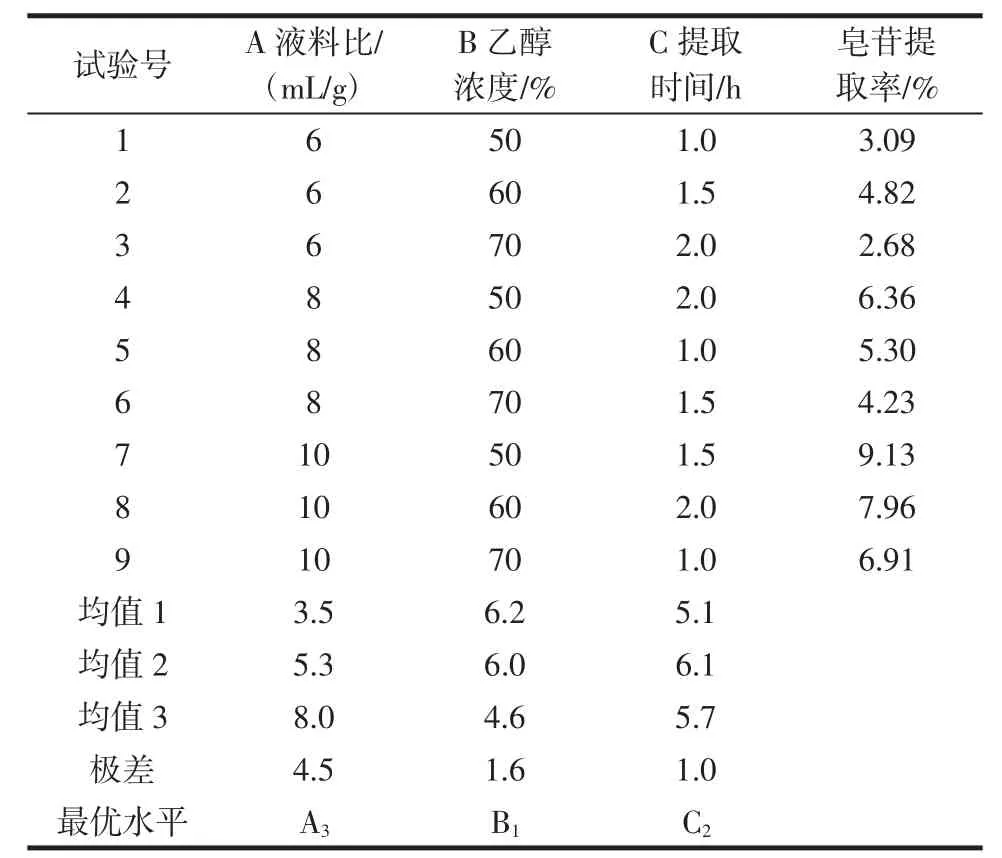
表2提取条件正交试验设计Table 2 The orthogonal design for extraction conditions
由表2可知,三因素的极差大小顺序为A > B > C,即三个因素对三萜皂苷提取率影响的大小顺序为A(液料比)> B(乙醇浓度)> C(提取时间)。
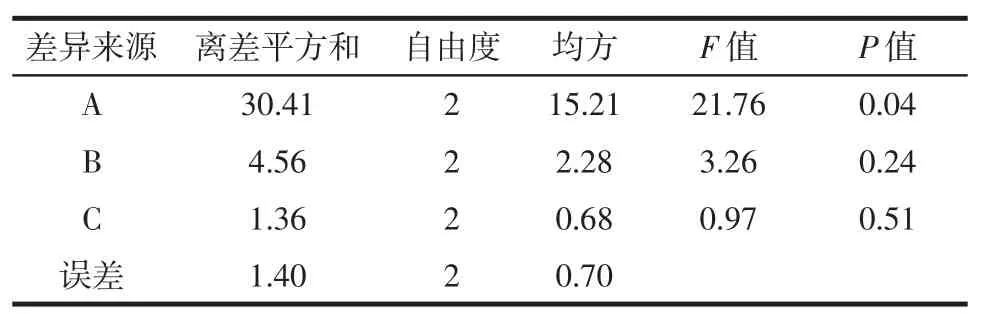
表3方差分析Table 3 The analysis of variance
由表3方差分析的F值可知,3个因素中,A(液料比)对枣叶三萜皂苷提取结果有显著影响(P = 0.04 < 0.05),其他二因素则影响较小。该结果与直观分析结果一致,因此,最佳工艺参数为A3B1C2,即液料比为10∶1(mL/g),乙醇水溶液浓度为50 %,回流提取时间为1.5 h。
2.2样品含量测定
精密称取5份供试品,每份10.0 g,按2.1项方法制备供试品溶液,分别从每份中吸取30 μL,按1.2.4下方法操作,在532.0 nm处测定吸光度,测得红枣叶中三萜皂苷含量为9.208 %,RSD = 2.26 %。结果见表4。
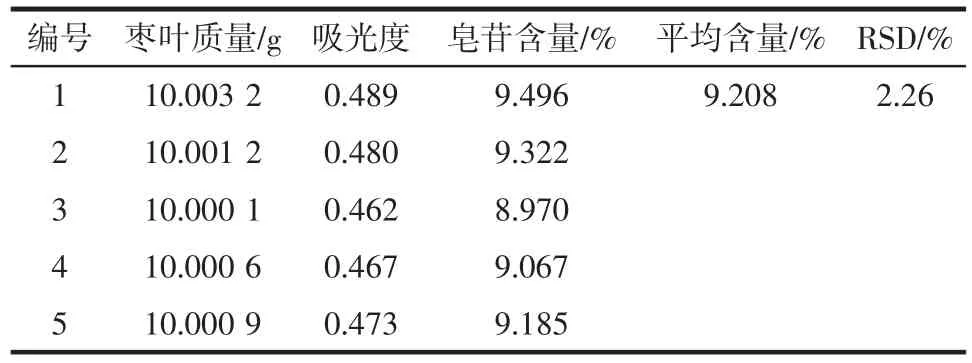
表4样品含量测定结果Table 4 Results of content determination
3 结论
本研究采用L9(34)正交设计对枣叶皂苷提取工艺进一步优化,并对结果进行了直观分析与方差分析,得出红枣叶皂苷提取最佳工艺为:液料比10∶1(mL/g),50 %乙醇水溶液回流提取1.5 h。首次采用香草醛-冰乙酸、高氯酸法测定红枣叶中三萜皂苷的含量,确定出最佳显色条件:50 g/L香草醛-冰乙酸用量为0.2 mL、高氯酸用量为0.8 mL、加热温度为60℃。该方法重复性好,对仪器要求低,稳定可靠,为枣叶皂苷的工业化提取和进一步开发和利用提供了参考。
参考文献:
[1]李时珍.本草纲目[M].天津:天津古籍出版社, 2006: 295
[2]熊辅信,寸树芬.中药现代研究荟萃[M].云南:云南科技出版社, 2002: 520
[3] Du H, Zhao X, Zhang A. Identifying potential therapeutic targets of a natural product jujuboside B for insomnia through network pharmacology[J]. Plant Science Today, 2014, 1(2): 69-79
[4] Guo S, Duan JA, Tang Y, et al. Simultaneous qualitative and quantitative analysis of triterpenic acids, saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDA-MS/ELSD[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 56(2): 264-270
[5] Ganachari M S, Kumar S. Effect of Ziziphus jujuba leaf extract on body weight, food intake and serum lipid levels in sucrose-induced obese rats[J]. Indian Journal of Pharmaceutical sciences, 2004, 66 (3): 363-365
[6] Erenmemisoglu A, Kelestimur F, Koker A H, et al. Hypoglycaemic effect of Zizyphus jujuba leaves[J]. Journal of Pharmacy and Pharmacology, 1995, 47(1): 72-74
[7] Shirdel Z, Madani H, Mirbadalzadeh R. Investigation into the hypoglycemic effect of hydroalcoholic extract of Zizyphus jujuba leaves on blood glucose and lipids in alloxan-induced diabetes in rats[J]. Iranian Journal of Diabetes and Lipid Disorders, 2009, 8(2): 13-19
[8]李全国,楚杰,王君高,等.乐陵枣叶中总黄酮提取工艺研究[J].中国食物与营养, 2013, 19(7): 51-54
[9] Yamada H, Imoto T. Inhibitory effect of the extract from Zizyphus jujuba leaves on sweet taste responses of the chorda tympani in the rat and hamster[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1987, 88(2): 355-360
[10] Kurihara Y, Ookubo K, Tasaki H, et al. Studies on the taste modifiers. I. Purification and structure determination of sweetness inhibitingsubstancein leavesof Ziziphusjujube[J]. Tetrahedron, 1988, 44(1): 61-66
[11]李艳红,林勤保,赵国燕.来自植物的天然甜味抑制剂[J].食品与发酵工业, 2005, 31(2): 93-96
Study on the Extraction Approach and Determination of Triterpene Saponins in the Leaf of Ziziphus jujuba Mill.
LIU Zi-zhen1,JIANG Rui1,LIU Wei-rui1,SHEN Meng1,XIE Meng1,XU Guan-ling1,YAN Cheng1,SONG Yan2,ZHANG Xia1,YANG Yue1,SHE Gai-mei1,*
(1. School of Chinese Pharmacy,Beijing University of Chinese Medicine,Beijing 100102,China;2. College of Pharmacology,Ningxia Medical University,Yinchuan 750004,Ningxia,China)
Abstract:A extraction process and a determination method of triterpene saponins in Ziziphus jujuba leaves was researched. The optimum extraction process of saponins was as follow:50 % aqueous ethanol,solvent to medicine was the ratio of 10∶1(mL/g),reflux extraction time was 1.5 h. The triterpene saponins content in the leaf of Ziziphus jujuba was 9.208 %,RSD = 2.26 %.
Key words:Ziziphus jujuba Mill.;triterpene saponins;extraction procedure;determination
收稿日期:2014-08-31
DOI:10.3969/j.issn.1005-6521.2016.01.015
作者简介:刘子祯(1990—),男(汉),在读硕士,研究方向:中药化学。*通信作者:折改梅,副教授,博导。
基金项目:陕西红枣树叶中黄酮制备技术研究及产业化技术服务(535/03578)

