重组嗜热β-葡萄糖苷酶转化稀有人参皂苷Rd和CK
许春春,于渤浩,王红蕾,李 晶,刘淑莹,3,于珊珊,4
( 1.长春中医药大学吉林省人参科学研究院,长春130000; 2.长春工业大学化学与生命科学学院,长春130024; 3.中国科学院长春应用化学研究所长春质谱中心,长春130022; 4.上海交通大学生命科学技术学院,上海200240)
重组嗜热β-葡萄糖苷酶转化
稀有人参皂苷Rd和CK
许春春1,于渤浩1,王红蕾2,李晶1,刘淑莹1,3,于珊珊1,4
( 1.长春中医药大学吉林省人参科学研究院,长春130000; 2.长春工业大学化学与生命科学学院,长春130024; 3.中国科学院长春应用化学研究所长春质谱中心,长春130022; 4.上海交通大学生命科学技术学院,上海200240)
摘要利用高效液相色谱( HPLC)法,对重组嗜热β-葡萄糖苷酶( Fpglu1)转化稀有人参皂苷( Rd和CK)进行研究,并表征了其催化动力学参数.利用同源模建和分子动力学模拟等生物信息学技术,探究了Fpglu1转化人参皂苷的结构基础及其相互作用.结果表明,Fpglu1能够水解人参总皂苷生成稀有皂苷Rd和CK,其催化人参皂苷Rb1,Rb2和Rc的Km值分别为0. 318,1. 840和5. 269 mmol/L;酶的转换数( kcat)值分别为144. 191,0. 572和0. 011 s-1.当转化时间分别为6和102 h时,Rd和CK的产率达到最大,分别为60%和93%.通过对该酶的结构预测及皂苷分子的对接研究发现,底物位于由疏水性氨基酸构成的底物口袋中,氨基酸残基Glu194和Glu367是参与催化作用的关键,且实验测得的酶促反应动力学参数( Km)与对接的相互作用能量值存在线性关系.
关键词β-葡萄糖苷酶;生物转化;稀有人参皂苷;动力学
人参( Panax ginseng C.A Maye)是我国的传统名贵中药,人参皂苷是人参药用的有效成分.目前,已经从人参中发现100多种天然人参皂苷产物,分离出40余种[1].各种人参皂苷的含量不同、结构多样,药理活性也有很大差别[2].研究[3,4]表明,稀有人参皂苷(如Rd,Rg3,F2,Rh2,CK和CMc等)是一类在人参中痕量存在或不存在的物质,但因其更容易在体内被吸收利用,且具有更显著的药理活性而受到越来越多的关注.人参皂苷Rd和CK是人参皂苷体内代谢后的主要物质,均属于稀有人参皂苷.人参皂苷Rd具有抗肿瘤、治疗动脉粥样硬化和保护神经等作用[5,6];人参皂苷CK具有抗炎、保护心肌、抗过敏、改善记忆力和肾组织病理变化等作用[7,8],尤其在治疗癌症方面疗效显著[9,10].但人参皂苷分子庞大,结构复杂,目前的化学全合成方法仍处于探索阶段;且人参皂苷Rd在人参中含量甚微,而人参皂苷CK根本不存在,难以通过直接提取的方法获得,因此大量高效地制备稀有人参皂苷Rd和CK已成为亟待解决的问题.
基于皂苷核心骨架和化学结构相似原理,通过水解某些含量高、药效低的人参皂苷末端糖基来大量制备稀有人参皂苷已成为目前最为可行的方法.化学水解法通常选择性较差、产率低、不易提纯且易造成环境污染.糖苷酶水解法则具有区域选择性和立体选择性高、产率高、副产物少、无污染和容易工业化生产等优点,是制备稀有人参皂苷最具有潜力的方法[11,12].目前,已有多种用于转化稀有人参皂苷Rd和CK的糖苷水解酶被报道,如β-D-葡萄糖苷酶、α-L-阿拉伯吡喃糖苷酶和α-L-阿拉伯呋喃糖苷酶[13~16],但是对转化人参皂苷Rd及CK的糖苷酶研究多集中在酶学性质及转化性质的定性定量研究,对于糖苷酶转化皂苷分子的结构基础及其相互作用的研究尚未见报道.此外,人参皂苷Rd和CK仍未实现大规模工业化生产,从而限制了其药理研究及新药开发的进程.这主要是因为目前用于皂苷转化的酶活性或稳定性较低,且多以单一皂苷作为转化底物,转化途径单一,原料成本高;而使用原料成本相对低廉的总皂苷进行转化时需应用多酶体系,从而增加了工业生产中对设备的要求及操作难度.
本文利用高效液相色谱( HPLC)法,对重组嗜热β-葡萄糖苷酶( Fpglu1)转化稀有人参皂苷Rd和CK进行了研究,表征了其催化动力学参数.利用同源模建和分子动力学模拟等生物信息学技术,探究了Fpglu1转化人参皂苷的结构基础及其相互作用.结果表明,Fpglu1能够以价格较低廉的总皂苷作为原料高效制备稀有人参皂苷Rd和CK,为工业化生产稀有人参皂苷Rd和CK奠定了基础,同时对Fpglu1蛋白分子与皂苷分子相互作用的研究也将对进一步的定向进化具有借鉴意义.
1 实验部分
1.1试剂与仪器
人参皂苷Rb1,Rb2,Rc,Rd和CK均购自南京泽朗生物有限公司;色谱纯乙腈和甲醇购自美国TEDIA试剂公司;工程菌BL21-28a-Fpglu1由本实验室提供,其基因来源于嗜热细菌Fervidobacterium pennivorans DSM9078.
Agilent 1200型高效液相色谱仪(美国Agilent公司) ; TU-1810型紫外-可见分光光度计(北京普析通用仪器有限责任公司) ; JY92-IIN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司).
1.2重组糖苷酶的表达和纯化
向100 mL含30 μg/mL卡那霉素的Luria-Bertani( LB)液体培养基中加入2 mL工程菌,于37℃,170 r/min转速下振荡培养10 h后;转移至2 L含30 μg/mL卡那霉素的LB液体培养基中,于37℃,170 r/min转速下振荡培养,直至菌液在600 nm波长处测得的吸光度值( OD600)达到0. 6~0. 8时,在培养基中加入2 mL异丙基-β-D-硫代半乳糖苷( IPTG,1 mol/L),于30℃,120 r/min转速下诱导过夜;将发酵液于4℃,8000 r/min转速下离心5 min,弃去上层清液,收集菌体.
称取约4. 7 g菌体,加入47 mL磷酸氢二钠-柠檬酸缓冲液( 20 mmol/L,pH=7. 0)重悬,菌体的终浓度为0. 1 g/mL,冰浴下超声破碎60 min(工作时间3 s,间隔时间3 s),于4℃,8000 r/min转速下离心50 min后,收集上层清液即为粗酶液;采用镍柱亲和层析法纯化,用含20 mmol/L咪唑的洗脱液除去杂蛋白,再用咪唑洗脱液( 150 mmol/L)收集目的蛋白,收集到的蛋白于磷酸氢二钠-柠檬酸缓冲液( 20 mmol/L,pH=7. 0)中透析过夜,并于-20℃下保存.采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳( SDS-PAGE)验证蛋白纯度[17].
1.3 HPLC色谱条件
色谱测试使用Agilent 1200型高效液相色谱仪和C18反相色谱柱( 5 cm×3. 0 mm,i.d.2. 7 μm) ;流动相为水( A)和乙腈( B),流速1. 0 mL/min;进样量5 μL;检测波长203 nm;柱温箱温度35℃.梯度洗脱条件: 0~5 min,15%~19% B; 5~7. 5 min,19% B; 7. 5~10 min,19%~30% B; 10~16 min,30%~33%B; 16~25 min,33%~45%B; 25~30 min,45%~65%B; 30~33 min,65%~80%B; 33~40 min,80%~100%B; 40~45 min,100%B(百分数均为体积分数).
1.4 Fpglu1转化人参总皂苷
人参总皂苷( 2 mg/mL)与等体积的酶溶液( 0. 267 mg/mL)于70℃反应,间隔时间取样,加入等体积的水饱和正丁醇终止反应,涡旋2~3 s后,于4℃,10000 r/min转速下离心2 min,静置10 min后取上层溶液,水浴蒸干,用色谱纯甲醇复溶,定容至1 mL,用0. 45 μm有机膜过滤,进行HPLC分析.
1.5 Fpglu1动力学测定
1.5.1人参皂苷Rb1,Rb2和Rc动力学反应时间的确定在20 mmol/L磷酸氢二钠-柠檬酸缓冲液( pH=7. 0)中,Fpglu1分别与人参皂苷Rb1( 0. 036 mmol/L)、人参皂苷Rb2( 0. 200 mmol/L)和人参皂苷Rc( 1. 000 mmol/L)于70℃下反应,间隔时间取样.样品处理方法参见1.4节,每个时间点分别做3个平行样品,保证底物的消耗量不超过20%[18].
酶活力单位( IU)定义:每分钟催化转化1 μmol人参皂苷所需的酶量定义为1 IU.
1.5.2米氏常数Km和vmax的测定利用液相色谱分析方法,分别测定人参皂苷Rb1,Rb2和Rc在0. 036~0. 900 mmol/L,0. 200~5. 000 mmol/L和1. 000~9. 700 mmol/L浓度范围内的酶催化动力学参数.
动力学数据分析依据Michael和Menten提出的酶反应动力学原理,即米氏方程进行计算.

式中: v为不同底物浓度时的反应速度; vmax为最大反应速度; Km为米氏常数; c为底物浓度.
1.6计算方法
应用Accelrys公司的Discovery Studio( DS) 3.5分子设计软件包进行同源模建及分子对接的计算.1.6.1同源模建DS3.5软件的Homology Modeling主要基于MODELER程序[19],其主要建模步骤如下: ( 1)使用序列相似性搜索工具BLAST或PSI-BLAST搜索目标序列的模板; ( 2)使用结构比对方法将模板进行比对、叠合; ( 3)使用序列比对方法将目标序列与模板结构的序列进行比对; ( 4)使用MODELLER产生目标序列的模型.对模建后的结构应用Procheck程序得到Ramachandran图.
1.6.2分子对接采用DS3.5软件的CDOCKER模块进行分子对接,CDOCKER是基于CHARMm力场的分子对接方法,能够产生高精度的对接结构.将皂苷分子(人参皂苷Rb1,Rb2和Rc)放入活性口袋进行多构象搜索,利用CHARMm力场对复合物进行模拟退火,以优化对接构象.将得到的配体构象进行聚类分析( RMSD≤0. 5 nm),分析对接能量较低的前10个构象,根据聚类情况和对接打分选取最佳构象.
2 结果与讨论
2.1 Fpglu1的纯化
粗酶液经镍柱亲和层析纯化后,利用SDS-PAGE电泳法分析蛋白样品纯度.由图1可见,目的蛋白呈单一条带,其分子量约为54000,与该酶的预测分子量相符;经纯化后的目的蛋白纯度达95%,浓度为7. 35 mg/mL.
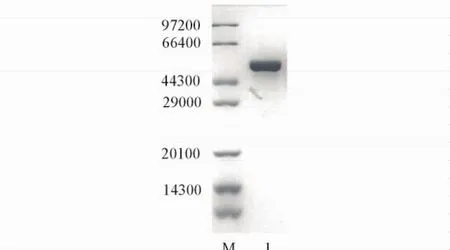
Fig.1 SDS-PAGE analysis of Fpglu1 after purificationLane M: standard protein molecular mass makers; lane 1: Fpglu1 purified by Ni-NTA chromatography.
2.2 Fpglu1转化人参总皂苷的产物鉴定
图2为Fpglu1转化人参总皂苷的HPLC分析结果.通过与标准品保留时间比对来鉴定转化产物.标准品人参皂苷Rg1,Re,Rb1,Rb2,Rc,Rd,F2,Rg3,CMc,CK和Rh2的保留时间分别为9. 435,9. 544,13. 249,13. 848,14. 602,16. 195,21. 473,23. 136,24. 276,27. 123和27. 792 min[图2( A)].根据人参皂苷的标准曲线计算各时刻反应液中不同皂苷的含量,通过对比转化前[图2( B)]与转化后[图2( C)和( D)]各皂苷含量的变化,发现转化过程中Re和Rg1的含量始终未发生变化,表明Fpglu1不能够转化Re和Rg1;反应10 min后,Rb1转化完全,Rb2和Rc含量均减少,而Rd的含量升高[图2( C)];反应2 h时,Rb2转化完全,Rc含量继续减少,Rd的含量进一步增多,并产生新的转化产物1,与标准品进行比对后确定该物质为稀有人参皂苷CK[图2( D)];反应6 h时,Rc含量继续减少,CK含量增加,Rd含量达到最高,并伴随产生新的转化产物2,与标准品比对后确定该物质为稀有人参皂苷CMc[图2( E)];反应66 h时,Rc和Rd含量均降低,CMc含量达到最高,CK含量进一步增加[图2( F)];反应78 h时,Rc转化完全,Rd和CMc含量降低[图2( G)],CK含量增高;反应102 h时,Rd和CMc含量继续减少,CK含量达到最大[图2 ( H)].可见,控制反应时间可分别获得稀有人参皂苷Rd和CK,即6 h时,人参皂苷Rd的含量最高,产率可达60%; 102 h时,人参皂苷CK的含量最高,产率可达93%.
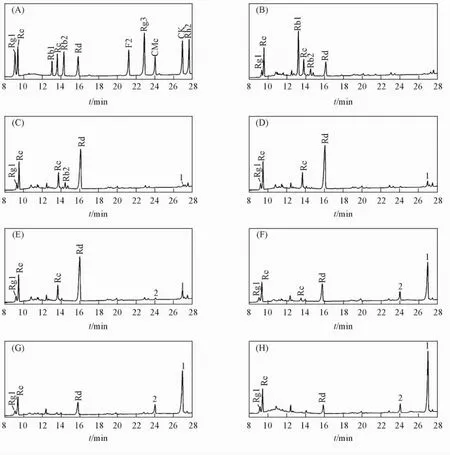
Fig.2 HPLC analysis of biotransformation of the ginseng root extract at different time( A) Standard ginsenosides; ( B)—( H) Fpglu1 reacted with 2 mg/mL ginseng root extract for 0,1/6,2,6,66,78 and 102 h,respectively in 20 mmol/L sodium phosphate buffer( pH=7. 5) at 70℃.
2.3 Fpglu1转化人参总皂苷的转化路径
达玛烷型人参皂苷根据其C3,C6和C20位上糖基种类和数量的不同可以分为二醇型人参皂苷和三醇型人参皂苷,而二醇型人参皂苷可根据C3和C20位上连接的糖基种类和数量的不同进行区分.本文实验结果表明,Fpglu1对三醇型人参皂苷无水解活性,但能够水解二醇型人参皂苷Rb1,Rb2和Rc,生成稀有人参皂苷Rd和CK.二醇型人参皂苷Rb1,Rb2和Rc的结构相似,具有共同的原人参二醇型皂苷元,且C3位都连有2个葡萄糖[Glc-β-( 1,2) -Glc],差别在于C20位侧链糖基的不同,即Rb1的C20位是2个葡萄糖以β-( 1→6)糖苷键相连接,Rb2的C20位是1个阿拉伯吡喃糖和1个葡萄糖以α-( 1→6)阿拉伯糖苷键相连接,Rc的C20位是1个阿拉伯呋喃糖和1个葡萄糖以α-( 1→6)阿拉伯糖苷键相连接.研究[20]发现,当转化人参皂苷Rb1时,Fpglu1先水解人参皂苷Rb1的C20位的β-( 1→6)糖苷键生成Rd,随后水解其C3位的与皂苷元相连的葡萄糖苷键生成CK;当转化人参皂苷Rb2时,Fpglu1先水解人参皂苷Rb2的C20位的α-( 1→6)阿拉伯糖苷键生成Rd,再水解其C3位与皂苷元相连的葡萄糖苷键生成CK;当转化人参皂苷Rc时,Fpglu1经过2条转化路径,即Fpglu1水解Rc的C20位的α-( 1→6)阿拉伯糖苷键生成Rd,再水解其C3位与皂苷元相连的葡萄糖苷键生成CK,或Fpglu1水解人参皂苷Rc的C3位与皂苷元相连的葡萄糖苷键生成CMc,再水解其C20位的α-( 1→6)阿拉伯糖苷键生成CK,2条路径同时存在,并得到共同的最终产物CK.另外还发现,Fpglu1不能水解人参皂苷CK的C20位内侧葡萄糖苷键.可见,Fpglu1转化人参总皂苷的转化路径为Rb1→Rd→CK,Rb2→Rd→CK以及Rc→Rd/CMc→CK,其中Rb1→Rd→CK为主要的转化途径(见图3).
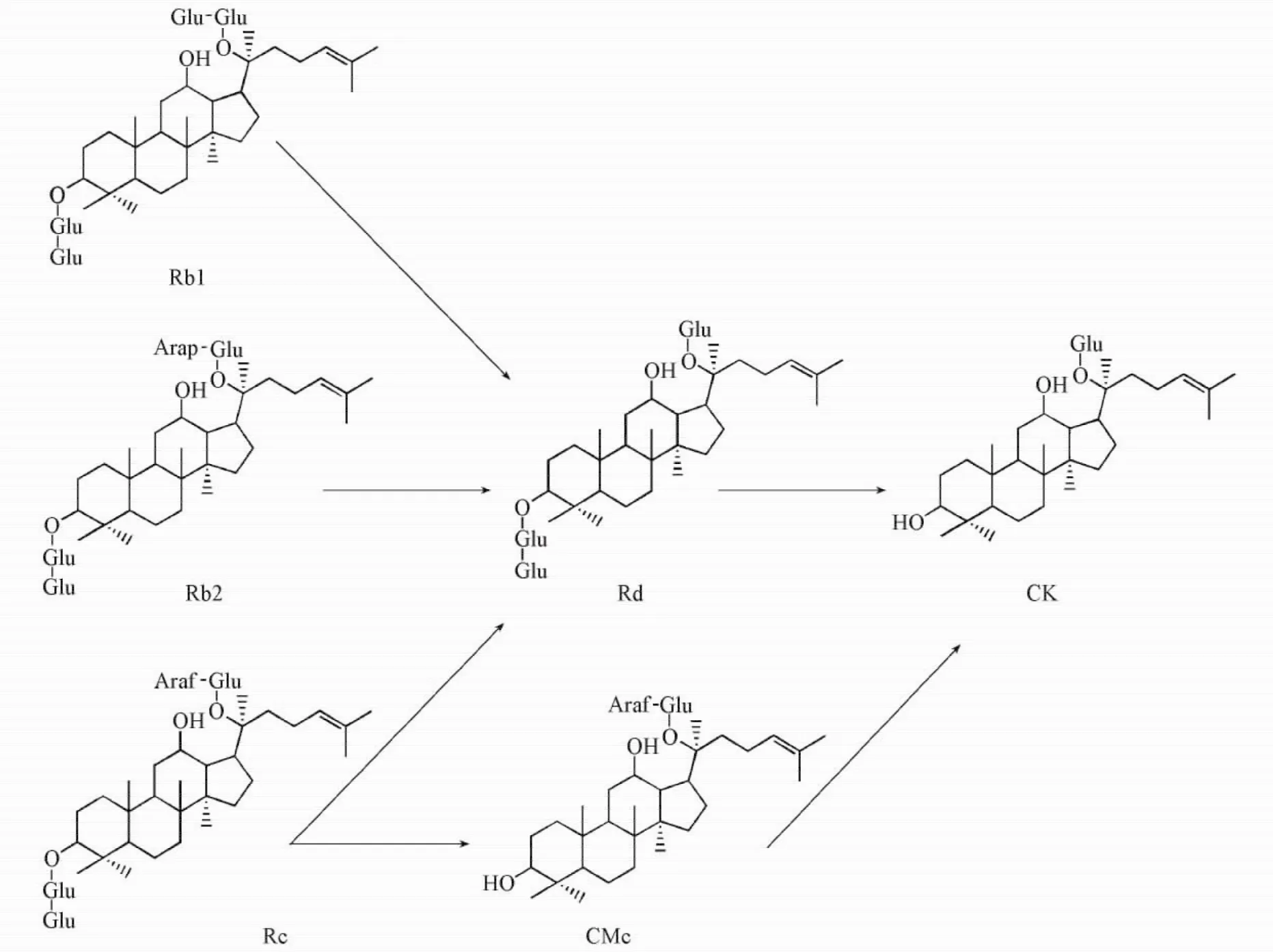
Fig.3 Transformation pathways of the ginsenosides Rb1,Rb2and Rc by Fpglu1The transformation pathways were Rb1→Rd→CK,Rb2→Rd→CK and Rc→Rd/CMc→CK.
2.4 Fpglu1转化人参总皂苷的时间进程
经HPLC定量分析,由人参皂苷的标准曲线求得各皂苷含量分别为Rb10. 185 mg/mL( 0. 167 mmol/L),Rb20. 049 mg/mL( 0. 046 mmol/L),Rc 0. 083 mg/mL( 0. 077 mmol/L)和Rd 0. 054 mg/mL ( 0. 058 mmol/L).通过间隔时间取样并经HPLC检测,Fpglu1转化人参总皂苷的时间进程曲线如图4所示.当反应6 h时,生成人参皂苷Rd 0. 197 mg/mL( 0. 208 mmol/L),其摩尔产率为60%,平均生成速度为23. 8 mg·L-1·h-1;当反应102 h时,生成人参皂苷CK 0. 201 mg/mL( 0. 323 mmol/L),其摩尔产率为93%,平均生成速度为1. 97 mg· L-1·h-1.
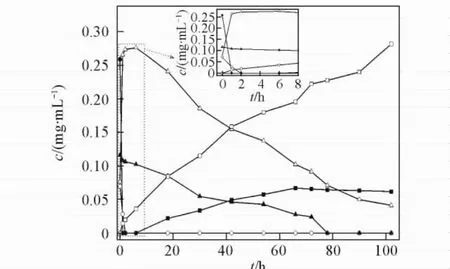
Fig.4 Production of Rd and CK from the ginseng root extract by Fpglu1●: Ginsenoside Rb1;○: Ginsenoside Rb2;▲: Ginsenoside Rc;△: Ginsenoside Rd;■: CMc;□: CK.
目前,用于Rd和CK转化的糖苷酶类主要以单一皂苷作底物进行转化[16,21~23],而鲜见利用总皂苷进行转化的报道.实验应用的人参总皂苷为人参根提取物,其制备过程简单、价格低廉,节约了生产稀有人参皂苷的工业成本.通过控制反应时间,可应用Fpglu1水解人参总皂苷较高产率生成稀有人参皂苷Rd和CK,为大量制备稀有人参皂苷Rd和CK奠定了基础.
2.5 Fpglu1转化人参皂苷Rb1,Rb2和Rc的催化动力学
利用HPLC法测定3种底物的反应时间,根据人参皂苷的标准曲线求得不同时刻底物的含量并计算转化率.在70℃下,Rb1浓度为0. 036 mmol/L时,测定0,1,2和5 min时的底物转化率; Rb2浓度为0. 200 mmol/L时,测定0,1,1. 5和2 h时的底物转化率; Rc浓度为1. 000 mmol/L时,测定0,0. 5,1. 5,2和3 h时的底物转化率.结果表明,当控制反应时间为1 min,1和1. 5 h时,人参皂苷Rb1,Rb2和Rc的底物转化率均未超过20%,因此确定1 min,1和1. 5 h分别为测定3种底物动力学的反应时间.
人参皂苷Rb1( 0. 036~0. 900 mmol/L),Rb2( 0. 200~5. 000 mmol/L)和Rc( 1. 000~9. 700 mmol/L)分别与Fpglu1在70℃反应1 min,1和1. 5 h后,计算不同底物浓度时的反应速度.对数据进行拟合后,得到Km值分别为0. 318,1. 840和5. 269 mmol/L,最大速度( vmax)值分别为1901. 41,18. 87和0. 69 mmol·L-1·h-1·mg-1,拟合曲线R2分别为0. 992,0. 992和0. 996(见图5).
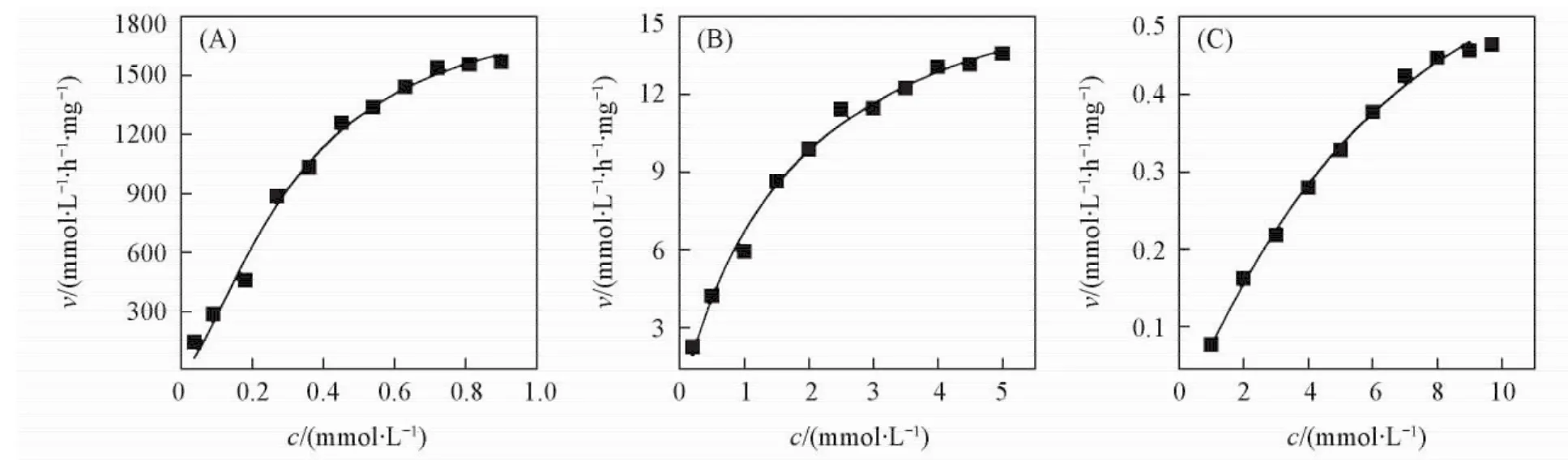
Fig.5 Fitting curve of ginsenosides Rb1( A),Rb2( B) and Rc( C)
Km是酶促反应的初速度为vmax的1/2时的底物浓度,仅与酶的性质有关,与酶的浓度无关,Km值越小,表示酶与底物的亲和力越高; vmax表示在一定酶量下的最大反应速度,即酶完全被底物饱和时的反应速度,与酶的浓度呈正比; kcat表示单位时间内每个酶分子将底物分子转换成产物的最大值,kcat越大,表示酶的催化效率越高.一般情况下,Km值越小,vmax值越大,kcat值也越大,对Fpglu1的动力学参数测定结果符合以上规律,即Fpglu1对3种皂苷底物的亲和能力和催化效率从高到低的顺序为Rb1>Rb2>Rc.
2.6 Fpglu1结构模型构建及模型评价
通常,在同源模建中当序列一致性高于30%时模建的结果具有较高的可信度.应用BLAST Search模块搜索到的模板序列与Fpglu1序列一致性为51. 48%,晶体结构分辨率为0. 17 nm,因此选择该蛋白质晶体结构( 3wdp)作为模板,应用DS3. 5软件的Homology Modeling功能构建Fpglu1的三维结构模型.使用Ramanchandran Plot和Profile-3D对模型进行评估.
拉氏构象图[Ramachandran图,图6( A)]是以φ和ψ的角度为横纵坐标,规定φ和ψ角允许的构象区域的一个图形[φ( phi)表示一个肽单位中α碳右边C—C键的旋转角度,ψ( psi)表示α碳左边C—N键的旋转角度,通过该图可鉴定蛋白质构象是否合理.图6( A)中红色的点表示落在不合理区域内的残基.Fpglu1结构模型位于合理区域内的残基百分比为99. 14%,位于不允许区域内的残基均不在活性位点区域.
Profile-3D是一种基于“穿线”法的模型评估程序.该方法采用3D-1D的打分函数来检测所构建模型与自身氨基酸序列的匹配度关系,分数越高,说明同源模型的可信度越大.Fpglu1的Profiles-3D打分为222. 61,高于理想最高分212. 797,表明该建模蛋白的残基均位于合理可信的位置.以上结果表明,经同源建模所得的Fpglu1三维结构合理可靠.
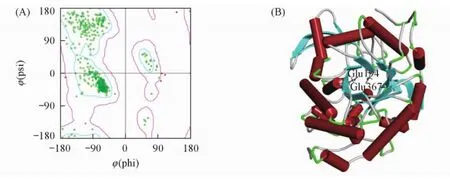
Fig.6 Ramachandran plot analysis and predicted 3D structure of Fpglu1( A) Ramachandran plot showing different regions of the modeled enzyme; ( B) the overall structure of the Fpglu1 model.
Fpglu1的蛋白质三级结构建模结果如图6( B)所示.Fpglu1的整体结构呈现1个典型TIM桶状结构,为糖苷水解酶家族1的典型结构,TIM滚筒结构的中心是平行的β片层结构,周围包裹着长短相间的α螺旋.Fpglu1的三维结构是由20个α螺旋和14个β折叠组成,β折叠形成了该酶的主体结构,位于结构的中心,α螺旋分布于β折叠的周围.同时,结构中有1个可供小分子物质进入的口袋式结构,催化残基Glu194和Glu367位于口袋中心位置,这是典型的外切型糖苷酶构象.口袋的深度、长度、结构内部疏水性的大小以及周围氨基酸残基的极性可能会影响该酶的活力或底物选择性.以上结构是Fpglu1发挥催化活力的结构基础,对Fpglu1的结构分析对于进一步的定向进化或定点改造具有借鉴意义.
2.7皂苷分子与Fpglu1结构模型的分子对接及分析
迄今为止,糖苷酶催化皂苷类分子的结构基础及催化机制的研究仍处于空白,而皂苷类分子作为β-葡萄糖苷酶的非天然底物,对皂苷分子与蛋白质相互作用的研究将有助于阐明其催化的选择性机制.本文结果表明Fpglu1对人参皂苷Rb1,Rb2和Rc均具有催化活性,推测得到的活性中心附近区域的残基为中心,应用DS3.5软件的CDOCKER模块将3种皂苷分子(人参皂苷Rb1,Rb2和Rc)对接到蛋白活性中心处.由于皂苷分子的多环结构使其刚性增强,因而选择CDOCKER INTER-ENERGY值对对接结果进行分析和评价[24].
分子对接结果[图7( A)]表明,底物位于活性部位的底物口袋中,此口袋中的疏水性氨基酸侧链形成了底物口袋的疏水环境,这些疏水性氨基酸包括Phe139,Val197,Leu201,Phe210,Phe339,Trp341,Trp405,Trp413和Phe421.参与催化作用的2个关键氨基酸残基,即β4上的Glu194和β10上的Glu367位于活性口袋中.为了进一步确定参与底物结合的关键氨基酸残基与底物的相互作用,选取距离底物0. 3 nm范围内的氨基酸为研究对象,发现与底物可能具有相互作用的残基还包括Ser13,His138,Asn193,Glu194,Gln200,Gln205,Met207,Ala208,Thr253,Asn291,Tyr293,Arg318,Tyr322,Glu326,Phe339,Glu367,Trp341,Trp405,Glu412,Trp413和Phe421.从皂苷分子与Fpglu1蛋白的二维结构图可知,皂苷分子可与Tyr293,Glu367,Glu412,Gln16,Trp413,His138和Asn193形成氢键; 而Phe139,Val197,Gln200,Leu201,Thr253,Phe421和Phe210则主要通过范德华力与底物相互作用[图7( B)].
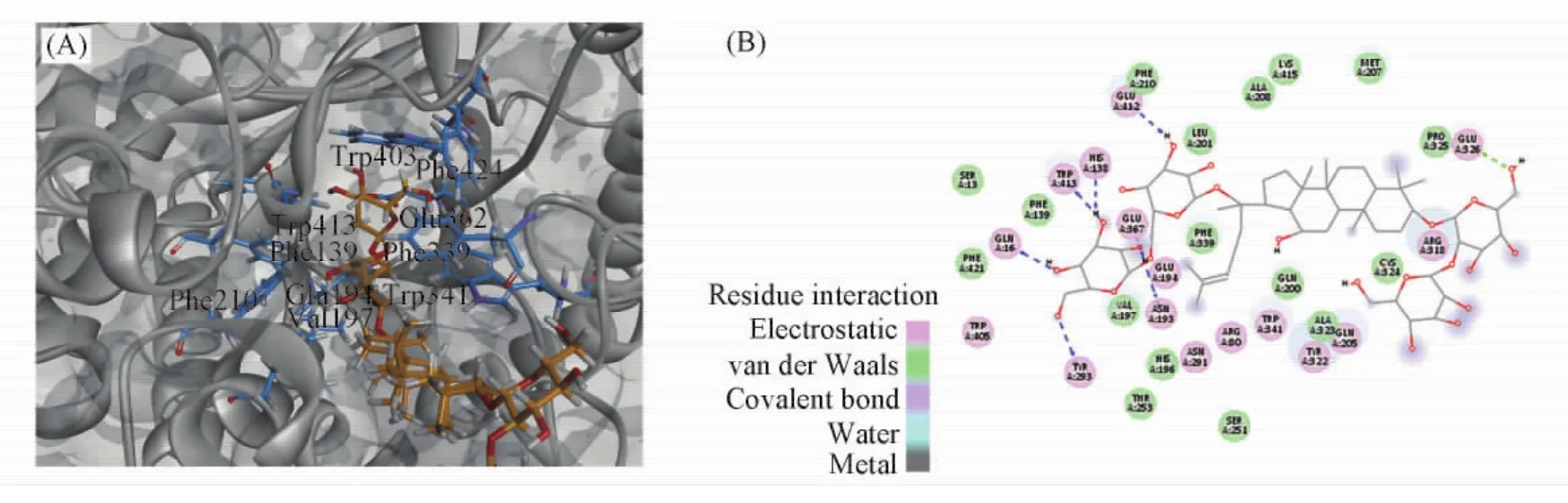
Fig.7 Docking model of Fpglu1 with ginsenoside Rb1( A) A zooming view showing the docking model with ginsenoside Rb1.The hydrophobic amino acids around ginsenoside Rb1and the key catalytic amino acids were indicated.The ginsenoside Rb1and the surrounding amino acids are colored yellow and blue,respectively; ( B) amino acid residues close to ginsenoside Rb1inside the binding pocket of Fpglu1( 2D view).
通过CDOCKER计算得到的人参皂苷Rb1,Rb2和Rc与蛋白分子的相互作用能值呈现逐渐升高的趋势(见表1),与动力学实验结果相比,相互作用能值的变化趋势与其动力学参数Km值的变化趋势一致,而与kcat值的变化趋势相反,因而从能量的角度再次证明了Fpglu1的最适底物为人参皂苷Rb1,具有最大的催化效率.

Table 1 Kinetic parameters of Fpglu1 for Ginsenosides
3 结 论
Fpglu1能够转化人参皂苷Rb1,Rb2和Rc生成稀有人参皂苷Rd和CK,其摩尔产率可分别达到60%和93%;利用同源模建和分子动力学模拟等生物信息学技术,探究了Fpglu1转化人参皂苷的结构基础及其相互作用.底物位于由疏水性氨基酸构成的底物口袋中,Glu194和Glu367是参与催化作用的关键氨基酸残基,酶促反应动力学参数Km与对接的相互作用能量值存在线性关系.本文结果为实现高效率和低成本生产稀有人参皂苷Rd和CK提供了新型酶源,同时为糖苷酶转化人参皂苷的定向进化研究奠定了基础.
参考文献
[1]Cheng Y.Q.,Jin Y.Z.,Liang D.C.,Chem.J.Chinese Universities,2011,32( 1),67—73(成乐琴,金瑜真,梁德春.高等学校化学学报,2011,32( 1),67—73)
[2]Chi H.,Kim D.H.,Ji G.E.,Biol.Pharm.Bull.,2005,28( 11),2102—2105
[3]Kim S.K.,Park J.H.,J.Ginseng Res.,2011,35( 4),389—398
[4]Wang Y.Z.,Chen J.,Chu S.F.,Wang Y.S.,Wang X.Y.,Chen N.H.,Zhang J.T.,J.Pharmacol.Sci.,2009,109( 4),504—510
[5]Shin J.Y.,Lee J.M.,Shin H.S.,Park S.Y.,Yang J.E.,Cho S.K.,Yi T.H.,J.Ginseng Res.,2012,36( 1),86—92
[6]Guan Y.Y.,Zhou J.G.,Zhang Z.,Wang G.L.,Cai B.X.,Hong L.,Qiu Q.Y.,He H.,Eur.J.Pharmacol.,2006,548( 1―3),129—136
[7]Park J.S.,Shin J.A.,Jung J.S.,Hyun J.W.,Le T.K.V.,Kin D.H.,Park E.M.,Kim H.S.,J.Pharmacol.Exp.Ther.,2012,341 ( 1),59—67
[8]Tsutsumi Y.M.,Tsutsumi R.,Mawatari K.,Nakaya Y.,Kinoshita M.,Tanaka K.,Oshita S.,Life Sci.,2011,88( 15/16),725—729
[9]Suda K.,Murakami K.,Murata J.,Hasegawa H.,Saiki I.,J.Tradit.Chin.Med.,2000,17( 4),144—150
[10]Li W.,Liu Y.,Zhang J.W.,Ai C.Z.,Xiang N.,Liu H.X.,Arch.Pharm.Res.,2009,32( 1),49—57
[11]Jiang B.H.,Han Y.,Zhao Y.Q.,Hu X.M.,Zheng L.X.,Chin.Tradit.Herb.Drugs,2004,35( 9),986—988(姜彬慧,韩颖,赵余庆,胡筱敏,郑龙熙.中草药,2004,35( 9),986—988)
[12]Li G.H.,Shen Y.M.,Zhang K.Q.,Chinese Chem.Lett.,2005,16( 3),359—361
[13]An D.S.,Cui C.H.,Sung B.H.,Yang H.C.,Kim S.C.,Lee S.T.,Im W.T.,Kim S.G.,Appl.Microbiol.Biotechnol.,2011,94 ( 3),673—682
[14]Shin H.Y.,Park S.Y.,Sung J.H.,Kim D.H.,App.Environ.Microbiol.,2003,69( 12),7116—7123
[15]An D.S.,Cui C.H.,Lee H.G.,Wang L.,Kim S.C.,Lee S.T.,Jin F.X.,Yu H.S.,Chin Y.W.,Lee H.K.,Im W.T.,Kim S.G.,App.Environ.Microbiol.,2010,76( 17),5827—5836
[16]Quan L.H.,Jin Y.,Wang C.,Min J.W.,Kim Y.J.,Yang D.C.,J.Ind.Microbiol.Biotechnol.,2012,39( 10),1557—1562
[17]Yu S.S.,Yin H.B.,Wang X.Y.,Feng L.,Xu C.C.,Li J.,Han H.X.,Liu S.Y.,Chem.Res.Chinese Universities,2014,30( 5),778—784
[18]Zhang D.J.,Screening of Highly Active Glycosidase for Rare Ginsenosides Production,Hanzhou Normal University,Hangzhou,2013(张道军.高活性人参皂苷催化酶的筛选,杭州:杭州师范大学,2013)
[19]Tu G.G.,Liu C.,Liao Y.J.,Xiong S.T.,Li S.H.,Chem.J.Chinese Universities,2014,35( 5),1063—1067(涂国刚,刘超,廖一静,熊胜涛,李少华.高等学校化学学报,2014,35( 5),1063—1067)
[20]Park C.S.,Yoo M.H.,Noh K.H.,Oh D.K.,Appl.Microbiol.Biotechnol.,2010,87( 1),9—19
[21]Son J.W.,Kim H.J.,Oh D.K.,Biotechnol.Lett.,2008,30( 4),713—716
[22]Shin K.C.,Lee G.W.,Oh D.K.,J.Microbiol.Biotech.,2013,23( 4),483—488
[23]Quan L.H.,Min J.W.,Jin Y.,Wang C.,Kim Y.J.,Yang D.C.,J.Agr.Food Chem.,2012,60( 14),3776—3781
[24]Fang T.,Sun C.W.,Xu Y.Y.,Yuan J.,Wang Y.F.,Xing J.H.,Chem.Res.Chinese Universities,2014,30( 6),931—936
Transformation of Minor Ginsenoside Rd and CK by Recombinant Thermostable β-Glucosidase†
XU Chunchun1,YU Bohao1,WANG Honglei2,LI Jing1,LIU Shuying1,3*,YU Shanshan1,4*
( 1.Jilin Ginseng Academy,Changchun University of Chinese Medicine,Changchun 130000,China; 2.School of Chemistry and Bioscience,Changchun University of Technology,Changchun 130024,China; 3.Changchun Center of Mass Spectrum,Changchun Institute of Applied Chemistry,Chinese Academy of Sciences,Changchun 130022,China;
4.School of Life Sciences and Biotechnology,Shanghai Jiaotong University,Shanghai 200240,China)
Abstract Ginsenosides are the principle components that are responsible for the biological and pharmacological activities of ginseng.In this study,biotransformation of ginsenside Rd and CK by recombinant β-glucosidasse( Fpglu1) was studied by high performance liquid chromatography( HPLC).Structure modeling and molecular docking studies were performed to study the interaction between the protein and the ginsenosides.The results showed that ginsenoside Rd and CK could be transformed from major ginsenosides Rb1,Rb2and Rc by Fpglu1.The Kmvalues for Rb1,Rb2and Rc were 0. 318,1. 840 and 5. 269 mmol/L,and the kcatvalues were 144. 191,0. 572 and 0. 011 s-1,respectively.The highest productivity of ginsenoside Rd and CK were 60% and 93% with biotransformation time of 6 and 102 h,respectively.Molecular docking studies show that Glu194 and Glu367 are key active site residues and the predicted inter-energy exhibits linear relations to experimental Kmvalues and kcatvalues.
Keywords β-Glucosidase; Biotransformation; Ginsenoside; Kinetics
( Ed.: P,H,D,K)
†Supported by National Natural Science Foundation of China( No.31400682) and the Key Technologies R&D Programme of Changchun,China( No.13KG60).
基金项目:国家自然科学基金(批准号: 31400682)和长春市重大科技攻关计划项目(批准号: 13KG60)资助.
收稿日期:2015-07-09.网络出版日期: 2015-12-26.
doi:10.7503/cjcu20150536
中图分类号O629; O641
文献标志码A
联系人简介:于珊珊,女,博士,讲师,主要从事人参皂苷生物转化研究.E-mail: yushanshan001@ aliyun.com刘淑莹,女,博士,研究员,博士生导师,主要从事质谱学研究.E-mail: syliu@ ciac.jl.cn

