羽衣甘蓝裂叶相关性状遗传分析
祝朋芳,冯 馨,程明明,潘志超
(沈阳农业大学 林学院,沈阳 110161)
羽衣甘蓝裂叶相关性状遗传分析
祝朋芳,冯馨,程明明,潘志超
(沈阳农业大学 林学院,沈阳 110161)
摘要:以羽衣甘蓝圆叶自交系‘0835’和裂叶自交系‘0819’为亲本,调查P1、P2、F1、F2群体莲座期4个裂叶相关性状表型数据,运用‘四世代主基因+多基因’遗传模型,对叶长、叶宽、叶形指数、叶缘缺刻数4个叶形相关性状进行遗传分析,探讨羽衣甘蓝裂叶相关性状的遗传规律,为羽衣甘蓝裂叶性状遗传、QTL定位及新品种选育奠定基础。结果表明:(1)4个性状均存在一定的杂种优势,其中叶缘缺刻数中亲优势达显著水平,4个性状均存在负向超亲优势。(2)叶长和叶宽均符合E-4模型,即由2对等加性主基因+加性-显性多基因共同控制;叶长主基因遗传率为83.80%,多基因遗传率为1.05%;叶宽主基因遗传率为22.28%,多基因遗传率为61.92%。(3)叶形指数和叶缘缺刻数均符合E-1模型,即由2对加性-显性-上位性主基因+加性-显性多基因控制;叶形指数主基因遗传率为93.73%,多基因遗传率为2.59%;叶缘缺刻数主基因决定了表型变异的91.18%。
关键词:羽衣甘蓝;裂叶;遗传模型;主基因;多基因
羽衣甘蓝(Brassicaoleraceavar.acephala)是十字花科芸薹属二年生观叶植物,因其叶形多变,叶色丰富,耐寒性强,在园林中广泛应用[1-2]。叶形是羽衣甘蓝的重要观赏性状,与其他观赏作物及经济作物一样[3-5],羽衣甘蓝叶形常被用于区分品种。叶边缘的异同决定了羽衣甘蓝品种的多样性[6]。裂叶是羽衣甘蓝叶形的基本类型之一[1,7-9],前人[1,7-8]认为裂叶对圆叶的遗传表现为显性或不完全显性。我们在试验中发现,裂叶对圆叶的遗传还受到微效多基因控制,即表现为数量性状遗传特点。关于羽衣甘蓝这些裂叶相关性状的遗传特性,目前尚未见报道研究。对于数量性状的研究,主基因+多基因模型[10-11]是有效的分析工具[12-19]。
本试验针对羽衣甘蓝裂叶性状,以圆叶与裂叶高代自交系为亲本配制遗传分离群体,针对羽衣甘蓝叶长、叶宽、叶形指数、叶缘缺刻数4个裂叶相关性状,采用盖钧镒等[10-11]数量性状遗传研究方法,旨在分析羽衣甘蓝裂叶相关性状的遗传规律,为羽衣甘蓝裂叶性状遗传、QTL定位及新品种选育奠定基础。
1材料和方法
1.1材料
以羽衣甘蓝圆叶自交系‘0835’(图1,a、d)和裂叶自交系‘0819’(图1,c、f)为亲本进行正、反杂交和自交,构建236株F2遗传分离群体。试验于2012~2014年在沈阳农业大学教学科研基地进行。
1.2羽衣甘蓝4个裂叶相关性状采集
调查叶长、叶宽、叶形指数、叶缘缺刻数这4个主要裂叶相关性状。选取莲座期植株由外向内第6叶位心叶叶片进行测量。叶长为叶基至叶尖的长度(图1,c的L值),叶宽为叶片最宽部分的长度,叶形指数为叶长与叶宽的比值,叶缘缺刻数为叶缘缺刻的总数。重复3次,取平均值。
1.3遗传模型分析
1.3.1杂种优势分析及显著性检验杂种优势以中亲优势、中亲优势率及超亲优势表示。中亲值(mid-parents value,MPV)为双亲平均数,中亲优势(Hm)为F1、F2群体的平均数(Fi)与中亲值之差Hm=Fi-MPV。中亲优势率RHm=(Fi-MPV)/MPV×100%。超亲优势(over-parent hererosis,Hop)为F1与高值亲本(HP)之差Hop=F1-HP,超亲优势率RHop=(F1-HP)/HP×100%。变异系数CV=标准差(SD)/群体平均数(Fi)×100%。分析统计采用Excel及SPSS 19.0软件。
1.3.2混合遗传模型选择采用‘主基因+多基因’混合遗传模型[10],选用P1、P2、F1、F2四世代联合分析法[11]。首先用测得的表型数据求出1对主基因(A类)、2对主基因(B类)、多基因(C类)、1对主基因+多基因(D类)和2对主基因+多基因(E类)等5类24种遗传模型的极大似然函数值(max-likeli-hood-values,MLV),并计算出AIC(akaike’s information criterion)值。根据AIC准则,初步选定AIC值最小的3种模型作为候选模型。然后对候选模型进行适合性检验,包括均匀性检验(U12、U22、U32)、Smirnov检验(nW2)和Kolmogorov检验(Dn),选择4个世代20个统计量中达到显著水平个数最少的模型为最优模型,若统计值均不显著则选择AIC值最小模型为最适模型。遗传模型估算采用最小二乘法。

a.圆叶亲本单叶;b.F1单叶;c.裂叶亲本单叶;d.圆叶亲本‘0835’;e.F1;f.裂叶亲本‘0819’;g.部分F1群体
2结果与分析
2.1杂种优势与F2群体表型分布
正、反杂交F1表型全部为亲本中间型(图1,b、e、g),t检验结果表明,叶宽在双亲间表现为显著差异,其他3个性状均表现为极显著差异(表1)。4个性状中,仅叶缘缺刻数中亲优势达到了显著水平。叶长和叶形指数中亲优势率均为-5.62%,说明这一性状在F1下降较快。叶缘缺刻数中亲优势率最高,为36.88%。这有利于选育出叶缘缺刻数较多的杂交F1代。叶长、叶形指数与叶缘缺刻数的超亲优势均极显著负相关,叶宽超亲优势为显著负相关。
4个性状之间相关性均为极显著(表2),说明这4个性状能够很好地解释羽衣甘蓝裂叶性状。
F2中4个性状中亲优势均为负值(表3),说明这4种性状的杂种优势在F2代下降较快。4个性状在F2分离比较大,变异系数在16.87%~50.71%之间,这为进一步的遗传分析提供了较好的遗传差异基础。偏度、峰度(表3)及F2群体次数分布图(图2)均表明,4个性状均表现为由多个正态分布组成的混合正态分布,连续性较好,表明这4个与裂叶相关的性状均属于由多基因控制的数量性状。此外,F2群体中各性状均存在超出亲本的个体(图2),这为选育具有超亲性状的品种奠定了遗传基础。
2.2遗传模型分析
2.2.1候选遗传模型的确定通过比较AIC值,叶长性状的3个最小AIC值(1 218.18、1 212.67和1 216.86,表4)对应的候选模型为E-1、E-4和E-6,即为备选最适模型。同样,叶宽最适候选模型为E-3、E-4和E-6,叶形指数最适候选模型为B-0、E-0和E-1,叶缘缺刻数最适候选模型为E-0、E-1和E-3。
2.2.2候选模型的适合性测验由表5可知,叶长、叶宽入选的3个候选模型中,统计值均未达到显著水平,E-4模型的AIC值在2个性状中均最小,由此认为叶长和叶宽的遗传模型均为E-4模型,即羽衣甘蓝的叶长、叶宽均由2对等加性主基因+加性-显性多基因控制。对叶形指数的3个候选模型进行适合性检验,结果发现E-1模型的统计量均未达到显著水平,表明E-1模型能够充分解释羽衣甘蓝叶形指数的遗传。叶缘缺刻数的3个备选最适模型统计量达到显著水平的值都为3个,但E-1模型AIC值最小,表明E-1模型是羽衣甘蓝叶缘缺刻数的最适遗传模型。即叶形指数与叶缘缺刻数均符合由2对加性-显性-上位性主基因+加性-显性多基因的混合遗传模型。

表3 4个叶形相关性状F2表型特征值

表1 4个裂叶相关性状F1杂种优势
注:*和**分别表示0.05和0.01水平差异显著。下同。
Note:* and ** indicate significant differences at 0.05 and 0.01 levels,respectively.The same as below.

表2 4个性状间的相关性

图2 羽衣甘蓝F2 4个叶形相关数量性状的频次分布图

模型Model代号Code叶长LeaflengthMLVAIC叶宽LeafwidthMLVAIC叶形指数LeafindexMLVAIC叶缘缺刻数No.ofserratedleafmarginMLVAICA-11MG-AD-621.861255.71-507.981027.96-127.99267.98-1548.393108.78A-21MG-A-623.211256.42-510.711031.42-171.52353.04-1535.203080.40A-31MG-EAD-640.601291.21-513.231036.46-130.61271.22-1566.683143.36A-41MG-AEND-631.481272.97-507.981025.97-175.69361.38-1568.483146.96B-12MG-ADI-608.961239.92-497.451016.89-26.5775.15-1509.873041.74B-22MG-AD-610.661235.33-497.671009.34-102.92219.83-1520.393054.78B-32MG-A-614.191238.38-500.321010.63-167.51345.01-1535.103080.21B-42MG-EA-614.191236.38-511.991031.98-167.51343.01-1556.933121.86B-52MG-AED-671.051352.09-513.161036.31-178.44366.88-1559.533129.06B-62MG-EEAD-638.181284.37-513.361034.71-163.24334.49-1559.223126.43C-0PG-ADI-605.511223.03-498.711009.42-138.19288.38-1526.323064.63C-1PG-AD-606.471222.93-498.871007.75-149.05308.10-1548.203106.40D-0MX1-AD-ADI-605.511227.03-497.151010.30-53.76123.53-1511.173038.33D-1MX1-AD-AD-606.111226.22-497.181008.35-147.81309.62-1524.633063.26D-2MX1-A-AD-606.441224.89-498.871009.74-149.02310.05-1510.173032.34D-3MX1-EAD-AD-606.451224.90-498.881009.75-146.63305.27-1548.203108.39D-4MX1-AEND-AD-606.441224.88-497.181006.37-149.05310.09-1526.073064.14E-0MX2-ADI-ADI-600.181224.35-495.351014.71-27.5779.15-1494.463012.91E-1MX2-ADI-AD-600.091218.18-495.401008.81-32.4682.92-1494.973007.95E-2MX2-AD-AD-605.841221.69-496.871003.74-144.03298.05-1513.713037.42E-3MX2-A-AD-606.361218.72-498.621003.25-149.01304.02-1510.103026.19E-4MX2-EAED-AD-604.341212.67-498.841001.68-149.01302.02-1525.203054.39E-5MX2-AED-AD-606.831219.65-499.041004.08-137.91281.82-1527.893061.77E-6MX2-EEAD-AD-606.431216.86-498.881001.75-144.03292.05-1548.193100.39
注:MLV.极大似然函数值(下划线表示最小AIC值);MG.主基因遗传模型;MX.主基因-多基因混合遗传模型;PG.多基因遗传模型;A.加性效应;D.显性效应;I.互作(上位性);N.负向;E.相等。
Note:MLV.Max-likelihood-value (underlined mark show the smallest AIC values corresponded the best genetic models);MG.Major gene model;MX.Mixed major gene and polygene model;PG.Polygene model;A.Additive effect;D.Dominance effect;I.Interaction (epistasis);N.Negative;E.Equal.

表5 候选模型适合性检验
注:U12、U22、U32为均匀性检验;nW2为Smirnov检验;Dn为Kolmogorov检验;U12、U22、U32、nW2、Dn后括号中的数字为概率水平,小于0.05为显著。
Note:U12,U22,U32are the statistic of Uniformity test;nW2is the statistic of Smirnov test;Dnis the statistic of Kolmogorov text;The number in parentheses behindU12,U22,U32,nW2andDnmeans probability and indicates significant at level ofP<0.05.
2.2.3最适模型的遗传参数估计由表6可知,控制叶长的2对主基因加性效应值为2.60,多基因加性效应、显性效应和显性度分别为-0.39、-1.87和4.79,加性效应、显性效应均为负值说明起减效作用;显性度绝对值大于1,说明多基因中显性效应占重要地位。从二阶遗传参数的分析结果可知,主基因遗传率为83.80%,多基因遗传率为1.05%,主基因遗传率远大于多基因的遗传率,说明叶长主要受2对主基因作用。根据二阶遗传参数的分析结果,主基因+多基因决定了叶长表型变异的84.85%,有15.15%是由环境因素决定的,说明叶长性状主要受遗传因素影响。
控制叶宽的2对主基因加性效应值为0.83,多基因加性效应、显性效应和显性度分别为-1.01、-0.54和0.53,多基因加性效应、显性效应均为负值说明起减效作用;显性度绝对值小于1,说明多基因中加性效应占重要地位。主基因遗传率为22.28%,多基因遗传率为61.92%,主基因遗传率远小于多基因遗传率,说明叶宽主要受多基因作用。此外,主基因+多基因决定了叶长表型变异的84.20%,有15.80%是由环境因素决定的。
在叶形指数的遗传中,da>db,说明第1对主基因以加性效应为主。2对主基因的显性效应|ha|<|hb|,说明第2对主基因显性效应较大;二者的显性度均小于1,说明控制叶形指数的2对主基因均以加性效应为主。从主基因间的互作分析结果来看,2对主基因加性×加性(i)、加性×显性(jab)、显性×加性(jba)及显性×显性(l)效应的互作效应的绝对值均小于2对主基因的加性效应;显性×显性效应与第2对主基因的加性效应相近,说明这2种互作效应对选择的影响是非常弱的。从二阶遗传参数的分析结果可知,主基因的遗传率为93.73%,多基因的遗传率为2.59%,主基因的遗传率远大于多基因的遗传率,这说明叶形指数性状主要受2对主基因的作用。主基因与多基因决定了叶形指数表型变异的96.32%,相比之下,环境影响微乎其微(3.68%)。

表6 最适模型的遗传参数估计值
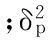

在控制叶缘缺刻数的2对主基因中,2对主基因的加性效应值分别为69.14和11.04,第1对主基因的加性效应远大于第2对主基因的加性效应,说明在控制叶缘缺刻数的遗传中,第1对主基因发挥重要作用。2对主基因的显性效应值分别为-58.62和-19.90,但|da|>|db|,说明第1对主基因的显性效应较大;显性度效应分析发现,|[ha]/[da]|<|[hb]/[db]|,说明控制叶缘缺刻数的2对主基因均以加性效应为主。从主基因间的互作分析结果来看,2对主基因加性×加性(i)、加性×显性(jab)、显性×加性(jba)及显性×显性(l)效应均介于2对主基因的加性效应值之间;加性×加性效应均与第2对基因的显性效应的绝对值相接近,说明这2种互作效应对选择的影响是比较小的。主基因遗传率为91.18%,多基因遗传率为0,并且主基因有上位性效应,说明叶缘缺刻数主要受2对主基因的作用。此外主基因+多基因决定了叶缘缺刻数表型变异的91.18%,有8.82%是由环境因素决定的。说明叶缘缺刻数的表现主要受遗传因素的影响,但环境因素也有一定的影响。
3讨论
叶片不仅是羽衣甘蓝重要的营养器官,也是主要的观赏部位。裂叶不仅叶形独特,而且叶片较直立,通风透光好,有利于减少病害的发生。对于羽衣甘蓝叶形遗传的研究,前人观点不完全一致,这可能与前人所采用的亲本纯度有关。顾卫红等[1]认为裂叶对圆叶为显性遗传,解莉楠[7]将裂叶和圆叶进行杂交,F1都为中间型但偏向母本。张丽娜等[8]通过品种间正、反交试验初步推断羽衣甘蓝叶形性状是由细胞核1对等位基因控制。本实验采用圆叶和裂叶高代自交系为亲本,F1均为双亲中间型,但叶缘缺刻深浅稍不一致。调查F2群体发现叶片大小和裂刻深浅并不与双亲或F1完全一致,而是呈现连续的变化趋势,因此我们推测有量性多基因参与裂叶性状的遗传。在本试验中,我们将裂叶性状分解为叶长、叶宽、叶形指数、叶缘缺刻数4个主要相关性状,进行了数量性状混合遗传分析,确立了遗传模型,这为全面解析羽衣甘蓝裂叶性状遗传提供了依据。
杂种优势和超亲现象在自然界中普遍存在。De Vicente等[20]对番茄的数量性状基因定位时发现,超亲现象的存在与双亲中有互补效应的QTL有直接关系。Ferreira等[21]认为超亲现象是由于基因的加性效应和非加性效应值的共同作用引起的。羽衣甘蓝为异花授粉作物,生产中以F1杂交种为主,叶缘缺刻数越多往往性状越优良,较高的中亲优势有利于提高杂交种的观赏性状。本试验发现4个裂叶相关性状杂种优势均比较明显,叶缘缺刻数中亲性较高,叶长、叶宽、叶形指数、叶缘缺刻数四个性状在杂交后代中普遍存在负向超亲分离现象,这为在杂交后代中选择优良叶形单株创造了有利条件,对扩大羽衣甘蓝优良遗传资源具有重要意义。
本研究采用主基因+多基因4世代联合分析方法,发现叶长和叶宽均符合E-4模型,由2对完全加性主基因+加性-显性多基因共同控制;叶形指数和叶缘缺刻数均符合E-1模型,由2对加性-显性-上位性主基因+加性-显性多基因控制。4个叶形相关性状的遗传都主要由遗传因素决定,叶长、叶形指数和叶缘缺刻数的主基因遗传率分别为83.80%、93.73%和91.18%,这些高遗传率主效基因的存在将有助于裂叶相关性状的分子标记辅助选择和QTL 定位。
参考文献:
[1]顾卫红,郑洪健,张燕,等.观赏型羽衣甘蓝新品系的选育及其主要遗传性[J].上海交通大学学报(农业科学版),2002,20(2):129-132.
GU W H,ZHENG H J,ZHANG Y,etal.A preliminary study on selection and breeding of new lines and main genetic characteristics of omamental kale[J].JournalofShanghaiJiaotongUniversity(Agricultural Science),2002,20(2):129-132.
[2]祝朋芳,刘丽,周广柱,等.羽衣甘蓝的离体培养研究[J].沈阳农业大学学报,2003,34(4):249-251.
ZHU P F,LIU L,ZHOU G Z,etal.A study on cultureinvitroofBrassicaoleraceavar.acephala[J].JournalofShenyangAgriculturalUniversity,2003,34(4):249-251.
[3]王江民,陈发棣,房伟民,等.基于叶形特征的切花菊品种鉴别[J].植物学报,2013,(6):608-615.
WANG J M,CHEN F D,FANG W M,etal.Identification of chrysanthemum cultivars based on leaf-shaped feature[J].ChineseBulletinofBotany,2013,48(6):608-615.
[4]祝朋芳.羽衣甘蓝育种与栽培技术[M].沈阳:辽宁科学技术出版社,2014.
[5]左力辉,张文林,邱彤,等.新疆野苹果叶形性状变异及其与SSR标记关联分析[J].园艺学报,2015,42(4):759-768.
ZUO L H,ZHANG W L,QIU T,etal.Malussieversiileaf traits variation and correlation analysis with SSR markers[J].ActaHorticulturaeSinica,2015,42(4):759-768.
[6]仪泽会.白菜SSR和InDel标记的开发及叶缘裂刻突变体的基因定位[D].陕西杨陵:西北农林科技大学,2012.
[7]解莉楠.羽衣甘蓝叶色、叶型遗传及自交不亲和性机理的研究[D].哈尔滨:东北林业大学,2003.
[8]张丽娜,沈向群.羽衣甘蓝叶形性状遗传规律初探[J].北方园艺,2007,(2):108-109.
ZHANG L N,SHEN X Q.Preliminary study on genetic regularity of kale leaf-shaped characters[J].NorthernHorticulture,2007,(2):108-109.
[9]祝朋芳,张健,房霞,等.25份羽衣甘蓝材料的亲缘关系与遗传多样性分析[J].西北农林科技大学学报·自然科学版,2012,40(5):123-128.
ZHU P F,ZHANG J,FANG X,etal.Analyses of genetic relationship and diversity of 25 accessions in kale[J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry(Nat.Sci.Edi.),2012,40(5):123-128.
[10]盖钧镒,章元明,王建康.植物数量性状遗传体系[M].北京:科学出版社,2003.
[11]曹锡文,刘兵,章元明.植物数量性状分离分析Windows软件包SEA的研制[J].南京农业大学学报,2013,36(6):1-6.
CAO X W,LIU B,ZHANG Y M.SEA:A software package of segregation analysis of quantitative traits in plants[J].JournalofNanjingAgriculturalUniversity,2013,36(6):1-6.
[12]张洁夫,戚存扣,浦惠明,等.甘蓝型油菜花瓣缺失性状的主基因+多基因遗传分析[J].中国油料作物学报,2007,29(3):227-232.
ZHANG J F,QI C K,PU H M,etal.Genetic analysis of apetalous inBrassicanapusL.using mixed model of major gene and polygene[J].ChineseJournalofOilCropSciences,2007,29(3):227-232.
[13]张书芬,傅廷栋,朱家成,等.甘蓝型油菜芥酸含量的基因分析[J].中国农业科学,2008,41(10):3 343-3 349.
ZHANG S F,FU T D,ZHU J C,etal.Genetic analysis of erucic acid inBrassicanapusL.using mixed major gene and polygene inheritance model[J].ScientiaAgriculturalSinica,2008,41(10):3 343-3 349.
[14]田露申,牛应泽,余青青,等.甘蓝型油菜白花性状的主基因+多基因遗传分析[J].中国农业科学,2009,42(11):3 987-3 995.
TIAN L S,NIU Y Z,YU Q Q,etal.Genetic analysis of white flower color with mixed model of major gene plus polygene inBrassicanapusL.[J].ScientiaAgriculturaSinica,2009,42(11):3 987-3 995.
[15]刘二艳,刘玉梅,方智远,等.青花菜花球'荚叶'性状主基因+多基因遗传分析[J].园艺学报,2009,36(11):1 611-1 618.
LIU E Y,LIU Y M,FANG Z Y,etal.Genetic analysis of head-leaf traits using mixed major gene plus polygene inheritance model inBrassicaoleraceaL.var.italicaPlanch.[J].ActaHorticulturaeSinica,2009,36(11):1 611-1 618.
[16]卓祖闯,万恩梅,张鲁刚,等.大白菜抽薹性状的主基因+多基因遗传分析[J].西北植物学报,2009,29(5):923-928.
ZHUO Z C,WAN E M,ZHANG L G,etal.Major gene plus poly-gene inheritance analysis of bolting trait in heading Chinese cabbage[J].ActaBot.Boreal.-Occident.Sin.,2009,29(5):923-928.
[17]王玉刚,李萌,吕晓雯,等.白菜叶裂数性状主基因+多基因遗传分析[J].西北植物学报,2012,32(2):252-256.
WANG Y G,LI M,LÜ X W,etal.Genetic analysis of leaf lobes inBrassicarapausing mixed major gene plus polygene model[J].ActaBot.Boreal.-Occident.Sin.,2012,32(2):252-256.
[18]唐海强,张飞,陈发棣,等.托桂型菊花花器性状杂种优势与混合遗传分析[J].园艺学报,2015,42(5):907-916.
TANG H Q,ZHANG F,CHEN F D,etal.Heterosis and mixed genetic analysis of inflorescence traits of anemone-typed chrysanthemum[J].ActaHorticulturaeSinica,2015,42(5):907-916.
[19]张允楠,曹齐卫,李利斌,等.黄瓜叶面积的主+多基因混合遗传模型分析[J].园艺学报,2015,42(5):897-906.
ZHANG Y N,CAO Q W,LI L B,etal.Genetic analysis of leaf size using mixed major-gene plus polygene inheritance model inCucumissativus[J].ActaHorticulturaeSinica,2015,42(5):897-906.
[20]DEVICENTE,TANKSLEY.QTL analysis of transgressive segregation in an interspecific tomato cross[J].Genetics,1993,134(2):585-596.
[21]FERREIRA,SATAGOPAN,YANDELL,etal.Mapping loci controlling vernalization requirement and flowering time inBrassicanapus[J].Theor.Appl.Genet.,1995,90(5):727-732.
(编辑:宋亚珍)
Genetic Analysis of Feathered-leaved Related Traits inBrassicaoleraceavar.acephala
ZHU Pengfang,FENG Xin,CHENG Mingming,PAN Zhichao
(College of Forestry,Shenyang Agricultural University,Shenyang 110161,China)
Abstract:We constructed an F2genetic segregation population crossed by parents between a flat-leaved inbred line ‘0835’ and a feathered-leaved inbred line ‘0819’in ornamental kale(Brassica oleracea var.acephala).Four feathered-leaved related traits,i.e.leaf length,leaf width,leaf index and number of serrated leaf margin,were investigated at rosette stage.The genetic segregation analysis was conducted by using four generations(P1,P2,F1and F2) mixed major gene plus polygene inheritance model.The results showed that:(1)there are prominent helerosis in the trait of number of serrated leaf margin.Meanwhile,these four characters showed negative transgressive heterosis.(2)Genetic analysis of quantitative traits indicated that leaf length and leaf width were both compatible with E-4 model characterized by two equal additive major gene plus additive-dominant polygene.The heritabilities of major gene and polygene were 83.80% and 1.05%,respectively,in leaf length.The heritabilities of major gene and polygene were 22.28% and 61.92%,respectively,in leaf width.(3)Leaf index and number of serrated leaf margin both meet E-1 model showing two additive-dominant-epistatic major gene plus additive-dominant polygene.The heritabilities of major gene and polygene were 93.73% and 2.59%,respectively,in leaf index.The major gene heritability was 91.18% in number of serrated leaf margin trait.
Key words:Brassica oleracea var.acephala;feathered-leaved;genetic model;major gene;polygene
中图分类号:Q348
文献标志码:A
作者简介:祝朋芳(1971-),女,博士,教授,博士生导师,主要从事观赏植物遗传育种研究。E-mail:pfzhu2013@126.com
基金项目:国家自然科学基金(31101566)
收稿日期:2015-12-02;修改稿收到日期:2016-01-13
文章编号:1000-4025(2016)02-0288-08
doi:10.7606/j.issn.1000-4025.2016.02.0288

