黑暗条件下连续性干出对全缘马尾藻幼孢子体生长和生化成分的影响
欧泽奎,刘东超,麦铭雄,何宇轩,杨 鹏(广东海洋大学 水产学院,广东 湛江 524025)
黑暗条件下连续性干出对全缘马尾藻幼孢子体生长和生化成分的影响
欧泽奎,刘东超,麦铭雄,何宇轩,杨鹏
(广东海洋大学 水产学院,广东 湛江 524025)
摘要:在黑暗条件下对全缘马尾藻(Sargassum integerrimum)幼孢子分别进行0.5、1、2、4 h干出处理,研究干出处理对幼孢子体生长、幼孢子体体内叶绿素a、叶绿素c、类胡萝卜素、脯氨酸以及可溶性糖含量的影响。结果表明:相比于未进行干出处理的对照组,0.5 h、1 h组的短暂干出可促进幼孢子体生长(P<0.05),幼孢子体体内两种叶绿素、类胡萝卜素、脯氨酸以及可溶性糖含量差异均无统计学意义(P>0.05);2 h、4 h组的长时间干出可抑制幼孢子体生长(P<0.05),幼孢子体体内两种叶绿素含量均降低(P<0.05),类胡萝卜素、脯氨酸以及可溶性糖的含量升高(P<0.05)并保持较高水平。在人工育苗过程中每天在黑暗条件下对幼孢子体进行短时间(0.5~1 h)干出处理,可促进幼孢子体生长,并适当提高其抗逆性以及对干旱的适应性。
关键词:全缘马尾藻;幼孢子体;干出;生长;生化成分
全缘马尾藻(Sargassum integerrimum)是一种中国特有的大型褐藻,隶属褐藻门,墨角藻目,马尾藻科。藻体雌雄异株,自然生长于低潮带石沼中,主要产于广东省沿海[1]。全缘马尾藻不仅富含人体需要的不饱和脂肪酸[2],还含有多糖类和褐藻多酚类等生物活性物质,具有较高的营养价值,以及保护神经、抗氧化和抗肿瘤等药用价值[3-5],极具开发价值。由于天然全缘马尾藻资源有限,人工栽培将是获取全缘马尾藻的主要途径。充足的苗种供应是开展人工栽培的前提条件。目前,关于全缘马尾藻人工育苗的研究已有水流速率和温度等环境因子对其幼孢子体影响的报道[6-7],研究表明[6-7],提高幼孢子体生长速率及减少病害是亟需突破的关键问题。
随着潮汐的节律性变化,栖息在潮间带的底栖海藻经历浸没于海水和暴露于空气(干出状态)的交替环境[8-10]。干出会对藻体生长以及抗氧化能力、光合作用强度等生理生化特性产生影响[11-12]。连续性短时间(0.5 h)干出可促进孔石莼(Ulva pertusa)生长[13],但长时间(4~7 h)干出致使过度失水,盐度过低,从而引起藻体死亡[14];坛紫菜(Pyropia haitanensis)叶状体经历(0.5~3 h)干出产量提高,可有效杀死与其有竞争关系的杂藻,增强其自身抗逆能力,减少病害[15]。可见适当干出有利于海藻的生长。此外,海藻在经历干出时,可引起藻体内抗氧化物质、氨基酸和可溶性海藻糖升高,使藻体累积细胞相容性物质作为渗透调解物,从而提高藻体对干出的适应能力,提高海藻产量和品质[13,16,18]。
目前,关于干出对大型海藻生长和生理生化的影响研究主要集中在海藻成藻,对海藻幼孢子体较少涉及[13,18]。干出对海藻幼孢子体上的复生(Diatom)、藻沟虾(Ampithoe)、柄海鞘(Styeta clava)等敌害生物有一定抑制作用[19],但在阳光照射下经历干出,紫外线会对幼孢子体造成一定伤害[20],且幼孢子体抗逆性低于成藻,光照条件下干出可能对其成活率影响较大;此外,潮间带的海藻幼孢子体对干出的耐受性存在明显的种间差异[18,21]。因此,研究海藻幼孢子体干出过程中需严格控制干出时间,并避免阳光直接照射。本研究在黑暗条件下对全缘马尾藻幼孢子进行连续性干出处理,分析幼孢子体的生长和生化成分变化,探讨适宜的黑暗干出条件,为全缘马尾藻工厂化育苗提供理论基础。
1 材料与方法
1.1全缘马尾藻幼孢子体的采集
从湛江市徐闻县四塘村的近岸海域(110°08′E,20°14′ N)采集已有生殖托雏形的全缘马尾藻成体,用湿毛巾包裹放入冰盒保温,及时运回广东海洋大学海藻培养室。用消毒海水清洗后,在(29±0.5)℃、照度7 500±100 lx、光照周期18 h ︰6 h、盐度29.0±0.5的条件下充气暂养。消毒海水中暂养13 d后雌、雄藻体生殖托完全成熟。对生殖托进行促排,促排条件为:温度(30±0.5)℃,照度0 lx,盐度31.0±0.5,水流速度(45±2)cm/s。促排后用孔径48 μm纱绢网收集脱落的受精卵,置于光照培养箱中,用PESI培养液,于(25.0 ±0.5)℃、光照强度(2 500±100)lx、光照周期10 h︰14 h条件下充气培养。培养液盐度为29.0 ±0.5,pH 8.0±0.2,每3 d更换培养液1次,并用软毛刷清洗幼孢子体表面杂质及附着生物。当受精卵发育至长度为2 cm的幼孢子体时,选取长度接近的幼孢子体进行干出实验。
1.2研究方法
在已有研究[14]基础上,设置4个实验组。实验组干出时间分别为30 min,1、2、4 h,对照组的干出时间为0 h,每组设置3个重复组。每组取幼孢子体50株,用天平准确称质量后放入含3 L PESI培养液的长方体PVC塑料盒,置光照培养箱,模拟幼孢子体的自然干出过程,每天按图1方式对幼孢子体进行干出。干出时用消毒胶管吸出海水,干出后将海水缓慢吸回。干出条件为:温度(25.0 ±0.5)℃,照度 0 lx。每3 d更换1次培养液。以光照过程作为实验起点及终点,实验时间12 d。在实验起点及终点进行取样,每3 d称量每组幼孢子体的湿体质量,计算特定生长率(SGR),并参照Jeffrey等[22]的方法测定幼孢子体叶绿素a、叶绿素c、类胡萝卜素含量,用酸性茚三酮法[23]测定脯氨酸含量,用蒽酮比色法[24]测定可溶性糖含量。实验中涉及的光密度测定均用UV-2450型紫外可见分光光度计。
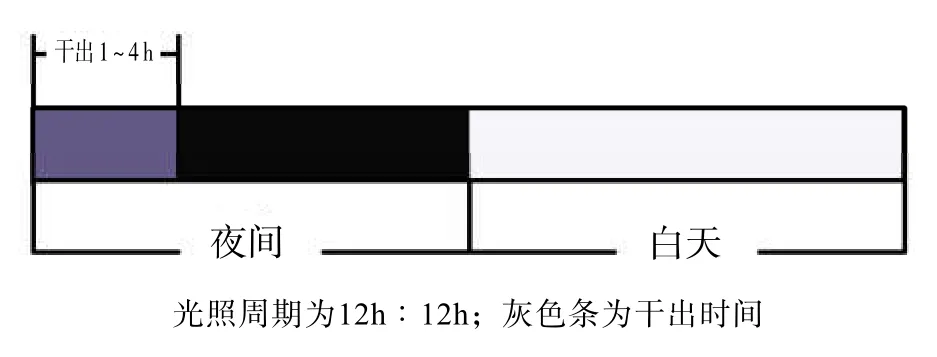
图1 连续性黑暗干出示意图Fig.1 Diagram of the continuously dark desiccation
1.3数据统计与分析方法
特定生长率SGR(%·d-1):
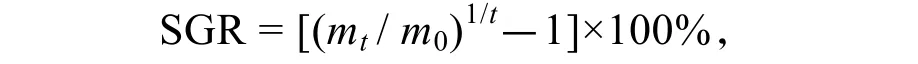
式中,m0为初始质量(g);mt为终末质量(g);t为实验周期(d)[13]。
按以下公式计算叶绿素a(Chl-a)、叶绿素c(Chl-c)和类胡萝卜素(Car)的质量分数:
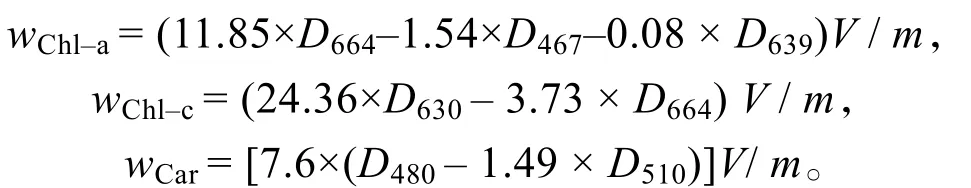
式中,wX为物质X的质量分数(mg·g-1),Dx为色素溶液在 x nm处的光密度,V为色素溶液总体积(L),m为藻体质量(g)[22]。
脯氨酸含量(P)、可溶性糖含量(C):
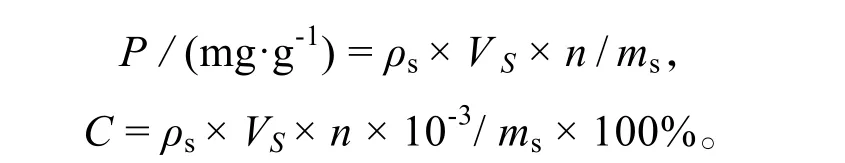
式中:ρs为用光密度测量值计算的样品质量浓度(μg·mL-1),VS为溶液体积(mL),n为样品溶液稀释倍数,ms为藻体质量(mg)[24]。
实验数据采用SPSS18.0进行处理及分析,结果以平均值±标准差表示,并作方差分析和Tukey多重比较,P < 0.05时差异有统计学意义,并用Origin8.0作图。
2 结果与分析
2.1黑暗条件下连续性干出期间幼孢子体的生长速率
由图2可知,在黑暗条件下干出0.5 h组特定生长率在12 d内均最高,且与其他组差异有统计学意义(P<0.05)。干出1 h组特定生长率前6 d与对照组差异无统计学意义(P>0.05),但6~12 d期间高于对照组,差异有统计学意义(P<0.05)。干出2 h组和4 h组的特定生长率在12d内均低于对照组,差异有统计学意义(P<0.05)。干出4 h组特定生长率在前6d内与2 h组差异无统计学意义(P>0.05),但在6~12d期间低于2 h组,差异有统计学意义(P<0.05)。
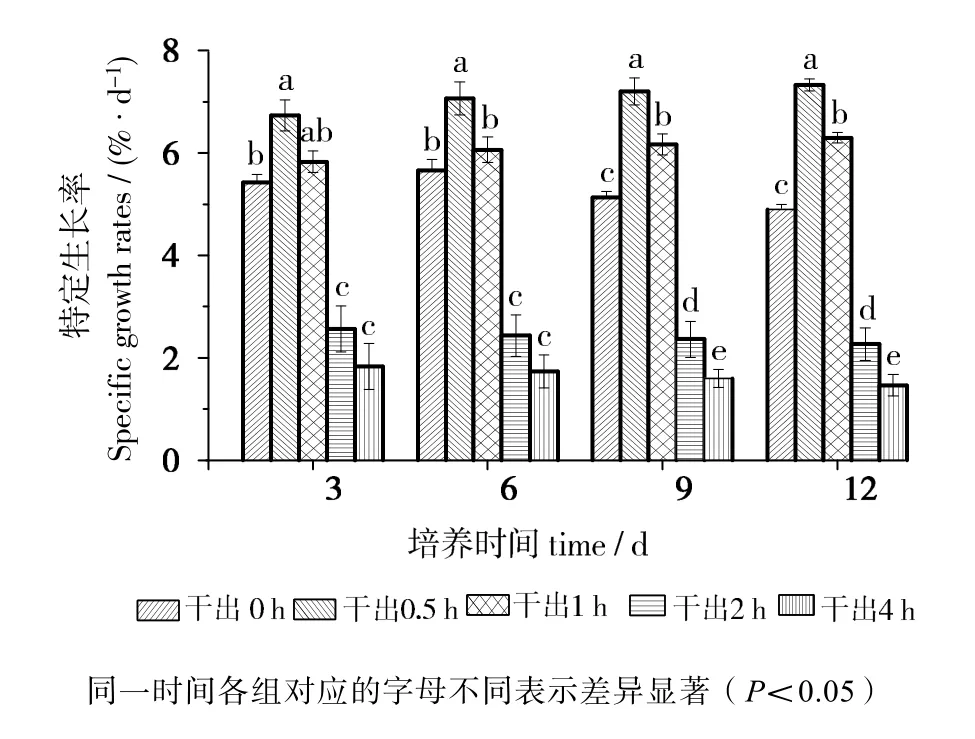
图2 连续性干出期间幼孢子体的特定生长率Fig.2 Specific growth rate of germlings during different periods of continuously dark desiccation
2.2黑暗条件下连续性干出期间幼孢子体的叶绿素a、叶绿素c含量
由图3、4可知,叶绿素a含量与叶绿素c含量的变化趋势相同。在黑暗条件下干出0.5 h组的叶绿素含量均与对照组差异无统计学意义(P>0.05)。干出1 h、2 h、4 h组的叶绿素含量在12 d内均低于对照组,差异有统计学意义(P<0.05)。干出1 h组叶绿素含量在12天内与0.5 h组差异无统计学意义(P>0.05)。干出1 h、2 h、4 h组的叶绿素含量在各时间段内均依次降低,差异有统计学意义(P<0.05)。
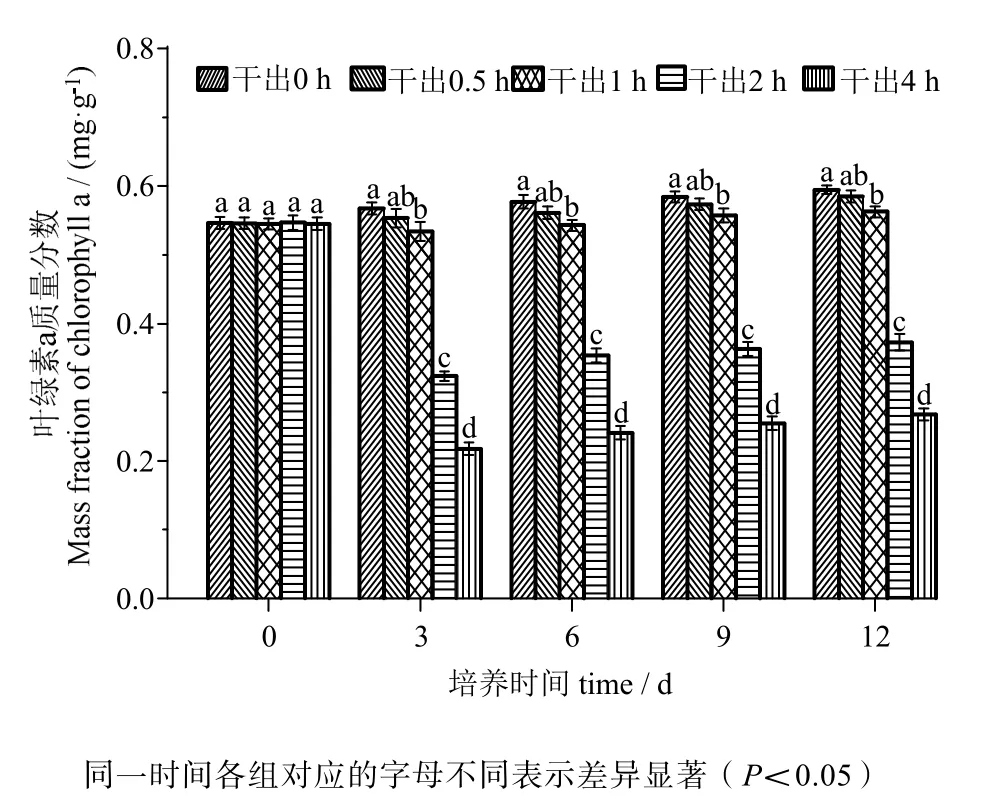
图3 连续性干出处理期间幼孢子体的叶绿素a含量Fig.3 Chlorophyll a mass fraction of germlings during different periods of continuously dark desiccation
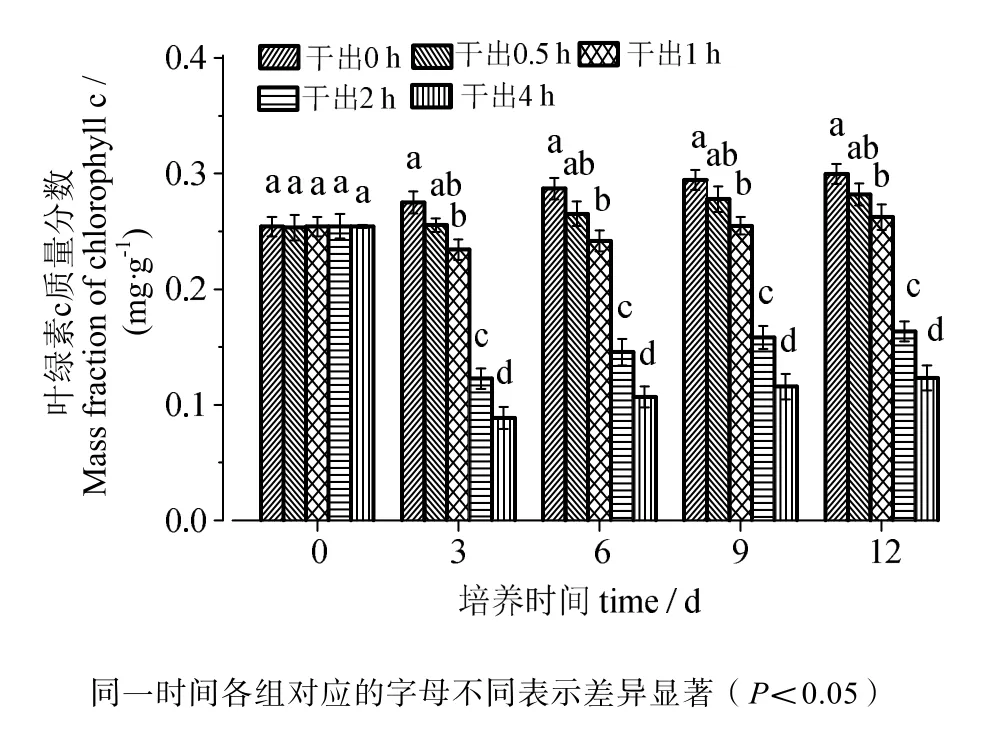
图4 连续性干出处理期间的叶绿素c含量Fig.4 Chlorophyll c content of germlings during different periods of continuously dark desiccation
2.3黑暗条件下连续性干出期间幼孢子体的类胡萝卜素含量
由图5可知,在黑暗条件下干出0.5 h组的类胡萝卜素含量在12 d内均与对照组差异无统计学意义(P>0.05)。干出1 h组的类胡萝卜素含量在12 d内与干出0.5 h组差异无统计学意义(P>0.05)。干出2 h、4 h组的类胡萝卜素含量在12 d内均高于对照组,差异有统计学意义(P<0.05)。干出4 h组的类胡萝卜素含量在12 d内均高于干出2 h组,差异有统计学意义(P<0.05)。
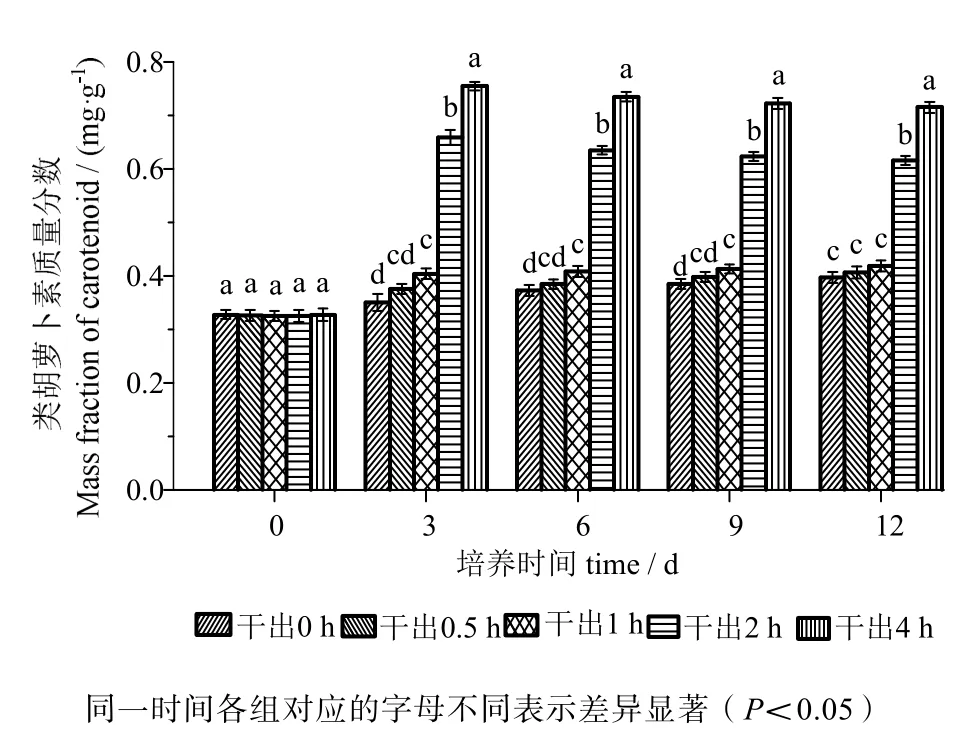
图5 连续性干出处理期间幼孢子体的类胡萝卜素含量Fig.5 Carotenoid content of germlings during different periods of continuously dark desiccation
2.4黑暗条件下连续性干出期间幼孢子体的脯氨酸及可溶性糖含量
由图6可知,在黑暗条件下干出0.5 h组的脯氨酸含量在12d内与对照组差异无统计学意义(P>0.05)。干出1 h组的脯氨酸含量在12d内与干出0.5 h组在前9 d内差异无统计学意义(P>0.05),9~ 12 d内差异有统计学意义(P<0.05)。干出2 h组和4 h组的脯氨酸含量在12 d内均明显高于对照组,差异有统计学意义(P<0.05)。干出4 h组的脯氨酸含量在12 d内均高于2 h组,二者差异有统计学意义(P<0.05)。
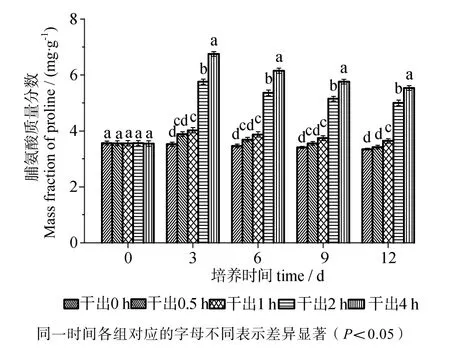
图6 连续性干出处理期间幼孢子体的脯氨酸含量Fig.6 Proline content of germlings during different periods of continuously dark desiccation
由图7可知,在黑暗条件下干出0.5 h组的可溶性糖含量在12 d内与对照组差异无统计学意义(P >0.05)。干出1h组可溶性糖含量在12 d内与0.5 h组差异均无统计学意义(P>0.05)。干出1h、2 h、4 h组的可溶性糖含量在各时间段均依次升高,差异有统计学意义(P<0.05),干出1 h组在3 d时高于对照组,差异有统计学意义(P<0.05),之后与对照组差异无统计学意义(P>0.05),干出2 h、4 h组在12 d内均高于对照组组,差异有统计学意义(P<0.05)。
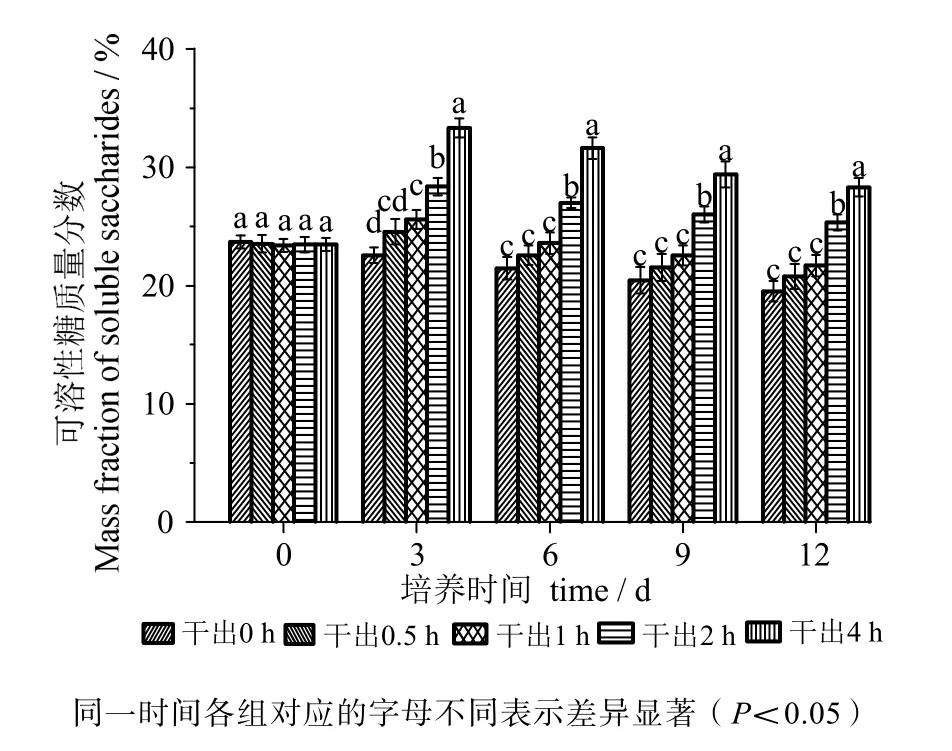
图7 连续性干出处理后幼孢子体的可溶性糖含量Fig.7 Soluble saccharides content of germlings during different periods of continuously dark desiccation
3 讨 论
3.1黑暗条件下连续性干出对全缘马尾藻幼孢子体生长的影响
干出对潮间带海藻的海藻形态、抗氧化能力、光合性能以及呼吸强度影响较大,其必然影响海藻对有机物的积累从而影响海藻生长速率[25-26]。张芬来等[16]研究发现,在白天对紫菜叶状体进行3~4 h干出处理,叶状体对有机物同化积累减少,生长受抑制。郭赣林等[13]在白天条件下对孔石莼进行连续性干出,发现0.5 h短暂干出可促进海藻的生长,而随干出时间的延长干出处理会抑制藻体生长。本研究表明,相比于未作干出处理的对照组,黑暗条件下连续性短暂干出(0.5~1 h)可促进全缘马尾藻幼孢子体生长。其原因可能是,短暂干出导致幼孢子体轻微失水,进而影响幼孢子体各组织的生理活动,如夜晚呼吸作用减慢,有机物消耗减少,有利于幼孢子体生长[16];同时干出环境中CO2含量比海水环境中高,幼孢子体在干出时的光合作用暗反应较在海水中时有所加强,幼孢子体中有机物的积累增多,从而生长较快[10]。长时间干出(2~4 h)则使幼孢子体生长明显减缓。其原因可能是,幼孢子体的耐受力较低,随着机体失水增多,幼孢子体中与光合作用相关的细胞受损严重,从而影响其光合作用,导致幼孢子体生长变慢[27]。综上可见,黑暗条件下短时间干出可促进全缘马尾藻幼孢子体的生长。
3.2黑暗条件下连续性干出对全缘马尾藻幼孢子体体内叶绿素的影响
叶绿素是大型海藻光合作用中最重要的色素,其含量能反映藻体的有机物同化能力[28]。潮间带海藻经过干出或干燥处理后其叶绿素光合活性普遍下降,而将其重新浸入海水中后,其叶绿素光合活性一般可在2 h左右恢复至正常水平[29]。杨帆等[17]在黑暗条件干出孔石莼0~6 h,叶绿素含量随干出时间增加而显著下降,但将干出6 h的孔石莼复水3 h后叶绿素含量仅可恢复至一半以上。此外,Priya等[30]对脐形紫菜(Pyropia umbilicalis Kützing)进行阴干处理和光曝处理,发现过度曝晒是藻体光合作用减弱的主要原因,而干旱胁迫对其光合作用的影响较小,表明黑暗条件下干出对藻体光合作用的影响相对较小。本研究在黑暗条件下对全缘马尾藻幼孢子体进行0.5~1 h干出处理后,幼孢子体中的叶绿素a、叶绿素c含量与未经干出处理组无明显差异;2~4 h干出处理后,幼孢子体中的叶绿素a、叶绿素c含量相比于未经干出处理组显著降低。其原因可能是,幼孢子体在黑暗条件下,光合作用无光反应过程,其体内叶绿素含量相对较低;短暂干出会减少幼孢子体中的叶绿素含量,但减少的叶绿素含量会在随后的复水环境中恢复,因此,在白天开始前取样的幼孢子体的叶绿素含量几近相同。但是长时间干出会导致藻体严重脱水,进而破坏叶绿素结构,严重脱水也会损伤部分产叶绿素细胞的结构,导致光合作用紊乱,造成叶绿素含量急剧下降,且在短时间内难以修复[31]。因此,黑暗条件下短时间干出对全缘马尾藻幼孢子体的叶绿素含量影响不显著,可能对白天的光合作用影响较小。而长时间干出会导致幼孢子体的叶绿素含量显著下降,从而可能会减弱幼孢子体在白天的光合作用强度。
3.3黑暗条件下连续性干出对全缘马尾藻幼孢子体体内类胡萝卜素含量的影响
当大型海藻受到干旱胁迫时,机体内抗氧化物质代谢明显增强,如谷胱甘肽还原酶、过氧化氢酶、类胡萝卜素含量急剧上升,在很大程度上减少了活性氧对机体产生的损伤[12,30]。褐藻中的褐藻黄素、β胡萝卜素、三色堇黄素、炔类色素等类胡萝卜素含量较高,其中褐藻黄素含量最多[32]。类胡萝卜素除可有效提高光合作用效率外,还有较强的抗氧化作用[33-34]。本研究表明,在黑暗条件下对全缘马尾藻幼孢子体进行0.5~1 h干出处理后,幼孢子体类胡萝卜素含量与未经干出处理组无显著差异。其原因可能为,在短暂干出后,为减少干旱胁迫造成的氧化效应,幼孢子体产生的类胡萝卜素明显增加,胁迫消除后,类胡萝卜素含量恢复至正常水平。而进行2~4 h干出处理后,幼孢子体中的类胡萝卜素含量相比于未经干出处理组显著升高并保持高含量,说明机体在严重受损后抗氧化性显著增强。其原因可能是,严重失水使幼孢子体各组织的部分细胞受损,从而造成机体持续性氧化损伤,机体为适应失水胁迫进行自身调节,类胡萝卜素的含量显著升高并持续保持高含量以增强机体的抗氧化性。由此可推测,类胡萝卜素在幼孢子体抵抗干旱胁迫中发挥着重要作用。长时间(2~4 h)干出导致类胡萝卜素含量明显升高也从侧面反映了幼孢子体的抗逆性较弱。
3.4黑暗条件下连续性干出对全缘马尾藻幼孢子体体内脯氨酸和可溶性糖的影响
当植物受到干旱胁迫时,机体会产生渗透调节物质用以缓解失水造成的细胞内渗透压过高[35-36]。脯氨酸和可溶性糖均为常见的植物细胞渗透调节物质[31]。钱飞箭[37]研究发现,干出胁迫坛紫菜会使藻体内红藻糖苷迅速积累,且积累的红藻糖苷有助于缓解干旱胁迫。赵素达等[38]研究表明,潮间带海藻体内脯氨酸和可溶性糖含量升高可有效缓解藻体因细胞失水造成的细胞内渗透压过高,以适应潮间带由潮汐变化引起的剧烈环境变化。本研究表明,在黑暗条件下对全缘马尾藻幼孢子体进行0.5~1 h干出处理后,幼孢子体体内脯氨酸及可溶性糖含量与未经干出处理组无显著差异,这与杨帆等[17]的研究结果相符。其原因可能是,短暂干出期间,幼孢子体会产生应激反应,孢子体内脯氨酸和可溶性糖在短时间内急剧升高,复水处理后干旱胁迫逐渐消除,脯氨酸和可溶性糖含量逐渐恢复至对照组水平。而对幼孢子体进行2~4 h干出处理后,脯氨酸及可溶性糖的含量相比于未经干出处理组明显升高并保持高含量。其原因可能是,在长时间干出过程中,幼孢子体内脯氨酸和可溶性糖在短时间内急剧升高,随着干出的持续进行,幼孢子体通过调节脯氨酸及可溶性糖的合成与代谢途径,提升体内脯氨酸以及可溶性糖含量以抵抗持续的干旱胁迫,而当对幼孢子体进行复水处理后,其脯氨酸及可溶性糖含量并不随胁迫逐渐解除而下降,而是维持在较高水平。因此,推测全缘马尾藻幼孢子体可通过体内渗透调节物质有效缓解短时间的干旱胁迫,长时间干旱胁迫可能会使幼孢子体通过提高体内渗透调节物质而提高自身抗逆性。
3.5连续性干出在人工育苗中的运用
本研究表明,与未经干出的对照组相比,在黑暗条件下,短暂干出(0.5~1 h)显著促进全缘马尾藻幼孢子体生长(P<0.05),幼孢子体体内两种叶绿素含量均变化不明显(P>0.05),可能对白天的光合作用影响较小;类胡萝卜素含量变化不大(P>0.05),可见短暂干出对藻体的抗氧化物质含量基本无影响,而且由于藻体定期经历氧化损伤及抗氧化过程,藻体会通过自身调节形成更完善的抗氧化机制,可推测短时间干出可适当提高藻体的抗逆性;脯氨酸以及可溶性糖含量无显著变化(P>0.05),可见短暂干出对藻体的渗透调节物质含量基本无影响,而且由于藻体定期经历失水及复水过程,藻体会通过自身调节形成更完善的渗透调节机制,可推测短时间干出可适当提高藻体对未知干旱胁迫的适应性。研究提示,在全缘马尾藻人工育苗过程中,每天可在黑暗条件下对幼孢子体进行短时间(0.5~1 h)干出处理,不仅可促进幼孢子体的生长,而且可适当提高其抗逆性以及对干旱的适应性。
在自然条件下,受潮汐变化的影响,全缘马尾藻孢子体干出过程既可能发生在黑暗的夜晚也可能发生在有日照的白天。因此,在随后的研究中需探索白天光照条件下连续性干出处理对幼孢子体生长和生化成分的影响,以完善连续性干出对幼孢子体生长和生化成分影响的理论依据。此外,在人工育苗中改变幼孢子体生长所需的其他环境因子也会影响干出对幼孢子体生长的促进效果,至于干出状态下其他环境因子需进一步研究。
参考文献
[1]曾呈奎,陆保仁.中国海藻志·褐藻门·墨角藻目[M].北京:科学出版社,2000:170-171.
[2]卢虹玉,杨小青,谢恩义,等.全缘马尾藻的主要营养成分分析与评价[J].食品研究与开发,2013,34(7):120-122.
[3]JIN W H,ZHANG W J,WANG J,et al.A study of neuroprotective and antioxidant activities of heteropolysaccharides from six Sargassum species[J].Int J Bio Macromol,2014,67:336-342.
[4]卢虹玉,刘义,吉宏武,等.全缘马尾藻褐藻多酚的抗氧化和抗肿瘤细胞增殖作用研究[J].现代食品科技,2013,29(4):702-705.
[5]肖为,陶叶杏,谷毅鹏,等.全缘马尾藻提取物对酵母膏诱导小鼠高尿酸血症的拮抗效应[J].食品工业科技,2015,36(17):339-342.
[6]黄苑媚,刘志刚,谢恩义,等.水流速率对全缘马尾藻幼孢子体生长和生理活性的影响[J].广东海洋大学学报,2014,34(6):45-50.
[7]孙宗红,麦惠欣,刘志刚,等.温度对全缘马尾藻幼孢子体生长和生理组分的影响[J].广东海洋大学学报,2015,35(1):51-56.
[8]吴倩倩,佟少明,侯和胜.干出胁迫对孔石莼生长及生理影响[J].海洋渔业,2011,33(4):472-475.
[9]郭赣林,董双林.干出对潮间带不同垂直位置海藻的生长及光合作用速率的影响[J].海洋湖沼通报,2008(4):78-84.
[10]邹定辉,高坤山.低潮干出状态下石莼的光合作用特性(简报)[J].植物生理学通讯,2001,37(6):503-506.
[11]KUMAR M,GUPTA V,TRIVEDI N,et al.Desiccation induced oxidative stress and its biochemical responses in intertidal red alga Gracilaria corticata(Gracilariales,Rhodophyta)[J].Environ Exp Bot,2011,72(2):194-201.
[12]VAN HEES D H,VAN ALSTYNE K L.Effects of emersion,temperature,dopamine,and hypoxia on the accumulation of extracellular oxidants surrounding the bloom-forming seaweeds Ulva lactuca and Ulvaria obscura[J].J Exp Mar Bio Ecol,2013,448:207-213.
[13]郭赣林,阎斌伦,徐静,等.连续性干出对孔石莼生长和生化组成的影响[J].生态学杂志,2011,30(12):2767-2769.
[14]YAMOCHI S.Effects of desiccation and salinity on the outbreak of a green tide of Ulva pertusa in a created salt marsh along the coast of Osaka Bay,Japan[J].Estuar Coast Shelf S,2013,116:21-28.
[15]陈昌生,翁琳,汪磊,等.干露和冷藏对坛紫菜及杂藻存活与生长的影响[J].海洋学报(中文版),2007,29(2):131-136.
[16]张芬来.干露影响坛紫菜叶状体生理活性和生长的试验[J].浙江水产学院学报,1993,12(3):204-211.
[17]杨帆,李世国,佟少明,等.黑暗条件下干露对孔石莼生理生化指标的影响[J].延边大学学报(自然科学版),2012,38(1):54-58.
[18]CONTRERAS-PORCIA L,CALLEJAS S,THOMAS D,et al.Seaweeds early development:detrimental effects of desiccation and attenuation by algal extracts[J].Planta,2012,235(2):337-348.
[19]贾柽,杨彬,谢恩义.硇洲马尾藻人工育苗常见敌害生物及防治初探[J].水产养殖,2012,33(7):35-39.
[20]ALTAMIRANO M,FLORES-MOYA A,FIGUEROA F L.Effects of UV radiation and temperature on growth of germlings of three species of Fucus(Phaeophyceae)[J].Aquat Bot,2003,75(1):9-20.
[21]CHU S H,ZHANG Q S,LIU S K,et al.Tolerance of Sargassum thunbergii germlings to thermal,osmotic and desiccation stress[J].Aquat Bot,2012,96(1):1-6.
[22]JEFFREY S W,Humphrey G F.New spectrophotometric equations for deteming Chlorophylls a,b,c1 and c2 in higher plants algae and natural phytoplankton[J].Biochem Physiol Pflanzen,1975,167:191-199.
[23]朱广廉,邓兴旺,左卫能.植物体内游离脯氨酸的测定[J].植物生理学通讯,1983(1):35-37.
[24]丁雪梅,张晓君,赵云,等.蒽酮比色法测定可溶性糖含量的试验方法改进[J].黑龙江畜牧兽医,2014(12):230-233.
[25]FLORES-MOLINA M R,THOMAS D,LOVAZZANO C,et al.Desiccation stress in intertidal seaweeds:Effects on morphology,antioxidant responses and photosynthe- tic performance[J].Aquat Bot,2014,113:90-99.
[26]SCHAGERL M,MÖSTL M.Drought stress,rain and recovery of the intertidal seaweed Fucus spiralis[J].Mar Biol,2011,158(11):2471-2479.
[27]LAMOTE M,JOHNSON L E,LEMOINE Y.Photosynthetic responses of an intertidal alga to emersion:The interplay of intertidal height and meteorological conditions[J].J Exp Mar Bio Ecol,2012,428:16-23.
[28]邹定辉,阮祚禧,陈伟洲.干出状态下羊栖菜的光合作用特性[J].海洋通报,2004,23(5):33-39.
[29]邹定辉,高坤山.低潮干出状态下潮间带海藻的某些光合生理特性[J].植物生理学通讯,2003,39(5):525-530.
[30]SAMPATH-WILEY P,NEEFUS C D,JAHNKE L S.Seasonal effects of sun exposure and emersion on intertidal seaweed physiology:Fluctuations in antioxidant contents,photosynthetic pigments and photosynthetic efficiency in the red alga Porphyra umbilicalis Kützing(Rhodophyta,Bangiales)[J].J Exp Mar Bio Ecol,2008,361(2):83-91.
[31]FLORES-MOLINA M R,THOMAS D,LOVAZZANO C,et al.Desiccation stress in intertidal seaweeds:Effects on morphology,antioxidant responses and photosynthetic performance[J].Aquat Bot,2014,113:90-99.
[32]何培民,秦松,严小军,等.海藻生物技术及其应用[M].北京:化学工业出版社,2007:221.
[33]TAKASHIMA M,SHICHIRI M,HAGIHARA Y,et al.Capacity of fucoxanthin for scavenging peroxyl radicals and inhibition of lipid peroxidation in model systems[J].Free Radic Res,2012,46(11):1406-1412.
[34]FUNG A,HAMID N,LU J.Fucoxanthin content and antioxidant properties of Undaria pinnatifida[J].Food Chem,2013,136(2):1055-1062.
[35]赵雅静,翁伯琦,王义祥,等.植物对干旱胁迫的生理生态响应及其研究进展[J].福建稻麦科技,2009,27(2):45-50.
[36]LIU H,ZHANG Y,YIN H,et al.Alginate oligosaccharides enhanced Triticum aestivum L.tolerance to drought stress[J].Plant Physiol Bioch,2013,62:33-40.
[37]钱飞箭.坛紫菜受高温和干出胁迫的机理及脂代谢关键基因的研究[D].宁波:宁波大学,2014.
[38]赵素达,董树刚,吴以平,等.盐胁迫对孔石莼的生理生化影响[J].海洋科学,2000,24(7):52-55.
(责任编辑:刘庆颖)
Effects of Continuous Desiccation in Darkness on Growth and Biochemical Constituents of Germlings of Sargassum integerrimum
OU Ze-kui,LIU Dong-chao,MAI Ming-xiong,HE Yu-xuan,YANG Peng
(Fisheries College,Guangdong Ocean University,Zhanjiang 524025,China)
Abstract:The effect of different time(0.5 h,1 h,2 h,4 h)desiccation in darkness on changes of germling growth and content of chlorophyll a,chlorophyll c,carotenoid,proline and soluble saccharides in germlings of Sargassum integerrimum were investigated.Compared with control group without desiccation,results show that the germlings growth of 0.5 hdesiccation group and1.0 h desiccation group were accelerated(P<0.05)and the content of two kinds of chlorophyll,carotenoid,proline and soluble saccharides in germlings of each group had no significant change(P >0.05).Meanwhile,results show that the germlings growth of 2 h desiccation group and 4 h desiccation group were inhibited(P<0.05),two kinds of chlorophyll content in germlings of each group decreased significantly(P<0.05),the content of carotenoid,proline and soluble saccharides in germlings of each group increased significant(P<0.05)and it remained at high level.Study suggests that 0.5 to 1 h of continuous desiccation in darkness on the germlings of S.integerrimum during seedling process on a daily basis has the effect of accelerating the growth of germlings.Thisbook=45,ebook=48treatment can also improve the stress resistance and adaptability to drought stress of germlings.
Key words:Sargassum integerrimum; germlings; desiccation; growth; biochemical constituents
通信作者:刘东超(1963-),男,副教授,主要从事藻类生理生态学研究。E-mail:liudc@gdou.edu.cn
基金项目:广东省科技计划项目(2006B60501016);广东省科技计划项目(2009B080701048)
收稿日期:2015-11-11
doi:10.3969/j.issn.1673-9159.2016.01.008
中图分类号:S917.3; S968.42
文献标志码:A
文章编号:1673-9159(2016)01-0044-07
第一作者:欧泽奎(1991-),男,硕士研究生,主要从事藻类生理生态学研究。E-mail:gdouozk@163.com

