土壤中硫化物的分析方法研究
匡华成 赵 哲 杨洪彪
(鞍山市环境监测中心站 辽宁 鞍山 114003)
土壤中硫化物的分析方法研究
匡华成 赵 哲 杨洪彪
(鞍山市环境监测中心站 辽宁 鞍山 114003)
硫化物作为土壤中常见的污染物在酸性环境中会生成H2S,造成环境污染,研究中根据环境质量要求分别针对土壤中易解析的硫化物、酸可溶解性硫化物、酸难溶性硫化物建立了相应的分析测定方法。硫化物分别在磷酸(1+1)、浓硫酸、盐酸(9.8 mol/L)作用下形成硫化氢,硫化氢随氮气进入装有乙酸锌吸收液的吸收瓶中,生成硫化锌沉淀,以碘量法定量。结果表明:酸难溶性硫化物的实际样品加标回收率为86%~98%;酸溶性硫化物的实际样品加标回收率为83%~91%,空白加标回收率为92%~97%。精密度实验中,酸溶性硫化物相对标准偏差为6.4%~8.3%。沙土、花园土、黄土、稻田土中酸难溶性硫化物的相对标准偏差分别为2.6%、4.0%、5.5%、5.8%。方法精密度和准确度满足分析要求,可以用来评估土壤中的硫化物污染问题,也可以了解不同类型硫化物的污染情况。
易解析硫化物;酸溶性硫化物;酸难溶性硫化物;碘量法
前言
土壤中的硫化物以多种形式存在,土壤硫的起源无疑是深成岩中的金属硫化物。如今大多数耕地中的硫存在于有机物、土壤溶液的可溶性硫酸盐中或吸附于土壤复合体上[1]。当前硫化物可能来源于灌溉水质、固废排放、土壤的生态效应。硫化物在酸性条件下,转化成硫化氢,从介质中易散于空气中,产生臭味,且毒性较大。释放的硫化氢是环境中硫化物可能造成的主要污染来源。
土壤中硫化物为H2S、HS-盐、金属硫化物,硫酸盐、亚硫酸盐,有机硫化物,单质S。针对可以在加热条件下酸化反应转变为硫化氢的无机硫化物,其中酸化剂不同、加热温度不同,土壤中解析出来的硫化物种类也不同。研究了土壤采集、土壤保存、土壤类型在实验中的稳定性、适用性、不同酸度下硫化物析出实验。
1 实验部分
1.1 主要仪器及试剂
加热磁力搅拌器、 pH计、碘量瓶(250 mL)、棕色滴定管(25 mL)、锥形吸收瓶(150 mL) 、柱状吸收瓶(125 mL)。
除非另有说明,分析时均使用符合国家标准的分析纯试剂和去离子水。
重铬酸钾标准储备溶液(c(1/6K2Cr2O7)=0.100 mol/L):称取105 ℃烘干2 h的基准重铬酸钾4.903 0 g溶于水中,稀释至1 000 mL,摇匀。
乙酸锌溶液(c[Zn(CH3COO)2]=2 mol/L):称取220 g±1 g乙酸锌(Zn(CH3COO)2·5H2O),溶解于500 mL水中,混匀。
淀粉指示液(10 g/L):称取1.0 g可溶性淀粉用少量去离子水调成糊状,加2 g水杨酸,再用刚煮沸的去离子水稀释至100 mL,混匀。
硫代硫酸钠标准储备溶液(c(1/6Na2S2O3)=0.1 mol/L):称取24.5 g五水合硫代硫酸钠和0.2 g无水碳酸钠溶于水中,用棕色容量瓶定容至1 L,混匀。
碘标准储备溶液(c(1/2I2)=0.1 mol/L):称取12.70 g碘于500 mL烧杯中,再添加40 g碘化钾,加适量的水使其溶解,移入1 L棕色容量瓶中稀释至标线,混匀。
乙酸锌-乙酸钠溶液:称取11.0 g乙酸锌和100.0 g无水乙酸钠溶解于水中,加入1 mL盐酸,定容至1 L,摇匀。
滴定时,将硫代硫酸钠标准储备溶液(0.1mol/L)稀释成硫代硫酸钠标准溶液(0.01mol/L);碘标准储备溶液(0.1mol/L)稀释成碘标准溶液(0.01mol/L)。
二氯化锡(SnCl2)、盐酸溶液(1+1)、磷酸溶液(1+1)、甲醛溶液(v/v=37%)。
1.2 蒸馏
1.2.1 土壤中酸溶性硫化物
称取10.0 g(精确至0.000 1 g)土壤样品于容器中,加200 mL去离子水,滴加浓硫酸直至溶液pH≤1,记录硫酸使用量。此过程在通风处进行,并不断搅拌。
称取10.0 g(精确至0.000 1 g)土壤样品移入三颈瓶中,在硫化氢吸收瓶中各加5 mL乙酸锌溶液(0.5 mol/L),连接土壤样品蒸馏装置和硫化氢吸收装置及吹气部分。 在加酸漏斗中加入50 mL浓硫酸和上述实验记录的硫酸用量。连接氮气吹气装置,确保该装置不漏气。设定氮气流速60~70 mL/min,吹气20 min,除去装置内的氧气。将水浴温度升到70 ℃,打开漏斗阀门,将硫酸加到三颈瓶中。打开氮气吹气阀,调整吹气流速60~100 mL/min,启动转子搅拌,使转子以尽可能快的速度旋转以形成漩涡。吹气90 min。关闭气路,停止加热。实验装置见图1。
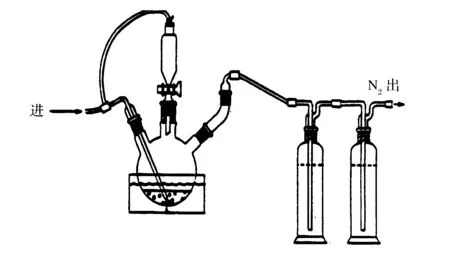
图1 实验装置图Figure 1 A diagram for the experimental setup.
1.2.2 土壤中酸难溶性硫化物
称取10.0 g(精确至0.000 1 g)土壤样品于三颈瓶中,加5 g二氯化锡、50 mL去离子水。在硫化氢吸收瓶中各加50 mL乙酸锌-乙酸钠缓冲溶液,连接土壤样品蒸馏装置和硫化氢吸收装置及吹气部分。 在加酸漏斗中加入100 mL盐酸溶液,连接氮气吹气装置,确保该装置不漏气。升温至100 ℃,吹气过程和时间同1.2.1。
1.2.3 土壤中易解析硫化物
称取10.0 g(精确至0.000 1 g)土壤样品置于三颈瓶中,在硫化氢吸收瓶中各加5 mL乙酸锌溶液(0.5 mol/L),连接土壤样品蒸馏装置和硫化氢吸收装置及吹气部分。 在加酸漏斗中加入20 mL磷酸(1+1)。连接氮气吹气装置,确保该装置不漏气, 吹气过程和时间同酸溶性硫化物的操作。
1.3 滴定[2]
将吸收液分别移至250 mL锥形瓶中,加入10.0 mL的碘标准溶液(0.01mol/L),加入5 mL盐酸溶液摇匀,于暗处静置10 min。用硫代硫酸钠(0.01 mol/L)滴定,待溶液变成淡黄时加入1 mL淀粉溶液,继续滴定至蓝色刚好消失。
2 结果与讨论
三种酸化系统针对土壤中不同类型的硫化物检测,根据实际需要可以做不同选择。磷酸系统和硫酸系统针对新鲜土壤样品中的硫化物,磷酸系统针对易解析性硫化物。硫酸系统针对酸能溶性硫化物以及部分CuS和PbS。盐酸和二氯化锡系统设计上主要针对金属硫化物。
表1中列举了在指定实验条件下不同的酸化条件对不同土壤中硫化物的检出结果。
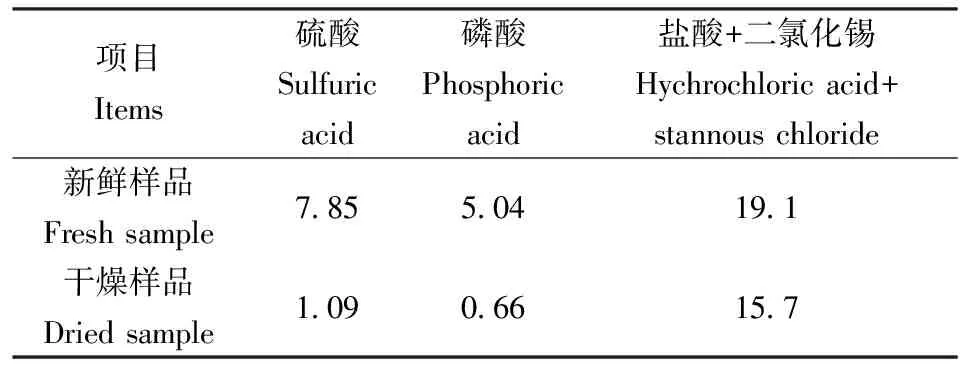
表1 不同土壤中硫化物的检出结果
表1显示同一样品在不同酸性条件下测定值会不同,土壤鲜样在硫酸、磷酸、盐酸+二氯化锡条件下的测定值分别是7.85、5.04、19.1 mg/kg。三种提取方法检出硫化物含量由低到高排列顺序是磷酸<硫酸<盐酸。三个系统中硫化物的提取是通过硫化物和酸反应生成硫化氢来完成的,盐酸+氯化亚锡测定结果比酸度接近的硫酸系统测定值要高,除了蒸馏温度高于其它系统,氯化亚锡既抑制了硫化物的氧化反应,也有可能硫单质被还原为硫化物而参与反应,使结果偏高。磷酸和硫酸系统由于酸度不同检出结果也有差异,其表现也符合理论推论,实验过程更符合自然状态下的反应条件。实践中,盐酸+二氯化锡系统与磷酸和硫酸酸化系统不可以互相替代,如果样品中不是只含有金属硫化物,建议使用磷酸和硫酸酸化系统。
2.2 土壤样品收集和保存
样品的采集,按照“土壤环境监测技术规范 HJ/T166—2004”规定采集[3]。
样品在采集后至送至实验室应低温保存。采集的样品装满玻璃瓶,玻璃瓶上部不留空间,4 ℃冷藏可最多保存7 d。另有实验结论现场采集样品在密闭容器中可以保存2 d,用氢氧化钠润湿容器内的土壤后可以保存4 d[4]。本研究样品4 ℃密闭保存可稳定3 d。
2.3 干扰及干扰消除
对于硫酸和磷酸系统,土壤中硫化物测定干扰物来自亚硫酸盐、亚硫酸氢盐、硫代硫酸盐,在酸性条件下会生成二氧化硫成正干扰,甲醛可以消除上述干扰。资料表明[4]: 土壤中亚硫酸盐含量在10 mg/kg以上时会有干扰,并且甲醛只有在亚硫酸盐含量1 000 mg/kg时使用效果才明显。本实验中,亚硫酸盐在25 mg/kg以下时不会有干扰。
微风轻送,吹动着她的细纱披风,勾勒出丰腴微耸的双肩,我隐隐感到她半透明白皙的肌肤,闪着美丽的光泽,有些像法式的奶酪,但要清冷得多,也许更应说像月光下的霜露。我偷眼看去,侧影中她的睫毛很长,挑出一道优美的曲线,轻颤颤的,似乎一下子长起来,使人感觉一厘米的睫毛能无限伸展,织成一张只有竖纹的网。
EPA建议直接向吸收液中加入5 mL甲醛溶液以消除干扰,同时做空白实验。
2.4 精密度实验[5]
对实际土壤样品平行测定6次,从而计算出实验的标准偏差和相对标准偏差,见表2、表3。
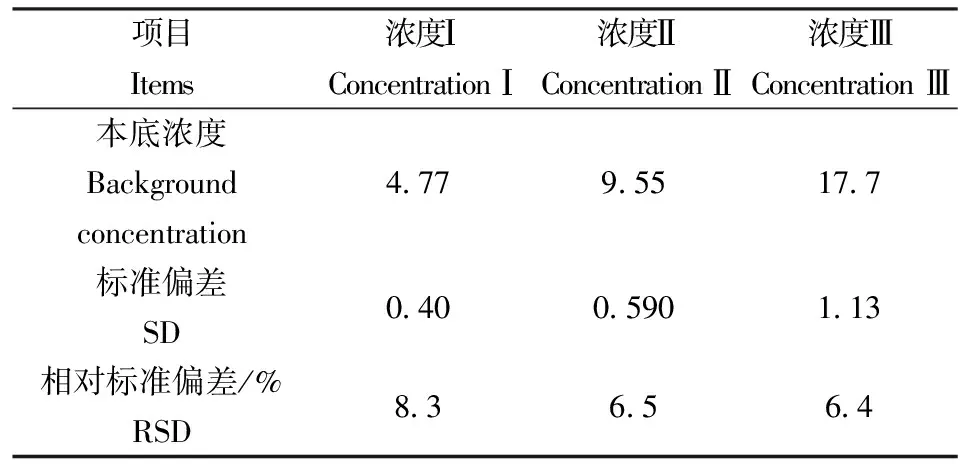
表2 土壤中酸溶性硫化物测定的精密度
从表2、表3可以看出,酸溶解性硫化物实验的三个浓度,其相对标准偏差是6.4%~8.3%。酸难溶性硫化物实验了四个土壤类型,其相对标准偏差2.6%~5.8%。精密度都能满足实验要求。
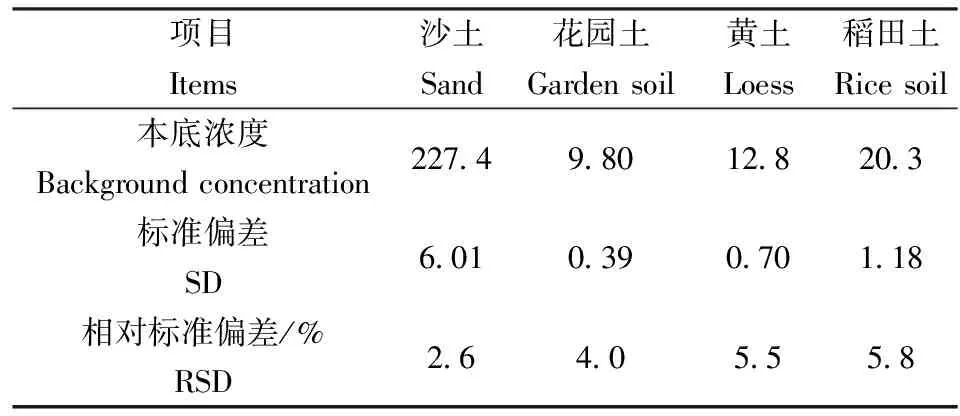
表3 土壤中酸难溶性硫化物测定的精密度
2.5 方法的准确度测定
实验方法的准确度是以实际样品的加标回收率表示。选3个浓度的实际土壤样品,每一个样品取平行双份,其中一份不加标准溶液,另外一份加入标准溶液(加标量为样品含量的 0.5~ 2倍,但加标后的总浓度应不超过方法的测定上限浓度值)。每份平行测定6次。测定结果见表4。理论上,实际样品加标回收率要达到80%~120%。本方法酸难溶硫化物加标回收率结果在86.1%~98.0%,满足对方法的质量要求(表5)。另外两种系统回收率会发生波动,有些土壤样品的加标回收率在60%~90%之间,这主要是样品中的重金属离子和其它介质的干扰。后期实验中为满足较好的加标回收率要求,做了探索性实验,蒸馏系统中加入5 g乙二胺四乙酸二钠,实际样品加标回收率达到80%以上。
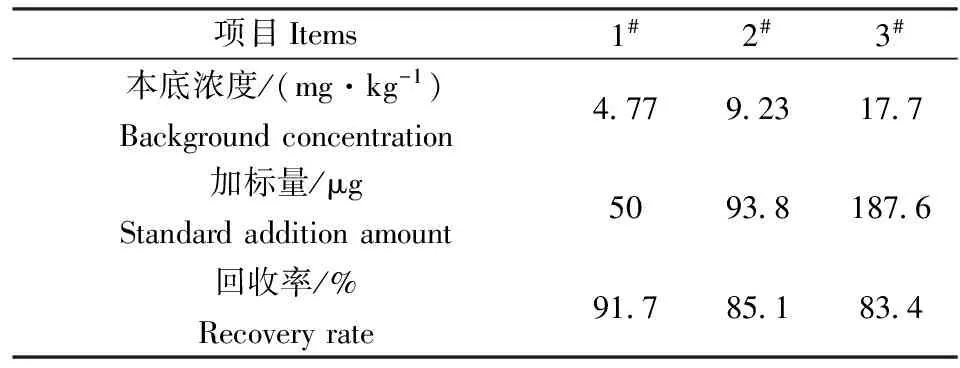
表4 土壤中酸溶性硫化物
选取了沙子、花园土壤、黄土壤、稻田土进行了加标回收率的测定,加标量为等量加标,实验结果见表5。
实验表明,酸溶解性硫化物的三个浓度的加标回收率是83.4%~91.7%,酸难溶性硫化物硫化物的加标回收率是86.1%~98%,二氯化锡避免了硫化物的氧化反应,呈现较好的加标回收率。
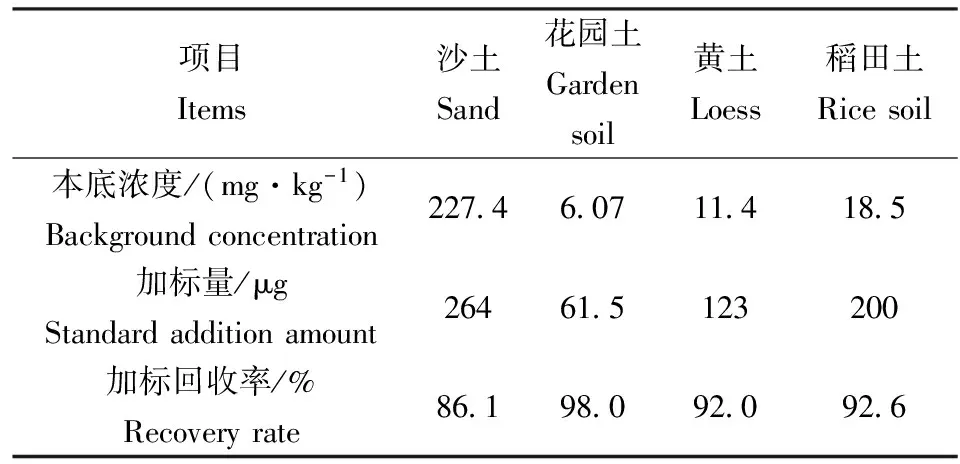
表5 土壤中酸难溶性硫化物
3 结语
本研究针对硫化物的测定,对不同的环保要求和不同的硫化物可以选用不同的实验方法。以磷酸为酸化试剂时和以硫酸为酸化试剂时的实验条件完全相同,不同之处在于酸化提取对象不同。
在实际样品检测中,针对硫酸酸化体系和磷酸酸化体系在加标回收时可能会出现加标回收率较低的情况,主要原因是土壤中的重金属或其它离子干扰造成。在盐酸和二氯化锡体系不会出现这种情况。
方法选择上,盐酸+二氯化锡系统与磷酸和硫酸酸化系统不可以互相替代,如果样品中不是只含有金属硫化物,建议使用磷酸和硫酸酸化系统。
[1] 单孝全,陈斌,铁军,等.土壤和河流中硫的形态分析[J].环境科学学报(ACTAscientiaecircumstantiae),1991,11(2):172-177.
[2] 中华人民共和国环境保护部.HJ/T60-2000水和废水中硫化物分析方法[S].北京:中国环境科学出版社,2002.
[3] 中华人民共和国环境保护部.HJ/T166-2004土壤环境监测技术规范[S].北京:中国环境科学出版社,2004.
[4] 中华人民共和国环境保护部.土壤和沉积物 硫化物分析方法[S].征求意见稿.北京:中国环境科学出版社,2016
[5] 中华人民共和国环境保护部.HJ168-2010环境监测分析方法标准制修订技术导则[S]北京:中国环境科学出版社,2010.
Study on Determination Method for Sulfide in Soils
KUANG Huacheng, ZHAO Zhe, YANG Hongbiao
(TheEnvironmentMonitoringCenterofAnshan,Anshan,Liaoning114003,China)
As a common pollutant, sulfide in soil generates H2S in acidic environment, causing environmental pollution. In this paper, based on the requirement of environmental quality, the corresponding analytical methods were established separately for unstable sulfide, acid-soluble sulfide, and acid-insoluble sulfide in soils. Sulfide hydrogen is obtained by the reaction of sulfide with phosphoric acid (1+1), sulfate and hydrochloric acid (9.8 mol/L), and then it was carried by nitrogen gas into an absorption flask with zinc acetate absorbing solution. The precipitation of zinc sulfide was formed in the absorption flask, and finally the content of sulfide was quantitatively determined by iodimetry. The results indicated that the recoveries for acid-insoluble sulfide, acid-soluble sulfide and blank were 86%-98%, 83%-91% and 92%-97%, respectively. The relative standard deviations (RSDs) for acid-soluble sulfide and acid-insoluble sulfide (sandy soil, garden soil, loess plateau and paddy soil) were 6.4%-8.3% and 2.6%-5.8%, respectively. Since the precision and accuracy of the method meet the requirement of analysis, so the method can be suitable for the determination of sulfide in soils. The results may be useful for assessing the pollution problems caused by sulfide in soils and understanding the pollution status of the different kinds of sulfide materials.
unstable sulfide;acid-soluble sulfide;acid-insoluble sulfide; iodimetry
10.3969/j.issn.2095-1035.2016.04.004
2016-04-29
2016-08-20
匡华成,男,工程师。主要从事环境监测分析研究。E-mail:976772013@qq.com
O655
A
2095-1035(2016)04-0011-04

