云南松根叶及林内土壤的碳酸酐酶活性分析
王晓丽 曹子林 和润喜 陈 诗
(1.西南林业大学林学院,云南昆明650224;2.西南林业大学环境科学与工程学院,云南昆明650224)
云南松根叶及林内土壤的碳酸酐酶活性分析
王晓丽1曹子林2和润喜1陈 诗1
(1.西南林业大学林学院,云南昆明650224;2.西南林业大学环境科学与工程学院,云南昆明650224)
从9株云南松林木上分单株取样,通过测定云南松针叶(鲜叶、枯叶)、根以及林内土壤(根际土壤、非根际土壤)的碳酸酐酶活性,分析了云南松不同器官及林内土壤碳酸酐酶活性的变化情况、差异性及其相关性。结果表明:云南松不同器官及林内土壤碳酸酐酶活性变化规律为鲜叶>枯叶>根>林内土壤,林内根际土壤和非根际土壤的碳酸酐酶活性变化规律存在一定差异;不同单株云南松鲜叶的碳酸酐酶活性保持相对稳定,且枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性皆存在与鲜叶相似的变化规律;云南松不同器官与林内土壤间碳酸酐酶活性皆存在极显著差异;云南松鲜叶、枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性两两之间皆存在极显著的相关性,因此云南松有利于林内土壤中碳酸酐酶的积累。
云南松;碳酸酐酶;针叶;根;林内土壤
碳酸酐酶是一种含Zn的金属酶,能有效地催化CO2的可逆水合反应[1-2]。岩溶地质学提出H+作为碳酸盐岩溶解的侵蚀剂促使CO2向H+和HCO3-转换是碳酸盐岩风化的第一步,此反应可能是碳酸盐岩溶解速率的决定因素,而碳酸酐酶正是该反应专一的生物催化剂[3]。
关于植物碳酸酐酶的研究,目前主要集中在低等植物微囊藻(Microcystis aeruginosa;Microcystis viridis;Microcystiswesenbergii)[4]、东海原甲藻(Prorocentrum donghaiense)、微小卡罗藻(Karlodinium micrum)[5],农作物玉米(Zea mays)[6]、水稻(Oryza sativa)[7],蔬菜诸葛菜(Orychophragmus violaceus)、油菜(Brassica campestris)[8]等方面,林木碳酸酐酶的研究较少,且关于植物碳酸酐酶的研究主要集中在碳酸酐酶与植物光合固碳能力相关性等方面。施倩倩等[9]以构树(Broussonetia papyrifera)和桑树(Morus alba)上部叶片为材料,测定其碳酸酐酶及碳酸酐酶胞外酶活力,结果表明,构树的碳酸酐酶及碳酸酐酶胞外酶活力明显高于桑树;范怡雯等[10]采用不同浓度的Zn、Cu、Ca溶液对华山松(Pinus armandii)、滇杨(Populus yunnanensis var.microphylla)、白栎(Quercus fabri)等1年生幼苗进行处理,测定不同处理下各植物的碳酸酐酶活性、叶绿素含量及荧光参数的变化,并分析其光合固碳能力,结果显示适量施用Zn、Cu、Ca能够提高植物的碳酸酐酶活性和光合固碳能力;曾宪东等[11]以西南岩溶地区黄荆(Vitex negundo)为材料,研究其碳酸酐酶的稳定性,结果表明其碳酸酐酶具有较好的热稳定性和储藏稳定性。
云南松(Pinus yunnanensis)天然林分布较广,东至贵州毕节、水城及广西西部百色地区,北达四川西南的大渡河、泸定及天全以南,西至西藏东南部的察隅,云南大多数地区均有分布,尤以金沙江中游、南盘江下游最为密集[12-13]。云南是中国岩溶分布最广的省区之一,岩溶主要分布在滇东南、滇东和滇中高原[14]。云南岩溶分布的主要区域同时也是云南松天然林的主要分布区之一。由此可见,云南松对岩溶区的生态环境具有适生性。
云南松体内碳酸酐酶的活性和分布情况及其与周围土壤中碳酸酐酶活性的相关性是研究云南松对岩溶区生态环境适生性的基础。目前,针叶用材树种碳酸酐酶活性与周围土壤中碳酸酐酶活性相关性的研究较少,本试验以云南松为试材,研究其针叶(鲜叶和枯叶)、根、林内土壤之间碳酸酐酶活性的相关性,为认识云南松对土壤中碳酸酐酶的贡献情况及为评价云南松碳酸酐酶在生物岩溶中的作用和地位提供理论依据。
1 材料与方法
1.1 材料来源
试验材料全部取自西南林业大学树木园22年生云南松林中,分单株分别采集9株云南松的鲜叶、枯叶、根、根际土壤和非根际土壤,带回实验室,备用。
1.2 研究方法
1.2.1 样品采集 在云南松林中,设3个10m×10 m的典型样地,每个样地按S形路线确定3株样树,分别采集每株样树的鲜叶、枯叶、根系、根际土壤和非根际土壤。每株样树从4个方向取新鲜针叶混合作为该株的样品,带回实验室备用。每株样树以树干基部为圆心,以1m为半径,收集该范围内的枯落叶,并将其混合作为该株的样品池,带回实验室,备用。
每株样树下按不同方向设4个取样点,先用铁铲除去枯枝落叶层,然后用铁镐和铁锨小心沿树干基部开始挖去上层覆土,逐段逐层地沿侧根生长方向追踪,找到须根部分,剪下分枝,小心将须根部分带土取出,用小刀将距根2 mm以上的土壤轻轻剥离作为非根际土收集,抖落其余土壤作为根际土并用小毛刷将无法抖落沾附在根上的土轻轻刷下一并装入土袋,每株样树将4个取样点的土壤混合作为1个样品,将混合样带回实验室处理[15]。同时将每株样树4个取样点剪下并收集完土壤样品的须根混合作为该株的根系样品,带回实验室,备用。
1.2.2 碳酸酐酶提取 每株样树取鲜叶、枯叶、须根、根际土壤和非根际土壤各4 g,分别剪碎(土壤样品无需剪碎)放入预冷的研钵中,加入液氮,再加入12mL巴比妥提取缓冲液(10 mmol/L,含巯基乙醇50mmol/L,pH 8.3)进行研磨,将研磨液倒入10 mL离心管中,置于冰浴中20 min后,在5 000 r/min下离心10min,取上清液,冷藏待测[8,11]。
1.2.3 碳酸酐酶活性测定 云南松样品和土壤样品碳酸酐酶活性的测定皆采用pH计法。保持反应系统在0~2℃,取待测粗提液0.5 mL,加入到含15 mL的巴比妥缓冲液(20 mmol/L,pH 8.3)的反应容器中,然后迅速加入10 mL预冷的(0~2℃)饱和CO2蒸馏水,用pH电极监测反应体系pH值的变化,记下pH下降1个单位(8.3至7.3)所需时间,记为te,同时记录同一样品在酶失活条件下pH下降1个单位所需的时间,记为t0,酶的活性用WA-unit表示[15-16]。WA=(te/t0-1)。酶相对活性:(活性/对照活性)×100%。
1.2.4 数据分析 运用SPSS软件进行方差分析和多重比较以及相关性分析[16]。
2 结果与分析
2.1 不同器官及土壤碳酸酐酶活性变化分析
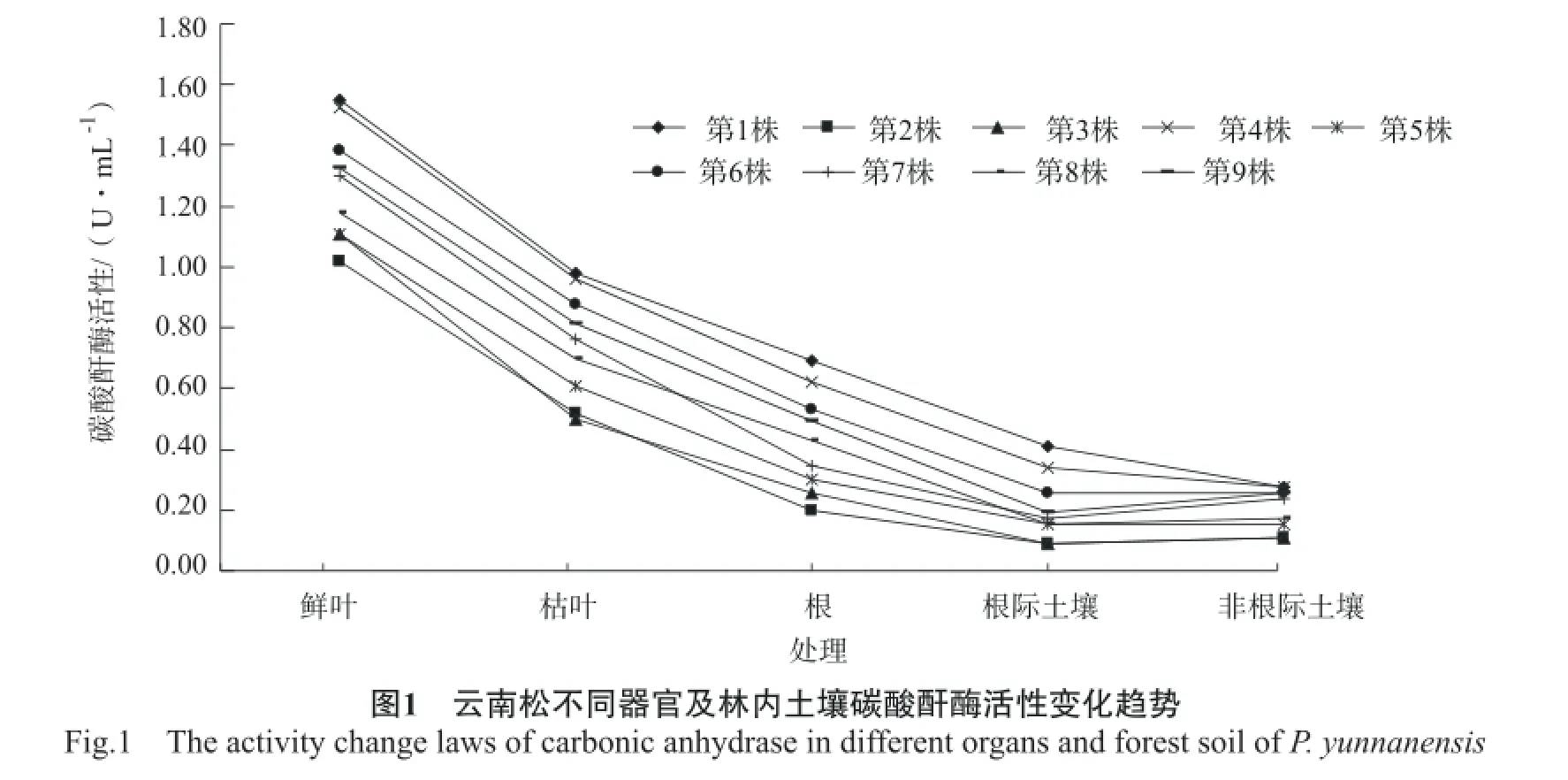
分别对9株云南松不同器官及林内土壤碳酸酐酶活性进行测定和分析,结果见图1。结果显示:9株云南松不同器官及林内土壤碳酸酐酶活性变化规律皆为鲜叶>枯叶>根>林内土壤,林内土壤中根际土壤和非根际土壤的碳酸酐酶活性变化规律存在一定的差异,其中2株根际土壤>非根际土壤,5株根际土壤<非根际土壤,2株根际土壤=非根际土壤,这可能与不同单株树下枯落叶的数量有关,树下枯落叶多的单株,枯落叶释放到土壤的碳酸酐酶的数量较多,导致根际土壤的碳酸酐酶活性等于或小于非根际土壤。
不同单株的云南松鲜叶的碳酸酐酶活性存在一定差异,但是差别不大,可见不同单株之间鲜叶的碳酸酐酶活性保持相对稳定。9株云南松鲜叶的碳酸酐酶活性最大为1.55 U/mL,最小为1.02 U/ mL,最大与最小值之间相差0.53 U/mL。不同单株的云南松枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性皆存在与鲜叶相同的差异变化规律。
2.2 不同器官及土壤碳酸酐酶活性方差分析
云南松鲜叶、枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性间存在极显著的差异(P=0<0.01)。对云南松鲜叶、枯叶、根、根际土壤和非根际土壤碳酸酐酶活性进行多重比较见表1。

表1 云南松不同器官及林内土壤碳酸酐酶活性多重比较Tab.1 Multiple comparisons of carbonic anhydrase in different organs and forest soil of P.yunnanensis
表1结果表明:鲜叶与枯叶、根、根际土壤、非根际土壤间皆存在极显著差异,枯叶与根、根际土壤、非根际土壤间皆存在极显著差异,根与根际土壤、非根际土壤间皆存在极显著差异,根际土壤与非根际土壤间无显著差异,云南松不同器官与林内土壤间碳酸酐酶活性皆存在极显著差异。
2.3 不同器官及土壤碳酸酐酶活性相关分析
云南松鲜叶、枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性两两之间皆存在极显著的相关性(表2)。结果表明:云南松鲜叶、枯叶、根中皆含有一定量的碳酸酐酶,鲜叶脱落和枯叶腐烂分解以及根的生长和延伸过程,可将碳酸酐酶释放到林内土壤中,有利于林内土壤中碳酸酐酶的积累。

表2 云南松不同器官及林内土壤碳酸酐酶活性相关性分析Tab.2 The correlation analysis of carbonic anhydrase activity in differentorgans and forest soil of P.yunnanensis
3 结论与讨论
植物中碳酸酐酶的研究大多数还停留在碳酸酐酶与光合固碳关系以及碳酸酐酶活性的影响因素等方面,随着学科的交叉融合和研究的不断深入,尤其是在发现碳酸酐酶在催化碳酸盐岩地区的二氧化碳的可逆水合反应之后,一些学者开始致力于植物对碳酸盐岩生境的适生性机制以及植物的生物岩溶作用等方面的研究。本试验对22年生的9株云南松林木针叶(鲜叶和枯叶)、根、林内土壤中碳酸酐酶活性进行测定并作相关性分析,结果显示:9株云南松不同器官及林内土壤碳酸酐酶活性变化规律皆为鲜叶>枯叶>根>林内土壤,林内土壤中根际土壤和非根际土壤的碳酸酐酶活性变化规律存在一定的差异。不同单株的云南松鲜叶的碳酸酐酶活性保持相对稳定,且不同单株的云南松枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性皆存在与鲜叶相似的变化规律。方差分析显示云南松不同器官与林内土壤间碳酸酐酶活性皆存在极显著差异。相关性分析显示云南松鲜叶、枯叶、根、根际土壤、非根际土壤的碳酸酐酶活性两两之间皆存在极显著的相关性,云南松有利于林内土壤中碳酸酐酶的积累。
本研究为进一步探索云南松对土壤中碳酸酐酶的贡献情况奠定了一定基础,今后可开展云南松林内土壤微生物碳酸酐酶活性方面的研究以及田间可控条件下云南松与土壤中碳酸酐酶活性相关性的研究,将林内研究与田间可控条件下的研究相结合,分析云南松对岩溶生态的适生对策,从而指导云南松天然林的经营管理,并为更好地恢复石漠化区云南松人工植被提供定向培育的理论依据和技术指导,同时丰富我国岩溶生态系统良性生态恢复的研究。
[1] Tripp B C,Sm ith K,Ferry J G.Carbonic anhydrase:new insights for an ancient enzyme[J].J Biol Chem,2001,276:48615-48618.
[2] Cronk J D,Endrizzi J A,Cronk M R,et al.Crystal structure of E.coli alpha-carbonic anhydrase,an enzyme with an unusual pH-dependent activity[J].Protein Sci,2001,10:911-922.
[3] 曾宪东.植物碳酸酐酶对石灰岩岩溶的驱动作用研究[D].武汉:华中科技大学,2004.
[4] 王山杉,刘永定,邹永东,等.微囊藻碳酸酐酶活性在不同环境因素下的调节与适应[J].生态学报,2006,26(8):2443-2448.
[5] 戴芳芳,周成旭,严小军,等.pH及光照对两种赤潮甲藻种群生长和胞外碳酸酐酶活性的影响[J].海洋环境科学,2011,30(5):694-698.
[6] 胥献宇.不同光照条件下玉米碳酸酐酶活性差异比较与分析[J].安徽农业科学,2010,38(33):18684-18688.
[7] 陈雄文.不同环境条件下水稻叶片中叶绿体内碳酸酐酶活性的变化[J].湖北师范学院学报(自然科学版),2000,20(4):40-42.
[8] 吴沿友,李西腾,郝建朝,等.不同植物的碳酸酐酶活力差异研究[J].广西植物,2006,26(4):366-369.
[9] 施倩倩,吴沿友,朱咏莉,等.构树与桑树叶片的碳酸酐酶胞外酶活力比较[J].安徽农业科学,2010,38(16):8376-8377.
[10] 范怡雯,喻理飞,蔡国俊,等.锌、铜、钙对植物碳酸酐酶及荧光特性的影响[J].广东农业科学,2013,40(9):32-35,64.
[11] 曾宪东,余龙江,李为,等.西南岩溶地区黄荆叶片碳酸酐酶的稳定性[J].植物学通报,2005,22(2):169-174.
[12] 蔡年辉,李根前.云南松天然林区植物群落结构的空间动态研究[J].西北植物学报,2006,26(10):2119-2124.
[13] 金振洲,彭鉴.云南松[M].昆明:云南科技出版社,2004:432-439.
[14] 谷勇,陈芳,李昆,等.云南岩溶地区石漠化生态治理与植被恢复[J].科技导报,2009,27(5):75-80.
[15] 沈有信,周文君,刘文耀,等.云南松根际与非根际磷酸酶活性与磷的有效性[J].生态环境,2005,14(1):91-94.
[16] 徐仲安,王天保,李常英,等.正交试验设计法简介[J].科技情报开发与经济,2002,12(5):148-150.
(责任编辑 张 坤)
The Correlation Analysis of Carbonic Anhydrase Activity in Needles,Roots and Forest Soil of Pinus yunnanensis
Wang Xiaoli1,Cao Zilin2,He Runxi1,Chen Shi1
(1.College of Forestry,Southwest Forestry University,Kunming Yunnan 650224,China;2.College of Environmental Science and Engineering,Southwest Forestry University,Kunming Yunnan 650224,China)
To analyze the change,difference and correlation of carbonic anhydrase activity in different organs and forest soil,different needles(fresh leaves,dead leaves),roots and forest soil(rhizosphere soil,non rhizosphere soil)of 9 single plants of P.yunnanensis were analyzed.The results showed that the carbonic anhydrase activity change lawswere fresh leaves>dead leaves>roots>forest soil,but the carbonic anhydrase activity change laws of rhizosphere soil and non rhizosphere soil had some differences;the carbonic anhydrase activity of fresh leaves in different individual of P.yunnanensis remained relatively stable,and the carbonic anhydrase activity of dead leaves,roots,rhizosphere soil and non rhizosphere soil in different individual of P.yunnanensis remained relatively stable with being similar to the fresh leaves;the carbonic anhydrase activity of P.yunnanensis were extremely differentwith different organs and forest soil;the carbonic anhydrase activity of P.yunnanensis were extremely correlated with fresh leaves,dead leaves,roots,rhizosphere soil and non rhizosphere soil.Accordingly,P. yunnanensis was conducive to the accumulation of carbonic anhydrase in forest soil.
Pinus yunnanensis;carbonic anhydrase;needles;roots;forest soil

S714.5
A
2095-1914(2016)02-0031-04
10.11929/j.issn.2095-1914.2016.02.005
2015-09-20
云南省高校优势特色重点学科(生态学)建设项目资助。
第1作者:王晓丽(1976—),女,副教授。研究方向:森林培育。Email:1144607944@qq.com。

