强还原土壤对尖孢镰刀菌的抑制及微生物区系的影响①
刘亮亮,黄新琦,2,3,朱 睿,张金波,2,3,蔡祖聪,2,3*
(1 南京师范大学地理科学学院,南京 210023;2 江苏省物质循环与污染控制重点实验室,南京 210023;3 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
强还原土壤对尖孢镰刀菌的抑制及微生物区系的影响①
刘亮亮1,黄新琦1,2,3,朱 睿1,张金波1,2,3,蔡祖聪1,2,3*
(1 南京师范大学地理科学学院,南京 210023;2 江苏省物质循环与污染控制重点实验室,南京 210023;3 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
摘 要:强还原土壤灭菌(reductive soil disinfestation,RSD)是一种抑制土传病原菌的高效和环保的方法。本试验通过荧光定量PCR和变性梯度凝胶电泳研究RSD对土壤尖孢镰刀菌(Fusarium oxysporum)及微生物区系的影响。结果表明:处理15天后,较对照(CK)相比,除添加氨水处理(NH3)土壤pH上升外,以苜蓿粉和乙醇为有机碳源的RSD(Al-RSD和Et-RSD)处理土壤pH分别降低了0.54和1.16;NH3、Al-RSD和Et-RSD处理将尖孢镰刀菌数量分别降低了74%、98% 和93%;Al-RSD显著增加了细菌的数量和多样性,Al-RSD和Et-RSD处理显著降低了土壤中真菌的数量,但增加了真菌的多样性。结果表明RSD与氨气熏蒸相比对于土壤微生物区系的改善具有更好的作用。
关键词:强还原土壤灭菌;土传病害;尖孢镰刀菌;微生物区系
香蕉是一种历史悠久的水果,在世界上一度认为是继水稻、小麦和玉米之后需求最大的农作物[1],然而一场对香蕉具有毁灭性的土传病害给香蕉产业带来了极大的打击。香蕉枯萎病,又称巴拿马病,是一种由尖孢镰刀菌古巴专化型(Fusarium oxysporum f.sp.cubense,FOC)引起的、世界广泛分布的土传真菌病害[2]。FOC主要通过根部感染植株并寄生于根茎中,引起植株维管束坏死,导致香蕉树枯萎[3]。该菌腐生能力强,即使没有寄主,也能产生厚垣孢子在土壤中长期存活[4-5]。它的传播途径分为自然因素和人为因素,主要包括苗木、土壤、流水、耕作工具以及人等途径传播,其感染力高、致病力强、死亡率大,防治非常困难[6]。
目前,彻底防治香蕉枯萎病的方法仍未找到,而现阶段采用较多的是物理防治、化学防治、培育抗病品种以及生物防治。物理防治如土壤暴晒法,虽然有一定的效果,但操作复杂,气候条件限制性大;某些化学杀菌剂,如溴甲烷,具有很强的杀菌效果,但对食品和人类健康具有很大的安全隐患[7];抗病品种在现阶段倍受青睐,但在土传病害防治上仍未发挥应有的作用[8],且存在病原菌不断积累的风险;由于具有环保、有效等优点,近年来生物防治土传病害的相关研究越来越多,在国内外已有诸多学者采用生防菌抑制病原菌,如哈茨木霉、枯草芽孢杆菌等[9-10],但外源添加的生防菌,它既要克服土著微生物的排斥,也要适应土壤以及周围的环境,见效慢和效果不稳定[11]。
2000年,日本Shinmura[12]和荷兰Blok等[13]人相继采用强还原法(reductive soil disinfestation,RSD)杀灭土壤病原微生物,此方法是由向土壤中添加易分解有机碳源并维持土壤厌氧状态组成,可在2~4周内杀灭大量土传病原菌,目前作为化学熏蒸剂替代品广泛用于农业生产中。国内黄新琦等[14-15]采用淹水方式实施RSD,虽然杀菌效果很明显,但是对于持水力较差的土壤采用淹水方式操作较为困难,因此,本试验采用添加有机物料后灌溉土壤至最大田间持水量并覆膜的方式实施RSD。此外,尽管RSD在日本和美国已取得一系列推广应用,但已有的研究表明,RSD对土壤微生物区系影响的相关研究较少[16],因此,本试验研究了不同有机物料的RSD及氨气熏蒸对于连作土壤中FOC、细菌和真菌数量及土壤微生物区系的影响。
1 材料与方法
1.1 试验材料
供试土壤:试验地位于海南省乐东县(109.17°E、18.75°N)香蕉种植园内,由于较高的香蕉枯萎发病率,此地块已被撂荒一年。该土壤pH 6.5,电导率40.8 μS/cm,有机碳和全氮含量分别为9.46 g/kg与0.43 g/kg。供试有机物料:苜蓿粉和乙醇。供试氨水浓度为25%。
1.2 试验处理
试验分为4个处理:原位土壤(CK)、土壤中添加500 ml/m2氨水后灌溉至最大田间持水量并覆膜(NH3)、土壤中添加2 kg/m2苜蓿粉后灌溉至最大田间持水量并覆膜(Al-RSD)、土壤中添加1 L/m2乙醇后灌溉至最大田间持水量并覆膜(Et-RSD),每个处理3个重复,每个重复面积为1 m ×1 m。处理期间温度25~35℃,处理周期为15 天,处理完成后揭膜,分别采取各处理0~20 cm和20~40 cm土层的土壤。
1.3 测定方法
1.3.1 土壤pH的测定 将土壤与去离子水以1︰2.5的比例混匀,然后以200 r/min在摇床中振荡30 min后用pH计(Mettler S220K,Switzerland)测定土壤pH。
1.3.2 土壤DNA的提取 土壤DNA提取使用试剂盒Power SoilTMDNA Isolation Kit(MO BIO Laboratories Inc.,USA)。
1.3.3 实时荧光定量PCR对真菌、细菌和FOC的定量 本试验通过实时荧光定量PCR和相应的特异性引物对真菌、细菌和FOC进行定量。定量PCR扩增采用8联管在CFX96TMReal-Time System(Bio-Rad Laboratories Inc.,Hercules, CA,USA)上进行。每个PCR管的反应体系总量为20 μl[17]:2 μl DNA模板,10 μl SYBR Green premix EX Taq(2×),正反引物各1 μl(真菌特异性引物:ITS1-f和5.8 s;细菌特异性引物:Eub338和Eub518;FOC特异性引物:ITS1-F 和AFP308,表1),6 μl无菌水。真菌和细菌的反应条件:95℃ × 2 min预变性,95℃ × 10 s高温解链,53℃ × 20 s低温退火,72℃ × 30 s延伸,40个循环;FOC反应条件:95℃ × 2 min预变性,95℃ × 10 s高温解链,58℃ × 15 s低温退火,72℃ × 20 s延伸,40个循环;在每个循环的延伸阶段采集荧光信号,并在反应结束后绘制熔解曲线。标准品的构建参照文献[18],得出的真菌、细菌及FOC标准曲线分别为:y = -3.003 0x + 47.779,R2= 0.999;y = -3.368 0x + 49.903,R2= 0.996 1;y = -3.358 6x + 51.282,R2= 0.995 3。
1.3.4 变性梯度凝胶电泳检测土壤微生物多样性 对土壤DNA进行PCR扩增所使用的细菌引物为GCU968(GC夹子40 bp)和L1401,真菌引物为GC-Fungi 和NS1(表1)。PCR反应体系总量为25 μl:1 μl DNA模板,正反引物各1 μl,12.5 μl Mix Taq(2×),9.5 μl无菌水。细菌PCR反应条件为94°C × 5 min预变性,94℃ × 10 s高温解链,52℃ × 20 s低温退火,72℃ × 30 s延伸,32个循环,72℃ × 10 min再延伸;真菌PCR反应条件:95℃ × 5 min预变性,94℃ × 20 s高温解链,55℃ × 20 s低温退火,72℃ × 30 s延伸,32个循环,72℃ × 7 min再延伸。PCR扩增后的产物通过琼脂糖凝胶电泳进行检测。

表1 实时荧光定量PCR与PCR-DGGE引物列表Table 1 The primers used in quantitative real-time PCR andPCR-DGGE
采用D-Code System(Bio-Rad Laboratories Inc.,Hercules,CA,USA)进行变性梯度凝胶电泳(DGGE),在6%(w/v)的聚丙烯酰胺凝胶(40% acrylamide/bisacrylamide,37.5︰1,Bio-Rad)中加入等量浓度PCR产物,然后以60℃、80 V进行电泳,持续16 h。细菌和真菌的变性梯度分别为45%~60% 和25%~40%,通过成像仪和Quantity One 4.6.3对电泳效果进行检测及分析。
1.4 数据处理与分析
采用Excel 2003、Origin 8.0和SPSS 19.0(SPSS Inc.,Chicago,USA)统计分析软件对土壤pH、微生物数量(细菌、真菌和FOC)及微生物多样性数据进行处理与分析,并结合LSD多重比较法检验各处理间的差异显著性(P<0.05)。
2 结果与分析
2.1 土壤pH的变化
处理15天揭膜后,0~20和20~40 cm土层:NH3处理的pH较CK分别显著增加了1.29和1.06;而Et-RSD处理的pH较CK分别显著降低了1.3和0.34。Al-RSD处理0~20 cm土层pH较CK降低了0.54,但20~40 cm土层显著增加了0.53(图1)。
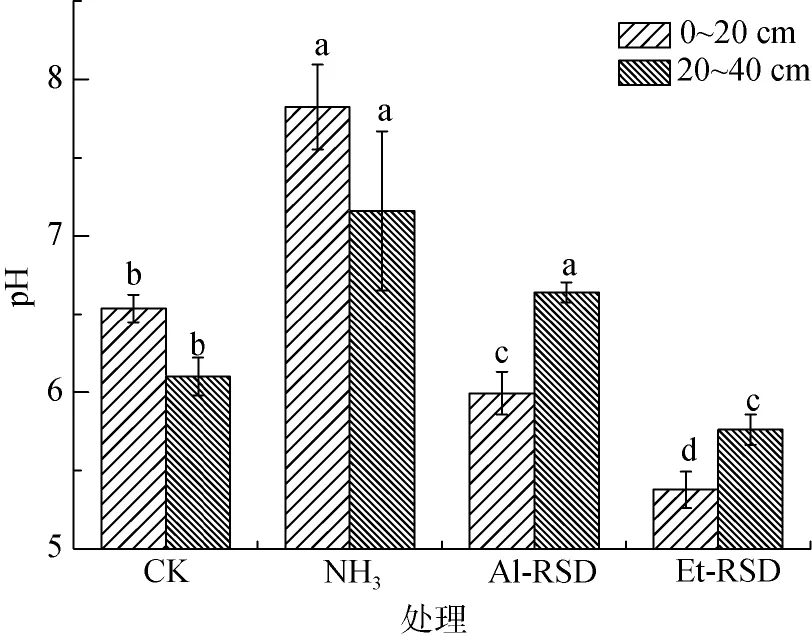
图1 处理结束后原位土壤(CK)、添加氨水(NH3)、苜蓿粉RSD处理(Al-RSD)和乙醇RSD处理(Et-RSD)的土壤pHFig.1 Soil pH in untreated soil(CK),treated with NH3,RSD with alfalfa(Al-RSD),and RSD with ethanol(Et-RSD)at the end of treatments
2.2 土壤真菌和细菌数量变化
处理结束后,0~20 cm土层,NH3处理的真菌数量较CK无显著差异,Al-RSD和Et-RSD处理的真菌数量(1.26 × 108、7.05 × 107copies/g)较CK(4.29×108copies/g)分别显著降低了71% 和 84%(图2);20~40 cm土层,除Al-RSD处理的真菌数量(3.16 × 108copies/g)较CK(1.59 × 108copies/g)显著增加了97% 之外,NH3和Et-RSD处理较CK都无显著变化。Al-RSD处理0~20 cm、20~40 cm的细菌数量(4.21 × 1010、2.48 × 1010copies/g)较CK(1.90 × 1010、1.11 × 1010copies/g)分别显著增加了121.42% 和123.42%,NH3和Et-RSD处理的土壤细菌数量与CK比较差异均不显著(图2)。
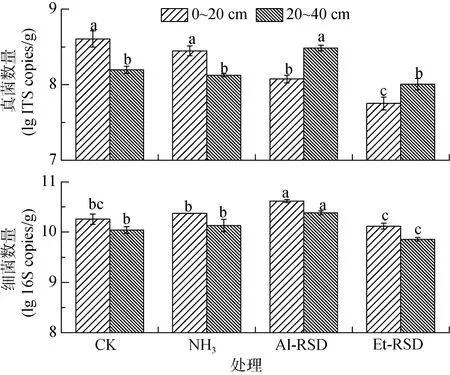
图2 处理结束后土壤真菌和细菌数量Fig.2 Populations of bacteria in soils at end of treatments
2.3 尖孢镰刀菌(FOC)数量及其占真菌比重
处理结束后,0~20 cm土层,NH3、Al-RSD和Et-RSD处理的FOC数量(3.32 × 106、2.63 × 105、8.63 × 105copies/g)较CK(1.28×107copies/g)分别显著降低了74%、98% 和93%。NH3处理20~40 cm 土层FOC数量与CK相比差异不显著,但Al-RSD和Et-RSD处理较CK分别显著降低了71% 和61%(图3)。
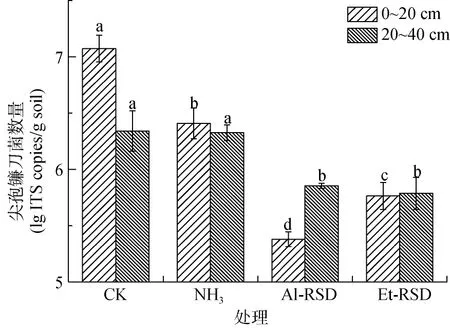
图3 处理结束后土壤FOC数量Fig.3 Populations of FOC in soils at end of treatments
根据FOC与真菌的数量可知FOC在4个处理土壤中占真菌的比重。0~20 cm土层,CK处理FOC占真菌的比重最高,NH3、Al-RSD和Et-RSD处理FOC占真菌的比重较CK分别显著下降了66%、92% 和64%。20~40 cm土层,NH3处理FOC占真菌比重与CK相比差异不显著,Al-RSD与Et-RSD处理分别显著下降了83% 和55%(表2)。

表2 尖孢镰刀菌占真菌比重(%)Table 2 Proportions of FOC in Fungi
2.4 土壤微生物多样性的变化
采用Quantity one 软件对DGGE图谱(图4)进行分析后,选用Shannon-Weaver指数(H′)、丰度(S)并结合聚类分析构建系统发育树分析各处理土壤微生物多样性[26]。从图4可以看出Al-RSD处理土壤细菌条带数量和组成较CK处理相比发生了明显变化。从表3可知细菌的H′ 和S的大小排列依次为Al-RSD、Et-RSD、NH3和CK,并且Al-RSD的H′ 和S与另3个处理差异相比均显著增加,表明Al-RSD处理细菌物种多样性最丰富;真菌的H’ 和S的大小排列依次为Et-RSD、Al-RSD、NH3和CK,并且Al-RSD和Et-RSD的H′与S与CK相比均显著增加,表明Al-RSD和Et-RSD处理真菌的物种多样性最为丰富。从图5可知,NH3和Et-RSD处理中的细菌群落具有较高的相似度;CK与NH3、Al-RSD与Et-RSD间的真菌群落也具有较高相似度。
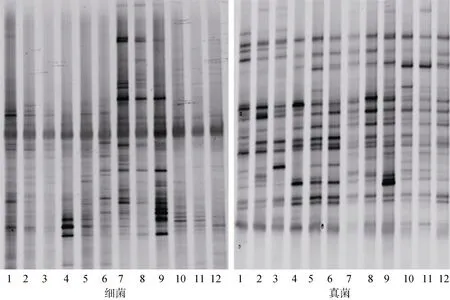
图4 处理结束后细菌和真菌DGGE图谱Fig.4 DGGE profiles of bacteria and fungi at end of treatments

表3 各样品微生物多样性分析结果Table 3 Microbial diversities of four treatments
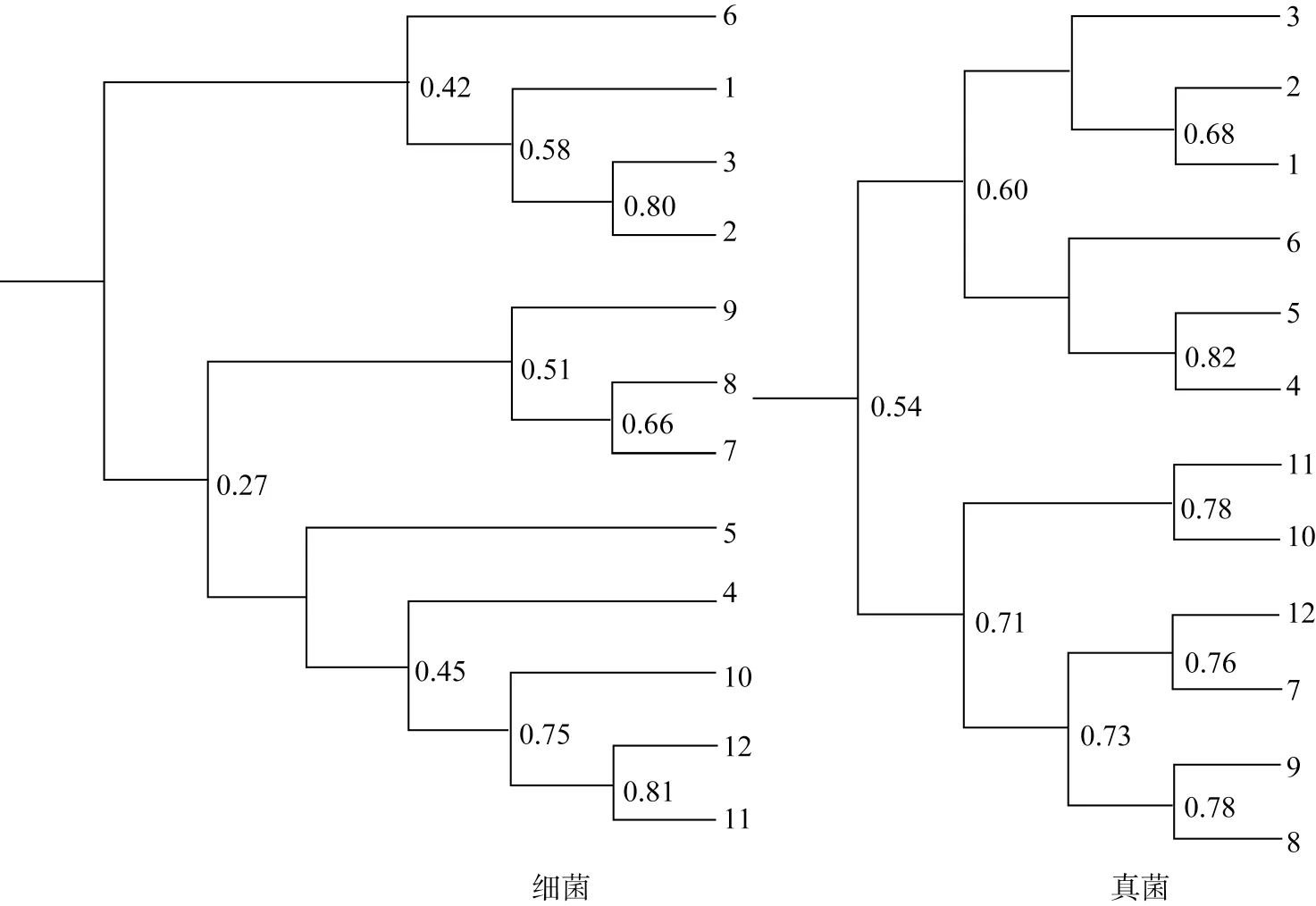
图5 聚类分析系统发育树Fig.5 Clustering analysis of phylogenetic tree
3 讨论
Stover[4]通过土壤淹水方式杀灭引起香蕉枯萎病的FOC,但是耗时近4个月,且杀菌效果不好。黄新琦等[14]研究结果也表明单独淹水在短时间内并不能很好地抑制病原菌,但是淹水同时添加有机物料使土壤呈现强烈还原状态显著地降低了土壤中FOC数量,本试验结果与此相似。然而,对于持水力较差的土壤采用淹水方式操作较为困难,且费时费水,所以本试验采用添加有机物料后灌溉土壤至最大田间持水量并覆膜的方式实施RSD,结果表明此方法也能取得较好的杀菌效果。
已有的研究报道表明[13,27],RSD的杀菌机理可能有:厌氧状态、抑菌物质(有毒有机酸和还原性产物)以及土壤微生物群落结构的改变。本试验中Al-RSD和Et-RSD处理0~20 cm的pH降低是由于在厌氧条件下,微生物分解有机物料产生有机酸所致,然而这些有机酸在土壤转为好氧状态后便会很快挥发或分解,并不会导致土壤酸化[17]。研究表明,RSD过程中产生的某些有机酸,如乙酸和丁酸对FOC具有很强的抑制作用[17,28],Al-RSD和Et-RSD处理土壤中FOC数量急剧下降可能是RSD过程中产生的有毒有机酸所造成的。相关研究表明氨气对于土传病原菌具有较好的抑制效果[29],本试验中NH3处理0~20 cm FOC显著下降可能是因为氨水熏蒸具有直接的杀菌作用。
土壤微生物区系对植物生长至关重要,它是衡量土壤微生物多样性和肥力的一个重要指标[30]。而土壤微生物多样性也是土壤生态系统稳定性及土壤生产力一个重要组成部分[31]。有研究表明植物根际促生菌(plant growth promoting rhizobacteria,PGPR)在防治土传病害和促进植物生长方面也具有重要的作用[32]。本试验中Al-RSD处理的细菌数量较CK显著增加,而Et-RSD处理较CK相比无显著差异,可能是因为苜蓿粉中有机碳源比较丰富,从而促使能利用这些碳源的细菌增加;而Et-RSD处理中碳源单一,能利用乙醇的细菌较少。此外,尤为重要的是Al-RSD处理显著地增加了土壤细菌多样性,改善了土壤微生物区系。Mowlick等[33]人研究指出在RSD过程中会产生许多厌氧细菌,其中以厚壁菌门梭菌属Clostridia和芽孢杆菌属Bacilli为主,其产生的孢子可以快速生长并繁殖为优势种,从而抑制病原菌的生存,本研究中RSD处理后所增加的新菌种可能与之相似。然而,Mowlick等[16]指出RSD处理后细菌多样性与处理前相比显著降低,与本试验结果相反,原因可能是DGGE与克隆文库检测的灵敏度不一,或不同有机碳源的RSD对不同土壤微生物区系的影响不尽相同。就真菌而言,RSD处理均显著减少了真菌数量,但显著增加了土壤真菌多样性,这对后续植物的健康生长至关重要。虽然利用氨水熏蒸对土壤病原微生物有一定的抑制效果,但其对土壤微生物区系的改善并无明显作用,同时还存在着许多问题,如处理后不能及时种植,否则会出现严重的烧苗现象[29]。相比而言RSD处理不仅减少了土壤中病原菌的数量,而且显著增加了土壤微生物多样性,改善了土壤微生物区系。
虽然Blok等[13]提到采用固体有机物料的RSD操作耗费劳动力的缺点,Momma等[34]人研究表明其杀菌效果不如乙醇,但是本研究表明采用固体有机物料的RSD对土壤微生物区系的改良效果要优于乙醇处理,此外还可以解决秸秆处理一直存在的困境从而变废为宝[35]。因此,乙醇和作物秸秆相结合的RSD对于退化土壤的改良效果可能会更佳,这有待进一步研究。
参考文献:
[1]Akila R,Rajendran L,Harish S,et al.Combined application of botanical formulations and biocontrol agents for the management of Fusarium oxysporum f.sp.Cubense(Foc)causing Fusarium wilt in banana[J].Biological Control,2011,57(3):175-183
[2]Thangavelu R,Palaniswami A,Velazhahan R.Mass production of Trichoderma harzianum for managing fusarium wilt of banana[J].Agriculture,ecosystems and environment,2004,103(1):259-263
[3]Viljoen A.The status of Fusarium wilt(Panama disease)of banana in South Africa:Review article[J].South African Journal of Science,2002,98(8):341-344
[4]Stover R H.Fusarial Wilt(Panama Disease)of Bananas and Other Musa Species[M].Kew,UK:Commonwelth Mycological Institute,1962
[5]彭双,王一明,叶旭红,等.土壤环境因素对致病性尖孢镰刀菌生长的影响[J].土壤,2014,46(5):845-850
[6]肖彤斌,谢圣华,芮凯,等.香蕉枯萎病的发生及防控对策[J].热带农业科学,2007,26(6):53-54
[7]Gamliel A,Austerweil M,Kritzman G.Non-chemical approach to soilborne pest management-organic amendments[J].Crop Protection,2000,19(8):847-853
[8]李世东,缪作清,高卫东.我国农林园艺作物土传病害发生和防治现状及对策分析[J].中国生物防治学报,2011,27(4):433-440
[9]王洪梅,吴云成,沈标.青枯病生防菌 N5 的特性及其生物学效应[J].土壤,2013,45(6):1 082-1 090
[10]罗佳,陈立华,赵爽,等.棉花黄萎病生防菌脂肽类抑菌物质分离和鉴定[J].土壤学报,2012,49(3):612-619
[11]殷晓敏,陈弟,郑服丛.尖镰孢枯萎病生物防治研究进展[J].广西农业科学,2008,39(2):172-178
[12]Shinmura A.Causal agent and control of root rot of welsh onion[C].PSJ Soilborne Disease Workshop Report,2000,20:133-143
[13]Blok W J,Lamers J G,Termorshuizen A J,et al.Control of soilborne plant pathogens by incorporating fresh organic amendments followed by tarping[J].Phytopathology,2000,90(3):253-259
[14]黄新琦,温腾,孟磊,等.土壤快速强烈还原对于尖孢镰刀菌的抑制作用[J].生态学报,2014,34(16):4 526-4 534
[15]黄新琦,温腾,孟磊,等.土壤厌氧还原消毒对尖孢镰刀菌的抑制研究[J].土壤,2014,46(5):851-855
[16]Mowlick S,Inoue T,Takehara T,et al.Changes and recovery of soil bacterial communities influenced by biological soil disinfestation as compared with chloropicrintreatment[J].AMB Express,2013,3(1):1-12
[17]Huang X Q,Wen T,Zhang J B,et al.Toxic organic acids produced in biological soil disinfestation mainly caused the suppression of Fusarium oxysporum f.sp.cubense[J].BioControl,2014:1-12
[18]Lopez-Mondejar R,Anton A,Raidl S,et al.Quantification of the biocontrol agent Trichoderma harzianum with real-time TaqMan PCR and its potential extrapolation to the hyphal biomass[J].Bioresource Technology,2010,101(8):2 888-2 891
[19]Gardes M,Bruns T D.ITS primers with enhanced specificity for basidiomycetes—— application to the identification of mycorrhizae and rusts[J].Molecular Ecology,1993,2(2):113-118
[20]Vilgalys R,Hester M.Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species[J].Journal of Bacteriology,1990,172(8):4 238-4 246
[21]Dorsch M,Lane D,Stackebrandt E.Towards a phylogeny of the genus Vibrio based on 16S rRNA sequences[J].International Journal of Systematic Bacteriology,1992,42(1):58-63
[22]Muyzer G,De Waal E C,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reactionamplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59(3):695-700
[23]Lievens B,Brouwer M,Vanachter A C R C,et al.Quantitative assessment of phytopathogenic fungi in various substrates using a DNA macroarray[J].Environmental Microbiology,2005,7(11):1 698-1 710
[24]Zoetendal E G,Akkermans A D L,De Vos W M.Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and hostspecific communities of active bacteria[J].Applied and Environmental Microbiology,1998,64(10):3 854-3 859
[25]Hoshino Y T,Morimoto S.Comparison of 18S rDNA primers for estimating fungal diversity in agricultural soils using polymerase chain reaction-denaturing gradient gel electrophoresis[J].Soil Science and Plant Nutrition,2008,54(5):701-710
[26]吴凤芝,王学征.设施黄瓜连作和轮作中土壤微生物群落多样性的变化及其与产量品质的关系[J].中国农业科学,2007,40(10):2 274-2 280
[27]Momma N,Kobara Y,Uematsu S,et al.Development of biological soil disinfestations in Japan[J].Applied Microbiology and Biotechnology,2013,97(9):3 801-3 809
[28]Momma N,Yamamoto K,Simandi P,et al.Role of organic acids in the mechanisms of biological soil disinfestation(BSD)[J].Journal of General Plant Pathology,2006,72(4):247-252
[29]刘庆城,许玉兰.液氨施肥防治作物土传病害的研究[J].中国农业科学,1986(1):29-32
[30]薛超,黄启为,凌宁,等.连作土壤微生物区系分析,调控及高通量研究方法[J].土壤学报,2011,48(3):612-618
[31]杨芳,徐秋芳.土壤微生物多样性研究进展[J].浙江林业科技,2002,22(6):39-41
[32]胡江春,薛德林,马成新,等.植物根际促生菌(PGPR)的研究与应用前景[J].应用生态学报,2004,15(10):1 963-1 966
[33]Mowlick S,Hiorta K,Takehara T,et al.Development of anaerobic bacterial community consisted of diverse clostridial species during biological soil disinfestation amended with plant biomass[J].Soil Science and Plant Nutrition,2012,58(3):273-287
[34]Momma N,Momma M,Kobara Y.Biological soil disinfestation using ethanol:Effect on Fusarium oxysporum f.sp.lycopersici and soil microorganisms[J].Journal of General Plant Pathology,2010,76(5):336-344
[35]鞠昌华.我国农作物秸秆处理的困境与对策[J].贵州农业科学,2011,39(6):221-224
Influences of Reductive Soil Disinfestation on Fusarium oxysporum and Soil Microbiome
LIU Liangliang1,HUANG Xinqi1,2,3,ZHU Rui1,ZHANG Jinbo1,2,3,CAI Zucong1,2,3*
(1 School of Geography Science,Nanjing Normal University,Nanjing 210023,China; 2 Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control,Nanjing 210023,China; 3 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application,Nanjing 210023,China)
Abstract:Reductive soil disinfestation(RSD)is an effective and environmentally-friendly method to suppress soil-borne pathogens.Real-time PCR and denaturing gradient gel electrophoresis were performed to investigate the influences of RSD on Fusarium oxysporum and soil microflora.Results showed that in 15 days after treatment,except for the NH3treatment,soil pH in Al-RSD and Et-RSD treatments decreased by 0.54 and 1.16 compared with that in the control treatment.NH3,Al-RSD and Et-RSD significantly reduced the numbers of Fusarium oxysporum in soil by 76%,98% and 94%,respectively.Al-RSD significantly increased the populations and diversities of bacteria.Al-RSD and Et-RSD significantly decreased the populations of fungi in the upper soil,but increased the fungal diversities.These results indicated that RSD has a better effect on the improvement of soil microflora compared with ammonia fumigation.
Key words:Reductive soil disinfestation; Soil-borne disease; Fusarium oxysporum; Soil microflora
作者简介:刘亮亮(1990—),男,江西永新人,硕士研究生,主要从事土壤微生物及土传病害生物防控等方面研究。E-mail:15996230060@ 163.com
* 通讯作者(zccai@njnu.edu.cn)
基金项目:①国家自然科学基金项目(41301335)、中国博士后科学基金项目(2014M551622)和江苏高校优势学科建设工程项目资助。
DOI:10.13758/j.cnki.tr.2016.01.014
中图分类号:S154.3

