镜检法与染色法对旋毛虫成囊前幼虫的检查效果比较
樊 航,闫钰鑫,蔡 欢,张 澎,娄源航,王国
1. 河南大学医学院,河南 开封 475004; 2. 河南大学民生学院,河南 开封 475004
镜检法与染色法对旋毛虫成囊前幼虫的检查效果比较

1. 河南大学医学院,河南 开封 475004; 2. 河南大学民生学院,河南 开封 475004
摘要:〔目的〕 观察镜检法与染色法对旋毛虫成囊前幼虫的检查效果。〔方法〕 30只雌性昆明小鼠随机分为6组,每组5只。1组:每鼠经口感染20条旋毛虫肌幼虫,感染13 d剖杀;2组:每鼠经口感染20条旋毛虫肌幼虫,感染14 d剖杀;3组:每鼠经口感染20条旋毛虫肌幼虫,感染18 d剖杀;4组:每鼠经口感染100条旋毛虫肌幼虫,感染13 d剖杀;5组:每鼠经口感染100条旋毛虫肌幼虫,感染14 d剖杀;6组:每鼠经口感染100条旋毛虫肌幼虫,感染18 d剖杀。镜检法、染色法检查膈肌、腹肌中的幼虫。〔结果〕 镜检法检查:1组、2组、4组、5组均未检出幼虫;3组膈肌、腹肌幼虫检出率分别为60%、40%;6组膈肌、腹肌幼虫检出率均为100%。染色法检查:1组未检出幼虫;2组、3组、4组、5组、6组小鼠膈肌幼虫检出率分别为60%、100%、80%、 100%、100%; 腹肌检出率分别为40%、100%、80%、 80%、100%。3组染色法膈肌幼虫每克虫荷均数高于腹肌(膈与腹染色q3=3.42,P<0.05);6组染色法膈肌幼虫每克虫荷均数显著高于腹肌(膈与腹染色q6=7.63,P< 0.01);3组、6组膈肌幼虫每克虫荷均数,染色法均显著高于镜检法(膈镜检与染色q3=5.24,q6=8.90,P<0.01);6组腹肌幼虫每克虫荷均数,染色法高于镜检法(腹镜检与染色q6=4.17,P<0.05)。〔结论〕 旋毛虫感染早期的成囊前幼虫病原学检查结果,与感染数量、检查方法和取材部位均有关。 感染较重的宿主,其寄生幼虫在肌细胞中出现时间,早于感染较轻的宿主;染色法优于镜检法;膈肌检出率高于腹肌。
关键词:旋毛虫;成囊前期幼虫; 镜检法;染色法;检查
旋毛形线虫(Trichinella spiralis)是旋毛虫病(Trichinellosis)的病原体,简称旋毛虫,可寄生于人与多种哺乳动物体内。成虫和幼虫寄生在同一宿主,成虫主要寄生在宿主的十二指肠和空肠上段,幼虫寄生在横纹肌细胞内,形成具有感染性的幼虫囊包[1]。任何年龄、性别、职业的人群均易受染[2],这种危害严重的人兽共患疾病主要因宿主食入含有活旋毛虫幼虫的肉类而感染。文献[3]报道, 旋毛虫感染早期的未成囊幼虫对新宿主已具有感染性。镜检法是旋毛虫病原学检查常用方法[4],对成囊幼虫的检出效果较好,但对旋毛虫感染早期的成囊前幼虫检出效果有待探讨。本实验采用镜检法和染色法,对旋毛虫感染早期的成囊前幼虫进行检查,并对病原学检查结果进行了比较,为旋毛虫病的预防和检测提供了实验依据。
1材料与方法
1.1旋毛虫虫种及肌幼虫收集
旋毛虫虫种为本实验室引自河南省疾病预防控制中心,用小白鼠传代保种的旋毛虫(Trichinella spiralis),实验前以肌幼虫转种小白鼠备用。每鼠经口感染200条旋毛虫肌幼虫,将感染35 d的小鼠引颈处死,去皮毛、头、爪、内脏,剪碎,加入人工消化液(胃蛋白酶1 g,盐酸1 mL,蒸馏水100 mL),置于恒温磁力加热搅拌器上37 ℃搅拌2 h,待肌肉被完全消化后过滤,自然沉淀,无菌生理盐水漂洗3~4次,收集纯净的肌幼虫。
1.2实验分组与动物感染
日龄35 d雌性昆明小鼠,体质量18~22 g,购自郑州大学实验动物中心。30只小鼠被随机分为6组,每组5只。1组:每鼠经口感染20条旋毛虫肌幼虫,感染13 d剖杀;2组:每鼠经口感染20条旋毛虫肌幼虫,感染14 d剖杀;3组:每鼠经口感染20条旋毛虫肌幼虫,感染18 d剖杀;4组:每鼠经口感染100条旋毛虫肌幼虫,感染13 d剖杀;5组:每鼠经口感染100条旋毛虫肌幼虫,感染14 d剖杀;6组:每鼠经口感染100条旋毛虫肌幼虫,感染18 d剖杀。
1.3标本采集
小鼠引颈处死。用生理盐水清洗阳性鼠肉, 将血水冲洗干净,放入4 ℃冰箱2 h,冷却。取完整膈肌和部分腹肌(10 mm×10 mm),分别标号后,置于电子天平上称重,记录。然后将膈肌和腹肌分别剪开,膈肌剪成2~4小块,腹肌剪成4~6小块即可。将剪成小块的膈肌和腹肌,置于2张载玻片之间, 挤压后两端用线扎紧,制成制片,备检。
1.4成囊前肌幼虫检查
同一标本制成的制片首先用镜检法检查并计数,然后通过染色法将制片染色,对染色后的标本再进行镜检并计数。
1.4.1镜检法将制片置于低倍镜(100)下,按照从上向下,从左向右的顺序镜检全片并计数。计算每克膈肌虫荷和每克腹肌虫荷。
1.4.2染色法醋酸明矾卡红染色。固定液、染色液的配制同文献[5]。
1.4.3实验过程固定:制片置于固定液中24 h,解线后再固定1 h,流水冲洗5 min,间隔5 min,蒸馏水冲洗5 min。染色与分色:固定后的制片置于染色液中10 h;取出后蒸馏水冲洗至标本不脱色为止(约5 min)。体积分数2%盐酸酒精分色液中分色2~10 min(视分色具体情况而定)。脱水、透明与封片:分色后的制片依次放入体积分数50%、70%、80%、95%、体积分数100%乙醇中脱水,各30 min,然后在100%乙醇中再脱水一次,30 min。无水乙醇与二甲苯( 比例1∶1) 混合液中透明30 min,纯二甲苯30 s。在载玻片上滴2滴中性树胶,将制片放入,加盖玻片,平置标本盒内,室温阴干。
将染色后的制片置于高倍镜(400)下,按照从上向下,从左向右的顺序镜检并计数。计算每克膈肌虫荷和每克腹肌虫荷。
1.5统计学方法
采用SPSS 17.0 统计分析软件进行数据处理和统计分析,采用单因素方差分析,检验水准α=0.05。
2结果
2.1镜检法镜检结果
小鼠感染后,1组、2组、4组、5组小鼠膈肌、腹肌压片镜检,均未检出幼虫,3组膈肌、腹肌检出率分别为60%、40%,膈肌与腹肌每克虫荷均数差异无显著性(膈与腹镜检q3=0.87,P>0.05);6组膈肌、腹肌检出率均为100%,二者每克虫荷均数差异无显著性(膈与腹镜检q6=2.75,P>0.05)。见表1。旋毛虫感染18 d未染色标本,见图1。
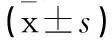
表1 感染旋毛虫13、14、18 d各组小鼠检查结果

图1 旋毛虫感染未染色标本A. 小鼠膈肌感染18 d(400);B.小鼠膈肌感染18 d(100)
2.2染色法镜检结果
1组未检出幼虫;2组膈肌、腹肌检出率分别为60%、40%,二者每克虫荷均数差异无显著性(膈与腹染色q2=0.18,P>0.05);3组膈肌、腹肌检出率均为100%,二者每克虫荷均数差异有显著性(膈与腹染色q3=3.42,P<0.05);4组膈肌、腹肌检出率均为80%,二者每克虫荷均数差异无显著性(膈与腹染色q4=0.23,P>0.05);5组膈肌、腹肌检出率分别为100%、80%,二者每克虫荷均数差异无显著性(膈与腹染色q5=0.81,P>0.05);6组膈肌、腹肌检出率均为100%,二者每克虫荷均数差异有非常显著性(膈与腹染色q6=7.63,P< 0.01)。见表1。旋毛虫感染13 d、14 d、18 d染色标本,见图2。

图2 旋毛虫感染染色标本A.小鼠腹肌感染13 d(100);B.小鼠腹肌感染13 d(400)C.小鼠腹肌感染14 d(100);D.小鼠腹肌感染14 d(400)E.小鼠膈肌感染18 d(100);F.小鼠膈肌感染18 d(400)
2.3镜检法与染色法结果比较
镜检与染色两种方法,3组膈肌每克虫荷均数差异有非常显著性(膈肌镜检与染色q3=5.24,P<0.01),腹肌每克虫荷均数差异无显著性(腹镜检与染色q3=2.32,P>0.05); 6组膈肌每克虫荷均数差异有非常显著性(膈肌镜检与染色q6=8.90,P<0.01),腹肌每克虫荷均数差异有显著性(腹肌镜检与染色q6=4.17,P<0.05)。见表1。
3讨论
本文实验结果显示,镜检法小鼠感染13~14d 的4个组(1组、2组、4组、5组)均未检到虫体。结合检查时镜下观察情况分析,原因可能为,旋毛虫感染13~14 d,虫体太小,无成囊结构,特征不典型,且与肌纤维没有明显区别, 低倍镜(100)下,难以将幼虫与周围组织进行明确辨识。高倍镜(400)下,虽然放大倍数增大,但因肌肉中含有水分,清晰度反而不及低倍镜(100),也不能正确清晰辨认。以上结果说明,在旋毛虫感染早期(13 d、14 d),镜检法极易漏检。染色法①组未检到虫体,2组、4组、5组均检到虫体。结合检查时镜下观察情况分析,旋毛虫感染13~14d,染色标本,低倍镜(100)下,幼虫入侵的肌纤维染色后色泽一般较深,与相邻肌纤维有区别,但内部的虫体形态不明显,不易明确判断是否有幼虫存在,这时,可将放大倍数增大,高倍镜(10×40)下,幼虫轮廓清晰可见,非常容易判断是否有幼虫存在,不易漏检。需要注意,观察此类旋毛虫感染早期的染色标本,低倍镜(100)寻找,发现可疑点,高倍镜(400)鉴别。因为,在标本制作过程中,由于染色、分色等诸多原因,正常肌纤维也会出现有些色泽较浅,有些色泽较深,与相邻肌纤维难以区别,若仅在低倍镜(100)下根据色泽特点进行判断,易造成误判。
小鼠感染18 d 的两个组(3组、6组),镜检与染色两种方法,膈肌与腹肌均检出了幼虫。结合检查时镜下观察情况分析,旋毛虫感染18 d,镜检法观察未染色标本, 低倍镜(100)下,幼虫所在部位色泽较周围组织浅、亮,已能看到虫体大体轮廓,增大放大倍数(400),幼虫与周围组织可进行明确辨识。旋毛虫感染18 d,染色法观察染色标本,低倍镜(100)下,有的幼虫的特征已较明显,高倍镜(400)下,虫体形态非常清晰,极易辨别。3组膈肌虫荷均数,染色法显著高于镜检法;6组膈肌虫荷均数,染色法显著高于镜检法;腹肌虫荷均数,染色法高于镜检法。染色法高于镜检法的原因,可能是幼虫进入肌细胞的时间有先后,其形态发育存在差别,虫体较大的幼虫染色法和镜检法均易检出,而虫体较小的幼虫镜检法易漏检。
关于取材部位。2组、4组、5组膈肌、腹肌染色法虽然均检到虫体,但因感染早期,虫体数量少,统计学处理,膈肌、腹肌虫荷均数无差异。3组和6组,虽然感染数量不同,但感染时间同为18 d。镜检法:二组膈肌、腹肌的虫荷均数均无差异;染色法:3组膈肌虫荷均数高于腹肌虫荷均数,6组膈肌虫荷均数显著高于腹肌虫荷均数。
对以上结果比较发现,旋毛虫感染早期的病原学检查结果,与感染数量、检查方法和取材部位均有关。感染较重的宿主,其寄生幼虫在肌细胞中出现时间,早于感染较轻的宿主。 镜检法不适合作为旋毛虫感染早期的病原学检查方法,而染色法适合作为旋毛虫感染早期的病原学检查方法。取材部位对检查结果有很大影响,从膈肌取材,检出肌幼虫的阳性率高于腹肌[6]。
参考文献:
[1] 李雍龙. 人体寄生虫学[M]. 6版. 北京:人民卫生出版社,2006:188-191.
[2] 郑德福,肖宁,冯萍,等. 1964-2011年中国大陆人体旋毛虫病流行分析[J]. 寄生虫病与感染性疾病,2011,9(3):119-125.
[3] 周吉礼,胡雪梅,刘春会,等. 成囊前旋毛虫幼虫对宿主的感染力与强度[J]. 中国人兽共患病杂志,2001,17(1): 71- 72.
[4] 崔晶,王中全. 旋毛虫检疫技术及肉类的安全加工方法[J]. 中国人兽共患病学报,2006,22(9):871-875.
[5] 杨丁,皮本伟,牛利娜,等. 一种旋毛虫肌幼虫囊包标本的单染制作方法[J]. 中国寄生虫学与寄生虫病杂志,2012,30(6):498-499.
[6] 王国英. 旋毛虫肌幼虫在感染小鼠体内的分布[J]. 中国血吸虫病防治杂志,2008,20(3):212-213.
[责任编辑时 红]
Comparison of trichinelloscopy and Staining method for the inspection results of Trichinella spiralis pre-encapsulated larvae
1. Medical College, Henan University, Henan Kaifeng 475004, China; 2. Minsheng College, Henan University, Henan Kaifeng 475004, China
Abstract:〔Objective〕To observe the inspection results of trichinelloscopy and staining method for on Trichinella spiralis pre-encapsulated larvae (PEL). 〔Methods〕Thirty male Kunming mice were randomly divided into six test groups (with 5 mice per group). Test group No.1: each mouse was inoculated orally with 20 muscle larvae of Trichinella spiralis and was killed after being infected for 13 days. Test group No.2: each mouse was inoculated orally with 20 muscle larvae of Trichinella spiralis and was killed after being infected for 14 days. Test group No.3: each mouse was inoculated orally with 20 muscle larvae of Trichinella spiralis and was killed after being infected for 18 days. Test group No.4: each mouse was inoculated orally with 100 muscle larvae of Trichinella spiralis and was killed after being infected for 13 days. Test group No.5: each mouse was inoculated orally with 100 muscle larvae of Trichinella spiralis and was killed after being infected for 14 days. Test group No.6: each mouse was inoculated orally with 100 muscle larvae of Trichinella spiralis and was killed after being infected for 18 days. Trichinelloscopy and Staining method were used to inspect the Trichinella spiralis pre-encapsulated larvae in the diaphragm and abdominal muscle. 〔Results〕Results got through Trichinelloscopy: Test group No.1, 2, 4, 5 were not found any PEL; for test group No.3 the PEL rates in the diaphragm and abdominal muscle were 60% and 40% respectively; and the PEL rates both in the diaphragm and abdominal muscle for test group No.6 were 100%. Results got through staining method: Test group No.1were not found any PEL; as for test group No.2, 3, 4, 5, 6, the PEL rates in the diaphragm were 60%, 100%, 80%,100% and 100% respectively and the PEL rates in the abdominal muscle were 40%, 100%, 80%, 80% and 100% respectively.As for test group No.3, the mean worm burden per gram for PEL in the diaphragm was higher than the number of PEL in the abdominal muscle (q3 = 3.42, P<0.05). And for test group No.6, the mean worm burden per gram for PEL in the diaphragm was obviously higher than the number of PEL in the abdominal muscle (q6 = 7.63, P<0.01). In terms of the mean worm burden of PEL in the diaphragm in test group No.3 and No.6, staining method was much more efficient than Trichinelloscopy (q3=5.24, q6=8.90, P<0.01). Besides, as for the the mean worm burden of PEL in the abdominal muscle in test group No.6, staining method was still obvious than Trichinelloscopy (q6 = 4.17, P<0.05).〔Conclusion〕The inspecting results of Trichinella spiralis pre-encapsulated larvae (PEL) is related to the infected degree, inspecting method and also body parts being inspected. For the heavily infected host, the PEL appear earlier than in the lightly infected host. What's more, staining method is more efficient than Trichinelloscopy and inspecting the diaphragm is more efficient than inspectining the abdominal muscle.
Key words:trichinella spiralis; pre-encapsulated larvae (PEL); trichinelloscopy; staining method; inspection
中图分类号:R383.15
文献标志码:A
作者简介:樊航(1994-),男,河南长垣,本科在读,从事基础医学的研究和学习。 通信作者:王国英(1962-),女,山西运城人,高级实验师,从事寄生虫免疫及寄生虫流行病学的教学与科研工作。
基金项目:2014年度河南大学大学生创新创业训练计划项目(14NA020);河南大学教学改革研究项目(2015133)
收稿日期:2015-10-30
文章编号:1672-7606(2016)01-0032-04

