氯胺酮通过NO通路介导的抗伤害作用与抑制脊髓P物质受体研究
张 博,王 宏,张涤非
氯胺酮通过NO通路介导的抗伤害作用与抑制脊髓P物质受体研究
张博1,王宏2,张涤非1
[摘要]目的:观察氯胺酮(Ket)通过一氧化氮(NO)通路介导的抗伤害作用与脊髓P物质(SP)受体的关系及可能机制。方法:通过行为学实验、免疫组织化学技术和分光光度法,记录鞘内注射SP和/或腹腔注射Ket,热板法实验观察小鼠舔后足反应的潜伏期、甲醛实验Ⅰ相和Ⅱ相小鼠舔足时间、脊髓Fos免疫样(FLI)阳性神经元数量和一氧化氮合酶(NOS)活性及NO产量的变化。结果:热板法实验: Ket 20 mg/kg和30 mg/kg腹腔注射可使小鼠热板法痛阈增加(P<0.05~P<0.01),SP 0.5 ng鞘内注射后15 min和20 min均可减少Ket小鼠热板法痛阈(P<0.01和P<0.05)。甲醛实验: Ket 30 mg/kg腹腔注射可减少小鼠舔足时间(P<0.01),鞘内注射SP 0.5 ng可增加Ket小鼠2个时相舔足时间(P<0.01和P<0.05)。对照组小鼠两侧脊髓背角对称分布少量FLI阳性神经元,甲醛注射侧脊髓背角FLI阳性神经元明显高于对照组(P<0.01),腹腔注射Ket显著减少注射侧脊髓背角FLI阳性神经元的数量(P<0.01),而鞘内注射SP可明显对抗Ket对甲醛注射侧脊髓背角FLI阳性神经元的抑制(P<0.01)。Ket均可抑制脊髓NOS活性和NO水平(P<0.05),鞘内注射SP可显著对抗Ket对NOS活性和NO的抑制(P<0.05)。结论:Ket抗伤害作用与抑制脊髓SP受体有关,这可能通过NO通路介导。
[关键词]氯胺酮;抗伤害作用; P物质受体;一氧化氮
[作者单位]1.安徽省太和县人民医院麻醉科,236600; 2.蚌埠医学院第一附属医院麻醉科,233004
氯胺酮(ketamine,Ket)是唯一具有显著镇痛作用的静脉麻醉药,近年来人们对Ket抗伤害作用机制进行了许多研究,发现涉及多种受体、神经递质、离子通道[1-3],但其确切机制尚未完全明了。许多实验[4-6]已证实Ket抗伤害作用的中枢主要在脊髓。初级感觉传入神经中较细的C类和Aδ类纤维被认为与伤害性信息的传递有关,在背根神经中20%的Aδ和50%的C类细胞中含有P物质(substance P,SP)。现已肯定SP受体(substance P receptor,SPR)介导脊髓背角神经元伤害性信息的传递。以前的研究[7-8]已证实,鞘内注射SPR内源性激动剂SP能增强脊髓背角神经元的伤害性反应,诱发和增强伤害性行为,而SPR拮抗剂sendide能抑制鞘内注射SP诱发的伤害性行为[9]。
OKAMOTO等[10]通过全细胞膜片钳技术发现,Ket能抑制SP和SPR结合所引起的氯离子电流,同时发现Ket能抑制SP和SPR的结合,提示Ket的抗伤害作用可能与SPR有着密切联系。SONG等[11]用微电泳技术发现,SPR拮抗剂spantide能增强Ket抑制脊髓背角神经元对刺激的反应,提示SPR参与了Ket作用的脊髓机制。但这些实验都是在离体情况下进行的,由于离体实验缺乏完整的神经体液调节,忽略了神经元之间的相互作用、神经元分离过程中膜蛋白及受体的损伤而导致受体亲和力下降等因素,因此离体实验并不能完全反映在离体情况下药物与受体的关系。本实验首先通过行为学实验,观察鞘内注射不同剂量的SP对Ket抗伤害作用的影响,然后采用c-fos免疫组织化学技术,进一步验证脊髓SPR和Ket抗伤害作用的关系,最后通过分光光度法,探讨SPR参与Ket抗伤害作用与脊髓一氧化氮合酶(NOS)活性和一氧化氮(NO)产量的关系。
1 材料与方法
1.1实验动物和试剂昆明种小鼠192只,雌雄各96只,体质量为20~25 g,由蚌埠医学院实验动物中心提供。Ket为江苏恒瑞医药股份有限公司生产(批号H32022820),SP由Sigma公司提供,上述试剂用0.9%氯化钠注射液(NS)稀释成所需浓度,兔抗c-fos抗体购于Santa Cruz公司,ABC试剂盒购自北京中衫公司。考马斯亮兰蛋白试剂盒、NO试剂盒和NOS试剂盒购自南京建成生物工程研究所。1.2行为学实验方法(1)热板法:雌性小鼠置于(55.0±0.5)℃金属板上,以小鼠舔后足反应的潜伏期热板法痛阈(pain threshold in the hot-plate test,HPPT)作为痛阈指标。实验前筛选动物,将反应潜伏期<5 s或>30 s的动物剔除,为防足部烫伤,截止时间设为60 s。测基础痛阈间隔5 min,测2次取其平均值。(2)甲醛法:实验分为2个时相,0~10 min出现的反应为Ⅰ相(早期相),>10~60 min出现的反应为Ⅱ相(迟发相)。用微量注射器向每只小鼠足底皮下注射2%甲醛溶液20 μL,分别记录Ⅰ相和Ⅱ相小鼠舔被注射足累积时间(舔足时间)作为疼痛指标。
1.3分组动物均用分层随机区组设计分组,使各组平均体质量和性别比例基本相同。昆明小鼠120只,热板实验选用雄性小鼠,甲醛实验雌雄不限,随机分为12组,各10只: NS腹腔注射组,Ket 10、20、30组,NS鞘内注射组,SP 0.125、0.25、0.5组,Ket 30 + NS鞘内注射组,Ket 30 + SP 0.125、0.25、0.5组。NS腹腔注射组和Ket组分别腹腔注射NS或不同剂量的Ket; NS鞘内注射组和SP组分别鞘内注射NS或不同剂量的SP; Ket + NS鞘内注射组和Ket + SP组首先腹腔注射Ket 30 mg/kg,10 min后鞘内注射NS或不同剂量的SP。观察各组小鼠用药前后HPPT的变化,NS鞘内注射组和SP组鞘内注射后1 min,其余各组均在腹腔注射Ket后15 min开始测HPPT,或足底注射2%甲醛开始测Ⅰ相和Ⅱ相舔足时间。
1.4 Fos免疫组织化学技术昆明小鼠40只,分为5组,各8只: NS腹腔注射+ NS鞘内注射组,NS腹腔注射+ NS鞘内注射+ F组,Ket + NS鞘内注射+ F组,NS腹腔注射+ SP + F组,Ket + SP + F组。各组小鼠均首先腹腔注射NS或Ket 30 mg/kg,10 min后鞘内注射NS或SP,15 min时除NS腹腔注射+ NS鞘内注射组外均注射甲醛溶液。甲醛刺激后1 h进行Fos免疫组织化学。各组小鼠经实验处理后,腹腔注射戊巴比妥钠(60 mg/kg)麻醉,处死后取腰膨大段脊髓,以SP法作c-fos免疫组织化学反应。
细胞计数Fos免疫样(FLI)阳性神经元表现为细胞核呈棕褐色,细胞质不着色。每张切片根据Rexed分层法将脊髓灰质10层分为4个区: (1)浅层(Ⅰ~Ⅱ层) ; (2)固有核(Ⅲ~Ⅳ层) ; (3)背角颈部(Ⅴ~Ⅵ层) ; (4)腹角(Ⅶ~Ⅹ层),分别计数每个区内FLI阳性神经元数量。每只小鼠脊髓切片随机抽取10张,在镜下计数每张切片各区FLI阳性神经元数量,并取其平均值作为单个脊髓各区FLI阳性神经元的数量。
1.5分光光度法昆明小鼠32只,分为4组,各8 只: NS腹腔注射+ NS鞘内注射组,Ket + NS鞘内注射组,NS腹腔注射+ SP组,Ket + SP组。腹腔注射NS或Ket 30 mg/kg,10 min后鞘内注射NS或SP。然后小鼠静置30 min,断头取腰膨大段脊髓。准确称取所取脊髓组织的质量,按质量体积比加NS制备成10%的组织匀浆,1 000 r/min,离心10 min,然后取组织匀浆上清液,再用NS按1∶9稀释成1%组织匀浆。然后按照试剂盒说明测定脊髓组织的蛋白含量、NOS活性和NO产量。
1.6统计学方法采用方差分析和q检验。
2 结果
2.1热板实验NS、Ket 10 mg/kg和20 mg/kg腹腔注射对小鼠HPPT均无明显影响(P>0.05)。与NS组比较,Ket 20 mg/kg和30 mg/kg腹腔注射均使HPPT增大(P<0.05和P<0.01)。与基础HPPT比较,Ket 30 mg/kg腹腔注射后15 min时 HPPT增加53% (P<0.05) (见表1)。SP 0.125、0.25和0.5 ng鞘内注射对小鼠行为和HPPT无明显影响(P>0.05) (见表2)。NS和SP 0.125 ng鞘内注射后15 min Ket小鼠的HPPT均较基础HPPT升高(P<0.05)。与Ket + NS组HPPT相比较,Ket + SP 0.5组HPPT在Ket腹腔注射后15 min和20 min时分别减少30.0% (P<0.01)和26.13% (P<0.05) (见表3)。
2.2甲醛实验Ket 10 mg/kg和20 mg/kg腹腔注射对小鼠Ⅰ相舔足时间均无明显影响(P>0.05),Ket 30 mg/kg腹腔注射明显减少小鼠Ⅰ相舔足时间(P<0.01)。Ket 30 mg/kg和20 mg/kg腹腔注射小鼠Ⅱ相舔足时间均减少(P<0.05) (见表4)。SP 0.125、0.25和0.5 ng鞘内注射对小鼠行为及2个时相舔足时间均无明显影响(P>0.05) (见表5)。SP 0.125 ng和0.25 ng鞘内注射对Ket小鼠2个时相舔足时间均无明显影响(P>0.05),SP 0.5 ng鞘内注射均可增加Ket小鼠2个时相舔足时间(P<0.01和P<0.05) (见表6)。
表1 不同剂量Ket对小鼠HPPT的影响(ni=10;±s)
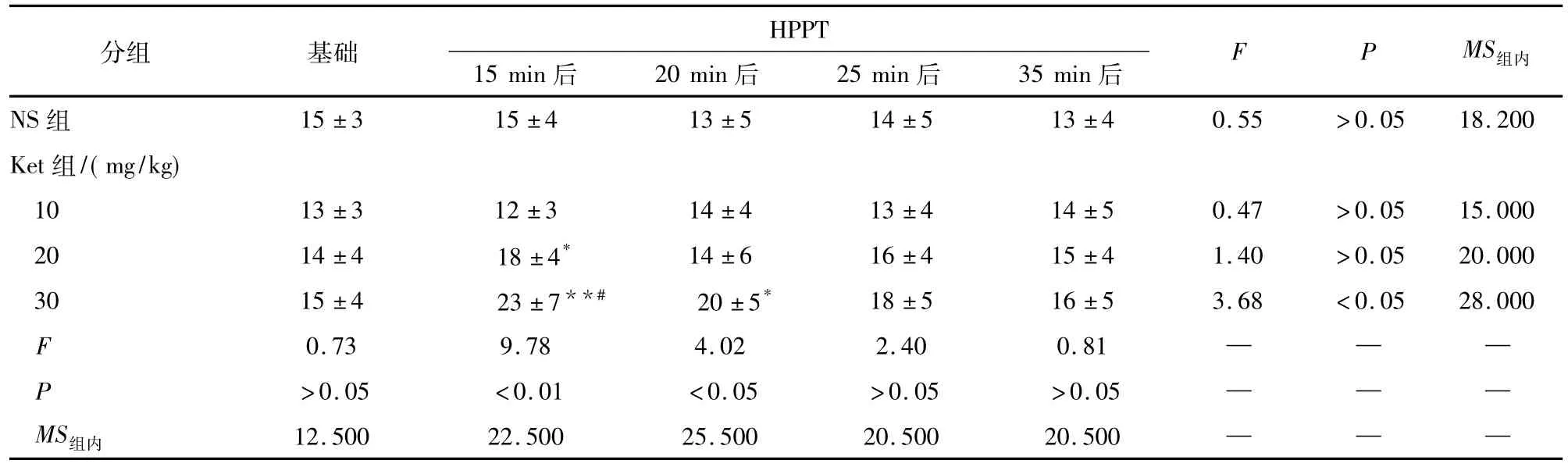
表1 不同剂量Ket对小鼠HPPT的影响(ni=10;±s)
q检验:与NS比较* P<0.05,**P<0.01;与基础HPPT比较# P<0.05
分组 基础 HPPT 15 min后 20 min后 25 min后 35 min后F P MS组内NS组15±3 15±4 13±5 14±5 13±4 0.55 >0.05 18.200 Ket组/(mg/kg) 10 13±3 12±3 14±4 13±4 14±5 0.47 >0.05 15.000 20 14±4 18±4* 14±6 16±4 15±4 1.40 >0.05 20.000 30 15±4 23±7**# 20±5* 18±5 16±5 3.68 <0.05 28.000 F 0.73 9.78 4.02 2.40 0.81 — — —P >0.05 <0.01 <0.05 >0.05 >0.05 — — —MS组内 12.500 22.500 25.500 20.500 20.500— —
表2 不同剂量SP对小鼠HPPT的影响(ni= 10;±s)
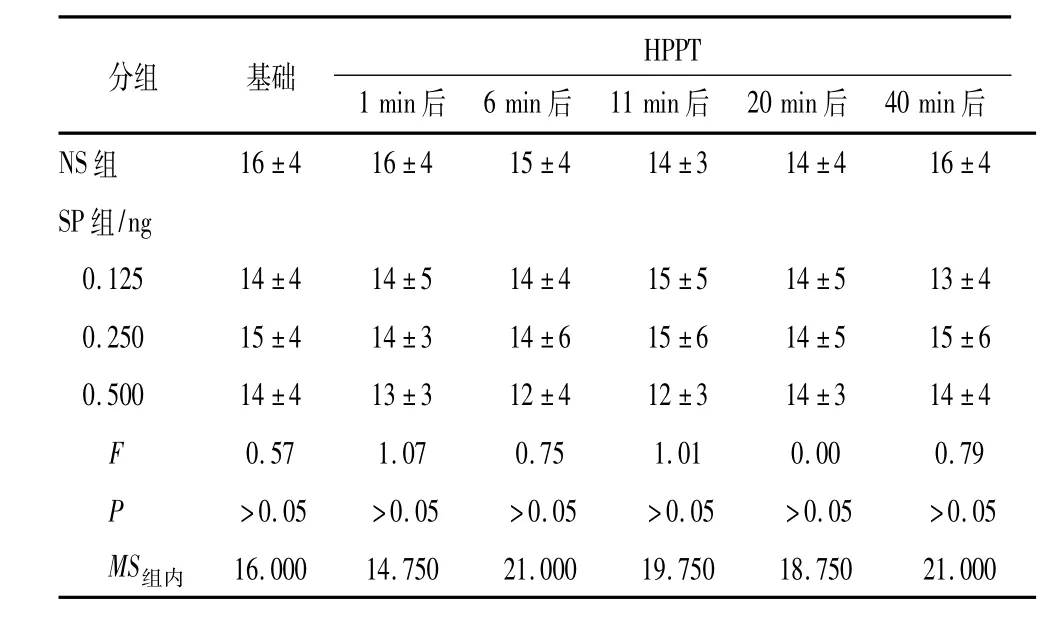
表2 不同剂量SP对小鼠HPPT的影响(ni= 10;±s)
分组 基础 HPPT 1 min后 6 min后 11 min后 20 min后 40 min后NS组16±4 16±4 15±4 14±3 14±4 16±4 SP组/ng 0.125 14±4 14±5 14±4 15±5 14±5 13±4 0.250 15±4 14±3 14±6 15±6 14±5 15±6 0.500 14±4 13±3 12±4 12±3 14±3 14±4 F 0.57 1.07 0.75 1.01 0.00 0.79 P >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 MS组内16.000 14.750 21.000 19.750 18.750 21.000
表3 不同剂量SP对Ket小鼠HPPT的影响(ni=10;±s)
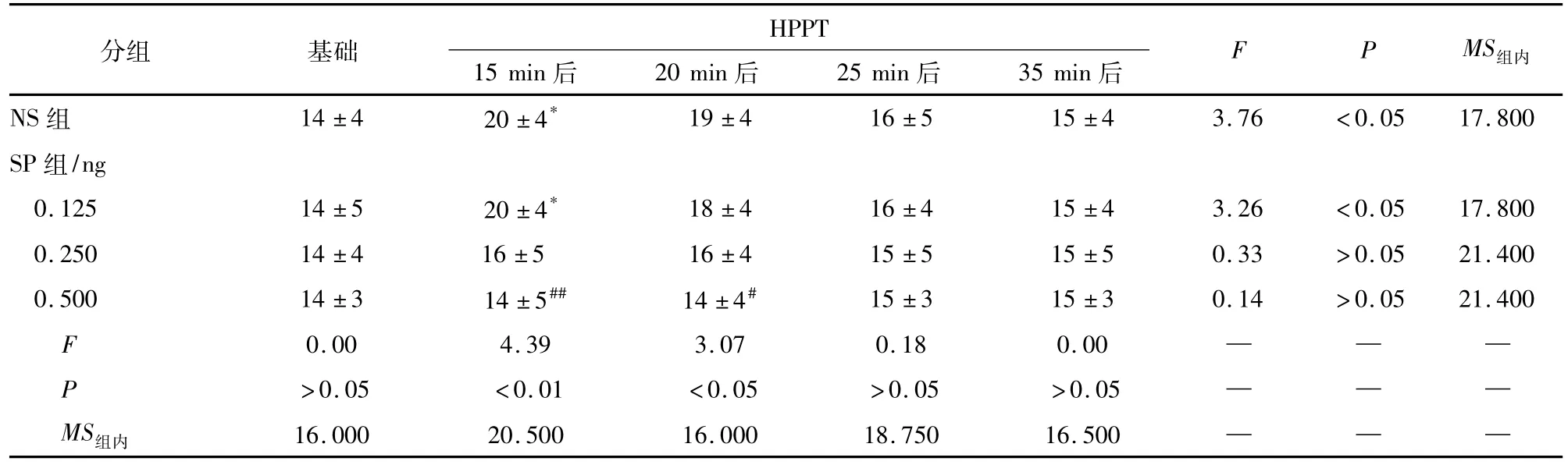
表3 不同剂量SP对Ket小鼠HPPT的影响(ni=10;±s)
q检验:与NS比较#P<0.05,## P<0.01;与基础HPPT比较* P<0.05
分组 基础 HPPT 15 min后 20 min后 25 min后 35 min后F P MS组内NS组 14±4 20±4*19±4 16±5 15±4 3.76 <0.05 17.800 SP组/ng 0.125 14±5 20±4* 18±4 16±4 15±4 3.26 <0.05 17.800 0.250 14±4 16±5 16±4 15±5 15±5 0.33 >0.05 21.400 0.500 14±3 14±5## 14±4# 15±3 15±3 0.14 >0.05 21.400 F 0.00 4.39 3.07 0.18 0.00 — — —P >0.05 <0.01 <0.05 >0.05 >0.05 — — —MS组内 16.000 20.500 16.000 18.750 16.500— —
2.3鞘内注射SP对Ket抑制甲醛小鼠脊髓背角Fos阳性神经元表达、NOS活性和NO水平的影响
NS腹腔注射+ NS鞘内注射组小鼠两侧脊髓背角对称分布少量的FLI阳性神经元(见图1)。NS腹腔注射+ NS鞘内注射+ F组与NS腹腔注射+ NS鞘内注射组比较,小鼠注射侧脊髓背角有大量FLI阳性神经元表达(P<0.01),其中大约59% FLI阳性神经元分布在Ⅰ层和Ⅱ层,26% FLI阳性神经元分布在Ⅴ层和Ⅵ层,10% FLI阳性神经元分布在Ⅲ层和Ⅳ层,未注射侧脊髓背角只有少量FLI阳性神经元散在分布(P>0.05)。Ket + NS鞘内注射+ F组与NS腹腔注射+ NS鞘内注射+ F组比较,脊髓背角各层FLI阳性神经元数量均明显减少(P<0.01),但仍多于NS腹腔注射+ NS鞘内注射组(P<0.01)。NS腹腔注射+ SP + F组与NS腹腔注射+ NS鞘内注射+ F组比较,FLI阳性神经元数量和分布相似(P>0.05)。Ket + SP + F组与Ket + NS鞘内注射+ F组相比,脊髓背角各层FLI阳性神经元数量明显增加(P<0.01) (见表7)。
与NS腹腔注射+ NS鞘内注射组比较,Ket + NS鞘内注射组Ket30 mg / kg腹腔注射明显抑制NOS活性(P<0.05)。NS腹腔注射+ SP组SP 0.5 ng鞘内注射对NOS活性和NO水平均无明显影响(P>0.05)。与Ket + NS鞘内注射组比较,Ket + SP组SP 0.5 ng鞘内注射可以激活NOS活性(P<0.05) (见表8)。
表4 不同剂量Ket对小鼠甲醛诱发舔足时间的影响(ni=10;±s)
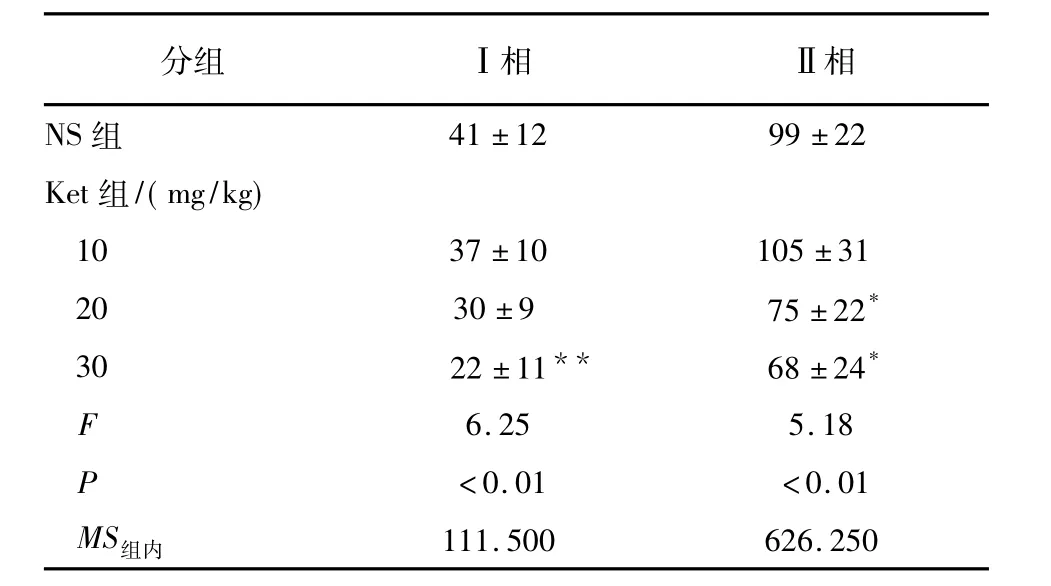
表4 不同剂量Ket对小鼠甲醛诱发舔足时间的影响(ni=10;±s)
q检验:与NS组比较* P<0.05,**P<0.01
分组 Ⅰ相 Ⅱ相NS组41±12 99±22 Ket组/(mg/kg) 10 37±10 105±31 20 30±9 75±22*30 22±11** 68±24*F 6.25 5.18 P <0.01 <0.01 MS组内111.500 626.250
表5 不同剂量SP对小鼠甲醛诱发舔足时间的影响(ni= 10;±s)
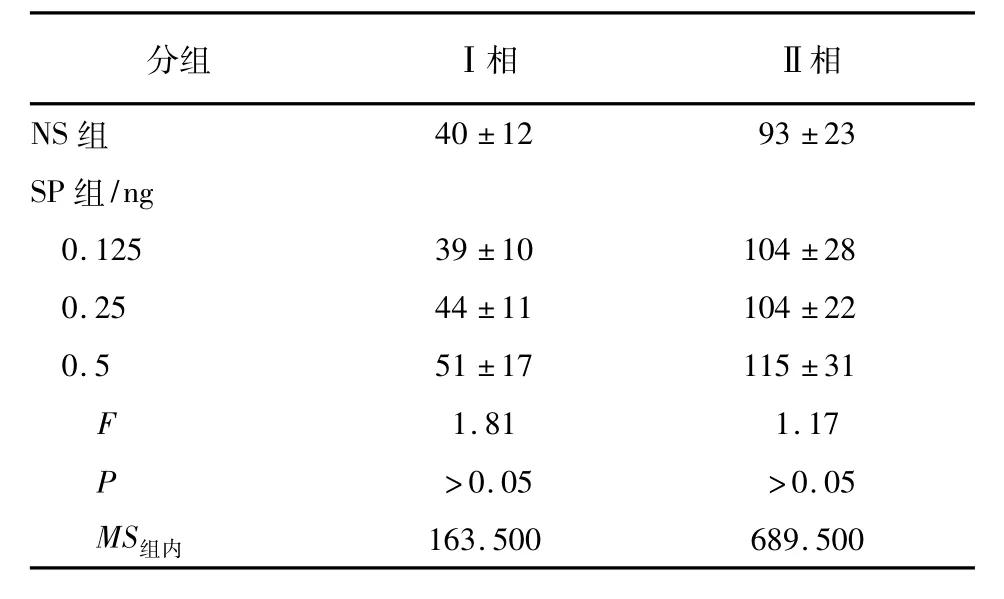
表5 不同剂量SP对小鼠甲醛诱发舔足时间的影响(ni= 10;±s)
分组 Ⅰ相 Ⅱ相NS组40±12 93±23 SP组/ng 0.125 39±10 104±28 0.25 44±11 104±22 0.5 51±17 115±31 F 1.81 1.17 P >0.05 >0.05 MS组内163.500 689.500
表6 不同剂量SP对Ket小鼠甲醛诱发舔足时间的影响(ni=10;±s)

表6 不同剂量SP对Ket小鼠甲醛诱发舔足时间的影响(ni=10;±s)
q检验:与Ket + NS比较* P<0.05,**P<0.01
分组 Ⅰ相 Ⅱ相Ket + NS 21±10 67±24 Ket + SP 0.125 21±9 74±24 Ket + SP 0.25 30±9* 89±20*Ket + SP 0.5 36±13** 97±21**F 5.01 3.67 P <0.01 <0.05 MS组内107.750 498.250
3 讨论
Ket不但具有明显的镇痛作用,而且具有较强的镇静作用,同时较大剂量的Ket还可使动物产生诸如摇头、旋转等异常运动,镇静作用和异常运动均会影响对药物镇痛效应的评价,因此,选择合适的剂量尽量排除这些因素对实验结果的影响就显得尤为重要。
本实验观察到未注射甲醛的小鼠保持安静,脊髓背角只有少量的FLI神经元散在分布在背角各层。注射甲醛的小鼠出现躁动不安,舔、咬注射足,注射足红肿,注射侧脊髓背角出现大量FLI阳性神经元,未注射侧脊髓背角各层仅有少量的FLI神经元散在分布。腹腔注射Ket 30 mg/kg明显减少小鼠在Ⅰ相和Ⅱ相舔足时间,并可明显抑制脊髓背角各层Fos蛋白表达,提示Ket在脊髓水平具有抗伤害作用,并对急性痛和慢性炎性痛均有抑制作用。
SPR介导脊髓背角神经元伤害性信息的传递,SP作为其内源性配体可激动SPR而发挥其效应。在本实验中鞘内注射的SP 0.5 ng对行为、痛阈和Fos蛋白表达均无明显的影响,但可明显减弱Ket对热板和甲醛刺激痛反应的抑制,同时拮抗Ket对甲醛实验小鼠脊髓背角Fos蛋白表达的抑制,提示Ket的抗伤害作用与脊髓SPR有着密切联系。
目前认为Ket抗伤害作用与NO通路有关,离体实验[12]发现,用NOS抑制剂L-NAME能明显增强Ket的麻醉作用,但Ket抗伤害作用主要与脑内NO通路还是脊髓NO通路有关存在着争议。GALLEY等[13]发现Ket可以抑制大鼠脑组织NOS的活性。同时大量实验[14-15]也证实了Ket的抗伤害作用与抑制脊髓NOS神经元的活性有关。有学者[16]发现,腹腔注射L-NAME可以拮抗Ket的抗伤害作用,但鞘内注射L-NAME不能拮抗Ket的抗伤害作用,故认为Ket抗伤害作用与脊髓上而不是脊髓的NO通路有关。不同研究者得出不同甚至矛盾的实验结果,不同的实验技术和条件可能是原因之一。但本实验结果证实,Ket的抗伤害作用与抑制脊髓NOS活性和减少脊髓NO产量有关。其是否与脊髓上NO通路有关,在本实验中尚未涉及。
既然Ket抗伤害作用与NO通路存在着密切的联系,那么SP拮抗Ket抗伤害作用是否通过NO通路发挥作用?孙晓彩等[17]发现鞘内注射SPR激动剂Sar-SP能增加NOS活性和NO生成,但同时使大鼠的痛阈降低。本实验结果显示,单纯鞘内注射对痛阈无影响的SP并不能激活NOS活性和增加NO生成,但却能激活被Ket抑制的NOS活性和增加NO生成,提示SP拮抗Ket的抗伤害作用与NO通路有关。
总之,本实验显示Ket在小鼠热板法实验和甲醛法实验中具有抗伤害作用,鞘内注射SP能够拮抗Ket的抗伤害作用,这种拮抗作用与激活NO通路有关。
表7 鞘内注射SP对Ket抑制甲醛小鼠脊髓背角Fos阳性神经元表达的影响(ni=8;±s)

表7 鞘内注射SP对Ket抑制甲醛小鼠脊髓背角Fos阳性神经元表达的影响(ni=8;±s)
q检验:与NS腹腔注射+ NS鞘内注射+ F比较**P<0.01;与Ket + NS鞘内注射+ F比较##P<0.01
合计NS腹腔注射+ NS鞘内注射 34±11**## 22±8**## 27±8**## 24±4**## 106±25**分组 LamⅠ-Ⅱ LamⅢ-Ⅳ LamⅤ-Ⅵ LamⅦ-Ⅹ## NS腹腔注射+ NS鞘内注射+ F 246±48 52±11 121±34 56±14 475±84 Ket + NS鞘内注射+ F 121±27** 34±12** 61±15** 37±9** 253±53**NS腹腔注射+ SP + F 253±59 67±19 120±34 61±13 501±97 Ket + SP + F 197±40## 57±15## 95±22## 51±10## 440±56##F 41.64 14.40 21.27 16.28 50.07 P <0.01 <0.01 <0.01 <0.01 <0.01 MS组内1 647.000 183.000 617.000 112.400 4 607.000
表8 鞘内注射SP对Ket抑制脊髓NOS活性和NO水平的影响(ni=8;±s)

表8 鞘内注射SP对Ket抑制脊髓NOS活性和NO水平的影响(ni=8;±s)
q检验:与NS腹腔注射+ NS鞘内注射比较* P<0.05;与Ket + NS鞘内注射比较# P<0.05
分组 NOS活性/ (U·mg prot-1) NO水平/ (μmol·gprot-1) NS腹腔注射+ NS鞘内注射0.065 3.225 1.4±0.2 6.8±1.7 Ket + NS鞘内注射 1.1±0.2* 4.9±1.5 NS腹腔注射+ SP 1.5±0.3 8.2±2.6 Ket + SP 1.4±0.3# 6.4±1.0 F 4.62 5.71 P <0.01 <0.01 MS组内
[参考文献]
[1]TAKAHASHI T,KINOSHITA M,SHONO S,et al.The effect of ketamine anesthesia on the immune function of mice with postoperative septicemia[J].Anesth Analg,2010,111(4) : 1051.
[2]NADESON R,TUCKER A,BAJUNAKI E,et al.Potentiation by ketamine of fentanyl antinociception.I.An experimental study in rats showing that ketamine administere by non-spinal routes targets spinal cord antinociceptive systems[J].Br J Anaesth,2002,88(5) : 685.
[3]ZHOU ZS,ZHAO ZQ.Ketamine blockage of both tetrodotoxin (TTX) -sensitive and TTX-resistant sodium channels of rat dorsal root ganglion neurons[J].Brain Res Bull,2000,52(50) : 427.
[4]CASTROMAN PJ,NESS TJ.Ketamine,an N-methyl-D-aspartate receptor antagonist,inhibits the spinal neuronal responses to distension of the rat urinary bladder[J].Anesthesiology,2002,96 (6) : 1410.
[5]HAO JX,SJOLUND BH,WIESENFELD-HALLIN Z.Electrophysiological evidence for an antinociceptive effect of ketamine in the rat spinal cord[J].Acta Anaesthesiol Scand,1998,42(4) : 435.
[6]LAURIDO C,PELISSIER T,PEREZ H,et al.Effect of ketamine on spinal cord nociceptive transmission in normal and monoarthritic rats[J].Neuroreport,2001,12(8) : 1551.
[7]THOMSON LM,TERMAN GW,ZENG J,et al.Decreased substance P and NK1 receptor immumoreactivity and function in the spinal cord dorsal horn of morphine-treated neonatal rats[J].J Pain,2008,9 (1) : 11.
[8]TAKAHASI K,SAKURADA T,SAKURADA S,et al.Behavioural characterization of substance P-induced nociceptive response in mice[J].Neuropharmacology,1987,26(9) : 1289.
[9]KISARA K,TAN-NO K,SAKURADA T.Pharmacological profile of sendide,a tachykinin NK-1 receptor antagonist[J].Nippon Yakurigaku Zasshi,1997,110(6) : 315.
[10]OKAMOTO T,MINSMI K,UEZONO Y,et al.The inhibitory effects of ketamine and pentobarbital on substance p receptors expressed in xenopus oocytes[J].Anesth Analg,2003,97(1) : 104.
[11]SONG XJ,ZHAO ZQ.Interaction between substance P and excitatory amino acid receptors in modulation of nociceptive responses of cat spinal dorsal horn neurons[J].Neurosci Lett,1994,168(1/2) : 49.
[12]TONNER PH,SCHOLZ J,LAMBERZ L,et al.Inhibition of nitric oxide synthase decreases anesthetic requirements of intravenous anesthetics in Xenopus laevis[J].Anesthesiology,1997,87(6) : 1479.
[13]GALLEY HF,WEBSTER NR.Brain nitric oxide synthase activity is decreased by intravenous anesthetics[J].Anesth Analg,1996,83(3) : 591.
[14]颜明,曾因明,张励才,等.大鼠脊髓神经元对福尔马林痛刺激的反应及氯胺酮的调节[J].解剖学通报,2003,26(3) : 209.
[15]袁维秀,张宏,徐娟,等.鞘内注射氯胺酮对慢性神经痛大鼠脊髓背角一氧化氮合酶的影响[J].中华麻醉学杂志,2004,204(5) : 377.
[16]BULUTCU F,DOGRUL A,GMO.The involvement of nitric oxide in the analgesic effects of ketamine[J].Life Sci,2002,71 (7) : 841.
[17]孙晓彩,李文斌,李淑琴,等.鞘内注射神经激肽-1受体激动剂Sar-SP增强大鼠脊髓一氧化氮合酶表达和一氧化氮生成[J].生理学报,2003,55(6) : 677.
(本文编辑刘畅)
Study of the relationship between the antinociception of ketamine mediated by nitric oxide pathway and inhibiting substance P receptors in the spinal cord
ZHANG Bo1,WANG Hong2,ZHANG DI-fei1
(1.Department of Anesthesiology,Taihe People's Hospital,Taihe Anhui 236600; 2.Department of Anesthesiology,The First Affiliated Hospital of Bengbu Medical College,Bengbu Anhui 233004,China)
[Abstract]Objective: To investigate the relationship between the antinociception of ketamine(Ket) mediated by nitric oxide(NO) pathway and inhibiting substance P(SP) receptor in the spinal cord,and its possible mechanism.Methods: The SP of intrathecal injection and/or Ket of intraperitoneal injection were recorded using behavioral experiment,immunohistochemical staining and spectrophotometry.The incubation period of licking foot reaction in mice and licking time in phaseⅠand phaseⅡmice were detected using hot-plate test and using formaldehyde experiment,respectively.The changes of the number of Fos-like immunoreactive(FLI) positive cells,nitric oxide synthase(NOS) activity and NO content were measured.Results: In hot-plate test,the 20 mg/kg and 30 mg/kg of Ket of intraperitoneal injection could increase the pain threshold in the hot-plate test(HPPT) of mice(P<0.05 to P<0.01),the 0.5 ng of SP of intrathecal injection after 5 min and 20 min could decrease the HPPT of ketamine-treated mice(P<0.01 and P<0.05).In formalin test,the 30 mg/kg of Ket of intraperitoneal injection could decrease the licking time of mice(P<0.01),the 0.5 ng of SP of intrathecal injection could increase the licking time of mice in two stages(P<0.05 to P<0.01).In control group,the few FLI positive cells were symmetrical distribution on both sides of spinal dorsal horn,the FLI positive cells on both sides of spinal dorsal horn injected by formalin were significantly higher than that in control group(P<0.01).The FLI positive cells on both sides of spinal dorsal horn injected by intraperitoneal Ket significantly decreased(P<0.01),the 0.5 ng of SP of intrathecal injection could significantly inhibit FLI positive cells on both sides of spinal dorsal horn injected by formalin(P<0.01).Ket could inhibit the copy paste in spinal cord(P<0.05),and the SP of intrathecal injection can counter copy paste caused by Ket(P<0.05).Conclusions: The antinociception of Ket is correlation with the inhibiting of SP receptor,which may be mediated by NO pathway.
[Key words]ketamine; antinociception; substance P receptor; nitric oxide
[通信作者]王宏,博士,副主任医师,副教授.E-mail: wh201071@ 163.com
[作者简介]张博(1975-),男,主治医师.
[收稿日期]2014-11-30
[文章编号]1000-2200(2016) 01-0010-06
[中图法分类号]R 971.2
[文献标志码]A
DOI:10.13898/j.cnki.issn.1000-2200.2016.01.003

