胃肠道间质瘤淋巴管及血管生成机制
王晓茹 ,白光辉(苏州卫生职业技术学院,江苏苏州 5009;苏州市立医院)
胃肠道间质瘤淋巴管及血管生成机制
王晓茹1,白光辉2(1苏州卫生职业技术学院,江苏苏州 215009;2苏州市立医院)
摘要:目的探讨胃肠道间质瘤(GIST)的淋巴管及血管生成机制。方法 收集70例GIST患者的肿瘤组织蜡块,并收集30例胃癌患者的肿瘤组织蜡块,通过免疫组化法观察淋巴管密度及微血管密度(MVD),并观察淋巴生成及血管诱导相关因子血管内皮生长因子(VEGF-C)、果蝇同源异形盒蛋白1(PROX-1)、缺氧诱导因子1α(HIF-1α)、的表达。结果GIST的淋巴管及MVD计数均显著低于胃癌组织(P<0.05);胃间质瘤、小肠间质瘤及胃癌组织中VEGF-C、PROX-1、HIF-1α表达差异均无统计学意义(P均>0.05);HIF-1α低表达组的MVD明显低于高表达组(P<0.05)。结论 间质来源GIST的淋巴管及微血管计数明显少于上皮来源的胃癌,VEGF-C、HIF-1α表达可能与GIST微血管生成相关;VEGF-C可能与GIST淋巴管生成有关。
关键词:胃肠道间质瘤;淋巴管;微血管
胃肠道间质瘤(GIST)起源于胃肠道间叶组织,占胃肠道恶性肿瘤的1%~3%,多发病于中老年患者[1,2]。GITST患者20%~30%属于恶性,且11%~47%首次就诊时已出现转移[3,4]。GIST常见转移方式为血行转移,淋巴结转移仅占小部分,且手术不推荐行淋巴结清扫,因此对于GIST的淋巴结转移机制研究至关重要[5]。淋巴管是淋巴结转移通道,其生成受多种因素控制,但淋巴管特异分子标志物有限[6]。胃癌的主要转移途径为淋巴转移,尽管与GIST组织来源不同,但通过对相同发病部位的胃癌进行对比研究有重要价值[7,8]。淋巴生成及血管诱导相关因子血管内皮生长因子(VEGF-C)、果蝇同源异形盒蛋白1(PROX-1)、缺氧诱导因子1α(HIF-1α)在GIST中淋巴管及血管的生成中发挥作用,但相关文献报道较少。2010年1月~2014年12月,我们对GIST的淋巴管及血管生成机制进行了研究。现将结果报告如下。
1资料与方法
1.1临床资料GIST患者70例,经手术切除并经术后病理组织学及免疫组织学确诊,制备石蜡包块,其中胃间质瘤患者38例,小肠间质瘤患者32例。纳入标准:①病理组织学符合GIST诊断;②免疫组织化学检查CD117为阳性;③原发性GIST患者,无远处转移及腹膜种植,术前未接受甲磺酸伊马替尼辅助化疗。70例患者中男42例、女28例,年龄(58.52±9.06)岁,患者均无淋巴结转移。另选取同期我院胃癌患者术后组织30例份,经术后病理确诊,制备石蜡包块,肿瘤组织均为上皮来源,排除间质瘤、肉瘤等非上皮源性肿瘤。30例胃癌患者中男21例、女9例,年龄(53.28±8.22)岁,淋巴结转移17例。
1.2淋巴管及微血管密度(MVD)计数采用免疫组化法。将选取的石蜡标本进行连续切片,多聚赖氨酸浸泡后37 ℃烤箱烘干备用。脱蜡水化后1 mmol/L/pH8.0柠檬酸溶液中抗原修复,3%H2O2阻断,依次滴加一抗、二抗,PBS缓冲液漂洗,切片染色观察。PBS取代一抗作为阴性对照,已知阳性切片作为阳性对照,保证显色反应的单一性及可比性。参照相关文献,由两位经验丰富病理科医师双盲阅片,MVD计数依据CD31染色结果,于毛细血管最多处评估MVD,先用低倍镜寻找微血管密集区域,然后用高倍镜观察计数,观察3个视野,微血管显色为单个或一簇棕色内皮细胞,大血管、纤维化、炎症坏死的微血管不计数;淋巴管计数依据D2-40染色结果,为裂缝样或多开口薄壁管腔,计数方法同微血管计数[9]。
1.3淋巴生成及血管诱导相关因子VEGF-C、PROX-1、HIF-1α蛋白表达检测将各组织通过石蜡包埋,4 μm连续切片,备用。通过免疫组化超敏法,使用二甲苯脱蜡并水化,双氧水浸泡10 min清除过氧化物酶活性并冲洗,使用EDTA液进行抗原修复,一次添加一抗、二抗,冲洗后37 ℃恒温孵育,DAB染色,镜下观察。相关抗体检测采用分级判定,无阳性细胞及阳性细胞<5%为-,阳性细胞数5%~20%为+,阳性细胞数20%~50%为++,阳性细胞数>50%为+++。-、+、++定为低表达,+++定为高表达。
2结果
2.1淋巴管及MVD计数D2-40染色阳性的淋巴管形状不规则,内皮细胞胞质及胞膜呈棕褐色,在GIST及胃癌组织中均可看到D2-40阳性细胞,在血管及平滑肌细胞中未见D2-40阳性细胞;CD31染色阳性多分布在肿瘤组织内部及边缘的血管内皮细胞,胞质及胞膜呈棕褐色。
GIST组织内少有瘤内淋巴管,胃癌组织瘤内淋巴管难以界定,不予计数。胃间质瘤及小肠间质瘤瘤内淋巴管计数不存在统计学差异(t=0.425,P=0.336);胃间质瘤与小肠内间质瘤瘤旁淋巴管计数不存在统计学差异(t=1.132,P=0.131),两者分别与胃癌组织比较,瘤旁淋巴计数明显低于胃癌组织(P<0.05);胃间质瘤与小肠内间质瘤MVD计数不存在统计学差异(t=0.036,P=0.486),两者分别与胃癌组织比较,MVD计数明显低于胃癌组织(P<0.05)。
表1 GIST和胃癌患者淋巴管及MVD计数
注:与胃间质瘤比较,△P<0.05;与小肠间质瘤比较,○P<0.05。
2.2相关抗体VEGF-C、PROX-1及HIF-1α蛋白在GIST及胃癌组织中表达见表2。胃间质瘤、小肠间质瘤及胃癌组织中各相关抗体表达均无统计学差异(P均>0.05)。
2.3GIST患者淋巴管及MVD计数与相关抗体表达的关系GIST患者组织中VEGF-C与淋巴管密度及MVD计数显著相关(P<0.05),HIF-1α与MVD计数显著相关(P<0.05)。见表3。
3讨论
GIST来源于间质,仅有一半能被放射学或内镜检查所发现,无痛及生长缓慢是其主要特点,但临床中70%的患者可出现临床症状。淋巴管是肿瘤淋巴转移的主要通道,淋巴管由静脉发育生成,受PROX-1调节,淋巴系统出现,静脉内皮细胞分化为淋巴内皮细胞。VEGF-C主要表达于心脏、小肠、卵巢等,在淋巴管丰富的肠系膜中高表达,其可与淋巴内皮细胞受体VEGFR-3结合,刺激淋巴管生长[10,11]。淋巴管密度主要通过检测D2-40表达体现,D2-40是抗podoplanin抗体,可反映淋巴管内皮细胞的唾液糖蛋白抗原决定簇,被认为是淋巴管内皮细胞的特异标志物[12]。

表2 淋巴生成及血管诱导相关因子在GIST
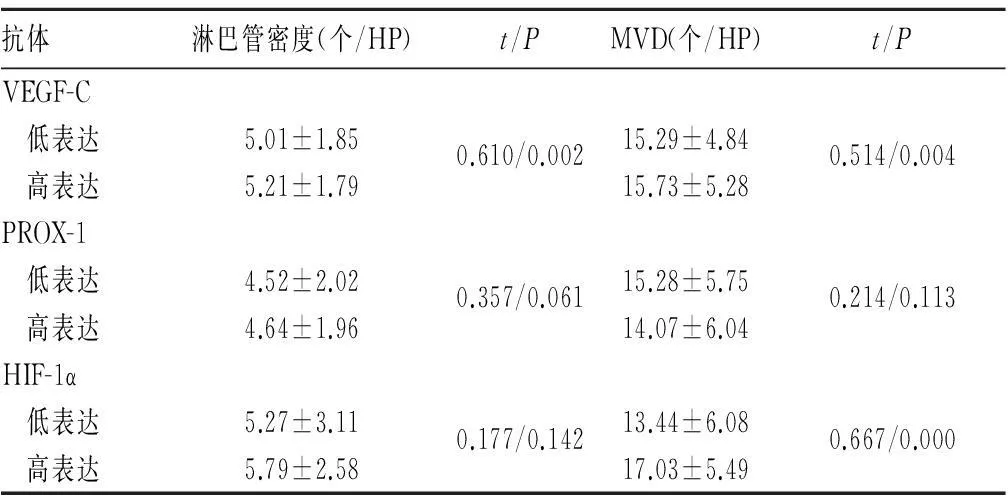
表3 GIST患者淋巴管及MVD计数与相关抗体
本研究发现淋巴管染色特异性较高,血管及平滑肌细胞中未见D2-40阳性细胞表达;胃间质瘤与小肠间质瘤的瘤内淋巴管及瘤旁淋巴管计数均不存在统计学差异,胃癌组织由于瘤内淋巴管无法界定未进行计数,在瘤旁淋巴管比较中,GIST淋巴管计数明显低于胃癌组织,可能是由于胃癌更易发生淋巴转移的原因。在胃间质瘤、小肠间质瘤及胃癌组织中,相关抗体VEGF-C及PROX-1的表达均无统计学差异,两种抗体表达在两类肿瘤中无差别。
CD31广泛分布于内皮细胞上,是内皮依赖性微血管存在标志物[13],可反映MVD。HIF-1α是确定HIF活性的标志,在许多恶性肿瘤组织中高表达,调节血管生成及肿瘤发展,肿瘤的过度生长常伴随缺血缺氧,缺氧则可激活HIF表达[14]。本研究中发现GIST的MVD计数明显低于胃癌组织,这可能与胃癌发生部位特点及GIST生长较缓慢相关。两种间质瘤及胃癌组织间HIF-1α表达不存在统计学差异,两类肿瘤微血管生成对于HIF-1α依赖性并不存在差异。HIF-1α表达与MVD计数显著相关,说明GIST组织内微血管的生成与HIF-1α的表达相关,但具体调控机制还有待进一步研究。
综上所述,GIST与胃癌由于组织来源不同,淋巴管及MVD的分布存在差异,VEGF-C、HIF-1α表达可能与GIST微血管生成相关,GIST淋巴管生成机制可能与VEGF-C有关。
参考文献:
[1] Obuchi T, Sasaki A, Baba S, et al. Single-port laparoscopic and endoscopic cooperative surgery for a gastric gastrointestinal stromal tumor:report of a case[J]. Surg Today, 2015,45(5):641-646.
[2] 郑育聪,李健丁,张瑞平.胃肠道间质瘤的影像学研究进展[J].世界华人消化杂志,2010,18(1):49-53.
[3] 陈立民,姚艳艳,黄艳贞,等.胃肠道间质瘤的诊治:附100例报告[J].中国普通外科杂志,2012,21(10):1266-1269.
[4] Burkill GJ, Badran M, AI-Muderis O, et al. Malignant gastrointestinal stromal tumor:distribution,imaging features and pattern of metastatic spread 1[J]. Radiology, 2003,226(2):527-532.
[5] Pelletier JS, Gill RS, Gazala S, et al. A Systematic Review and Meta-Analysis of Open vs. Laparoscopic Resection of Gastric Gastrointestinal Stromal Tumors[J]. J Clin Med Res, 2015,7(5):289-296.
[6] 常超,王平.淋巴管生成的分子机制与恶性肿瘤的淋巴转移[J].中国癌症杂志,2009,19(5):391-395.
[7] 王耕,杨道华,孙勤,等.胃癌组织若干癌相关基因的表达与淋巴转移的关系[J].中国肿瘤临床与康复,2000,7(2):4-6.
[8] 吴生华,俞继卫,姜波健. VEGF-C及其受体与胃癌淋巴转移关系的研究进展[J]. 中国普外基础与临床杂志,2010,17(8):872-875.
[9] Miettinen M, Sobin LH, Lasota J, et al. Gastrointestinal stromal tumors of the stomach:a clinicopathologic,immunohistochemical,and molecular genetic study of 1765 cases with long-term follow-up[J]. AM J Surg Pathol, 2005,29(1):52.
[10] 李雯君,张四洋,崔泽实. Prox-1与淋巴管新生和肿瘤转移的关系[J].国际病理科学与临床杂志,2010,30(4):332-336.
[11] 王文欢,伍仁毅,孙国瑛,等.VEGF-C和VEGF-D在胃癌组织中的表达与淋巴结转移的关系[J].中南大学学报(医学版),2010,35(4):335-340.
[12] Kahn HJ, Bailey D, Marks A, et al. Monoclonal antibody D2-40,a new marker of lymphatic endothelium,reacts with Kaposi′s sarcoma and a subset of angiosarcomas[J]. Mod Pathol, 2002,15(4):434-440.
[13] Hendrix MJ, Seftor EA, Kirschmann DA, et al. Molecular biology of breast metastasis:Molecular expression of vascular markers by aggressive breast cancer cells[J]. Breast Cancer Res, 2000,2(6):417-422.
[14] 艾晓辉,唐利立,廖国庆,等.缺氧诱导因子1α在胃肠道间质瘤中的表达及其与血管内皮细胞生长因子的相关性[J].中国肿瘤临床与康复,2014,21(4):385-388.
(收稿日期:2015-11-06)
中图分类号:R735
文献标志码:B
文章编号:1002-266X(2016)13-0040-03
doi:10.3969/j.issn.1002-266X.2016.13.015
基金项目:江苏省卫生职业技术教育研究项目(J201102)。

