微反应器法制备硝基丙烷的研究
张汉鹏
摘 要:利用微反应器研究了丙烷的硝化反应,考察了不同反应条件对反应结果的影响。在微反应器实验条件下,目的产物1-硝基丙烷的选择性达到45%,2-硝基丙烷的选择性达到43%,较文献结果有较大的提高,而硝基甲烷和硝基乙烷的选择性明显下降。反应温度更易控制,提高了反应的安全性和可操作性,该方法较传统的制备方法优越。
关键词:微反应器;1-硝基丙烷;2-硝基丙烷
引言
微反应器技术由于其在化学工业中的成功应用而引起越来越广泛地关注[1-5]。微反应器是一种连续流动的管道式反应器。它包括化工单元所需要的混合器、换热器、反应器、控制器等,但是,其管道尺寸远远小于常规管式反应器。微反应器内部是由直径为10~500μm 的很多微管并联而成,有极大的比表面积,由此带来的根本优势是极大的换热效率和混合效率。换句话说,可以精确控制反应温度和反应物料按精确配比瞬时混合。这些都是提高收率、选择性、安全性,以及提高产品质量的关键因素。[6]
自20世纪90年代中期微反应器技术兴起以来,国外在此方面的研究和应用的报道已经有数百篇(其中有不少是综述性文章) ,不但取得了很多令人瞩目的研究成果,尤为重要的是,不少公司已经在利用微反应器进行药物和精细化学品的公斤级合成,甚至在工业生产上也开始应用。而国内目前还处在起步阶段,文献报道很少。文章的目的在于,通过介绍微反应器技术的研究和应用进展,为读者展示微反应器的特点和优势,以及它在精细化工领域的巨大应用价值,以期推动该前沿技术在科研工作中的应用。[7]
1 生产方法
1-硝基丙烷、2-硝基丙烷是重要的医药化工产品,主要经丙烷硝化制取。在工业中主要有以下几种方法生产1-硝基丙烷和2-硝基丙烷。
1.1 1-硝基丙烷的生产方法[8]
丙烷硝化法:
先将丙烷放入预热器于430~450℃进行预热,然后进入反应塔与硝酸在390~440℃进行反应,压力为0.69~0.86MPa。从反应塔出来的气体经冷凝器冷却,硝基丙烷与稀硝酸即凝缩。而丙烷与气态氧化物则由回收塔回收,丙烷循环使用。所得产品为硝基甲烷10%~30%,硝基乙烷20%~25%,12硝基丙烷25%,22硝基丙烷40%。
丙烯硝化法:
由丙烯等不饱和烃为原料,经气相或液相硝化或饱和烃丙烷液相硝化,即可制得硝基丙烷。
1.2 2-硝基丙烷的生产方法 [9]
硝酸直接氧化法:
又称CSC法,以制取多种低碳硝基烷烃为目的,全过程分硝化、产物回收、原料丙烷与硝酸回收、硝基烷烃分离和精制等4个工序。硝化反应在绝热反应器内完成, 温度350~400℃,压力110~112Mpa,停留时间为110~112s。乙丙烷为原料时,,产物大致含硝基甲烷25%,硝基乙烷15%,1-硝基丙烷20%,2-硝基丙烷40%。视原料和反应条件而异,主要取决于原料中低碳烷烃的构成。丙烷和硝酸的转化率分别为10%和98%,选择性分别为60%和38%。
氧化氮硝化法:
又称GP法,20世纪70年代由法国GP公司开发,以低碳烷烃和氧化氮为主要原料,引入富氧或空气作氧化剂,反应温度280~340℃,压力110~112MPa,停留时间10s。当C3H8∶NOX∶空气=60∶1415∶2415时,产物含硝基甲烷15%,硝基乙烷5%,1-硝基丙烷20%,2-硝基丙烷60%。该工艺取消了硝酸回收系统,缩短了硝化反应工艺流程,但是由于需要引入空气,反应系统随时有可能处于爆炸极限边缘,安全性较差,低碳烷烃和氧化氮的转化率和选择性都低于硝酸硝化工艺。
液相硝化的特点是温度低而压力高,适用于正常条件时为液态的烷烃,工业上应用不多。气相反应一般在高温高压下进行,放热,1-硝基丙烷与空气形成爆炸性混合物,爆炸极限为2.6%(体积),生产条件苛刻且难以准确控制,常规工业法生产遇到的困难不小。丙烷硝化过程存在着副产物多、分离困难、腐蚀严重、工艺复杂、安全性低等问题。丙烷硝化制取1-硝基丙烷、2-硝基丙烷的工艺路线具有原料单一产物易分离等优点,但由于其选择性差、产率低、安全性而未能实现工业化。[10]
由于丙烷硝化是复杂的强放热反应过程,安全性比较低。微通道反应器具有优良的传递特性,可有效避免微反应器层内热点的形成。近年来,人们开展了微反应器用于氧化反应的研究,采用微反应器研究丙烷硝化与传统反应器相比具有明显优势,为该过程的工业化提供了可能性。为进一步优化反应性能,文章在微通道反应器内进行了丙烷硝化的研究,预测了反应条件在较大范围内变化时丙烷硝化的主要产物的选择性。[11]
2 实验部分
2.1 仪器和试剂
温度控制仪(AI-708P,厦门宇电自动化科技有限公司),微量平流泵(2PB-30C,北京卫星制造厂),质量流量控制器(D07-7B,北京七星华创电子股份有限公司),流量积算仪(D08-8C/ZM,北京七星华创电子股份有限公司),气相色谱仪(GC-7900,上海天美科学仪器有限公司,采用DM-1701极性柱),气相-红外联用仪(NEXUS 670 FT-IR, 美国NICOLET公司)。
丙烷(96.7%,溧水县工业气体制造有限公司),氮气(99.999%,南京三乐集团有限公司机动分厂),硝酸(65.0~68.0%,南京化学工业公司化工建材厂)。
2.2 实验原理
反应物浓硝酸和丙烷一起通过进料口进入加热到350~440℃的微反应器中,硝酸被同时气化,进行气相反应。反应生成硝基甲烷、硝基乙烷、1-硝基丙烷、2-硝基丙烷。再将生成的产物进行蒸馏分离,得到所需的1-硝基丙烷和2-硝基丙烷。
2.3 反应器及实验装置
微反应器结构如图1所示。图中包括上盖板1,加热孔2,石墨密封片3,主反应板4,下盖板5,进料口6,出料口7,测温孔8,螺栓孔9,微通道10。
加热棒插入加热孔2,反应板4上的微通道10的截面尺寸为宽1mm×深1mm。加热棒插入加热孔2,热偶插入测温孔8,加热棒和热偶均与温控仪连接对反应器温度进行控制。反应板尺寸为15x10x3cm,上下盖板、石墨密封片和反应板上有小孔9,由螺栓通过小孔将它们固定压紧。微通道10端部的进料口6和出料口7深1cm,直径2mm,分别由上盖板1和石墨密封片3主体上的小孔引出,上盖板1的孔为内螺纹。反应板上的微通道界面尺寸为几百微米至几毫米,由特种不锈钢机械加工或化学刻蚀加工制成。[12]
丙烷流量由质量流量控制仪(D08-8C/ZM,北京七星华创电子股份有限公司)控制,液体硝酸由微量平流泵(2PB-30C,北京卫星制造厂)加入。硝酸和气体经过三通阀后共同进入微反应器。有机产物由不锈钢管引出进入冷凝管冷凝收集在三颈圆底烧瓶,尾气通过碱液吸收酸性气体后,再经过干燥管回收丙烷。
实验在常压,不同空速、丙烷/硝酸摩尔比和反应温度条件下进行。气体总空速(SV)为3000~80000h-1,丙烷/硝酸摩尔比为5~9,温度(T)为350~440℃。选择性采用C归一化法处理,转化率是按一定量接馏物中有机相所含体积计算所得,所以只作为参考;总体上都处于7~9%间,故所有转化率数据没有列入表中。
2.4 实验目的
在微通道反应器内进行丙烷气相硝化反应,目的在于改变工艺流程,降低该反应的传质传热阻力,避免常规反应器热能量大易导致爆炸的危险,提高反应的安全性和可操作性,可在爆炸范围内操作,同时提高原料的利用率和产物的时空产率,有望实现该过程的工业化。
2.5 实验方法特征
(1)该气相硝化反应在微通道反应器内进行,不需要催化剂;
(2)以硝酸为硝化剂,硝酸浓度范围为45~90%;
(3)丙烷纯度为75~99%;
(4)丙烷量的范围为:硝酸/丙烷物质的量比为5~9;
(5)反应压力为常压~1.5MPa;
(6)反应温度为350~440℃;
(7)气体总空速为约3,000~80,000h-1。
2.6 实验步骤
2.6.1 实验准备
温度控制仪器将微反应器温度升到440℃,打开氮气钢瓶,质量流量控制仪控制在200ml/min,平流泵通入蒸馏水流量控制在0.2ml/min。试运行实验装置,用肥皂水检查三通阀及其他接口处的气密性,看是否漏气,以确保整个装置的气密性完好。
2.6.2 运行实验
实验运行前,先打开氮气钢瓶通入氮气,平流泵通入蒸馏水吹扫整个反应回路。吹扫完毕后,打开丙烷钢瓶阀门,通入丙烷,冷凝装置通入冷却水,开始进行实验。温度控制仪器控制微反应器在435~445℃,质量流量控制仪控制在150~300ml/min,平流泵流量控制在0.2~0.4ml/min。
2.7 分析方法
分析方法用气相色谱法。从反应器出来的高温反应混合气体冷却冷凝,将冷凝液中的水油两相物质分离,把油相产物用气相-红外联用色谱仪进行定性分析,再通过气相色谱仪(FID检测器,极性毛细管柱)进行定量分析,色谱条件:进样器温度=180℃,检测器温度=180℃,柱温=90℃,氢气:30ml/min,空气:300ml/min,尾吹:30ml/min。通过对不断改变反应条件生成的产物进行分析,来确定硝酸转化率和1-硝基丙烷和2-硝基丙烷选择性最高时候的反应条件,达到产物最优化的条件。
2.7.1 样品的气相谱图
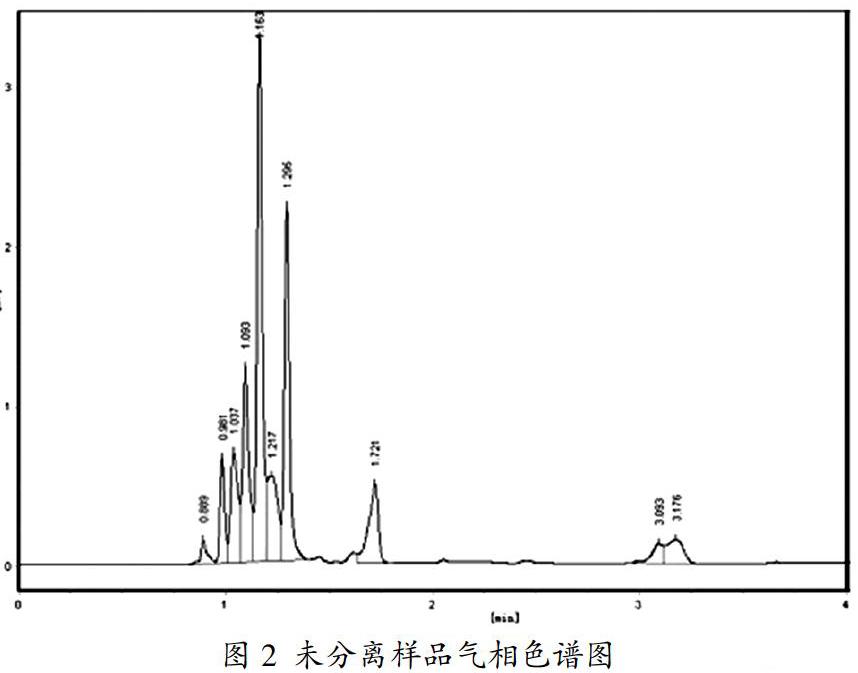
由图2可知,样品未分离时其谱峰较多,主要是由于样品除了含有硝基烷烃之外,还含有丙烷氧化产生的多种酸(甲酸、乙酸等)所导致的结果。
图3是样品分离以后油相样品的气相色谱图,由图可知,样品主要有四个峰。由图4~图8的气-红定性谱图可知,四个峰依次为:
上述保留时间不一致,这主要是二者的色谱条件不一致所致,但不影响物质出峰的次序。
2.7.2 气-红联用色谱仪分析的谱图
图4是样品的GC/IR重构图,其中峰1→t=4.647min,硝基乙烷,峰2→t=5.291min,2-硝基丙烷,峰3→t=6.336min,1-硝基丙烷。对应峰的红外谱图及其解析见如图5至图8。
图5是对保留时间在6.336min的物质用红外色谱仪进行定性分析,图6是图5的谱图曲线在IR数据库中的检索结果,匹配度达97.79%。
可以证明峰3分离出来的物质是1-硝基丙烷。
图7是对保留时间在5.291min的物质用红外色谱仪进行定性分析,图8是图7的谱图曲线在IR数据库中的检索结果,匹配度达93.52%。
同理,可以证明峰2分离出来的物质是2-硝基丙烷。
3 结果与讨论
反应条件的考察:
(1)温度的影响
在反应装置上考察了温度对选择性的影响,结果见表1。
注:压力为0.4~0.6MPa,丙烷:HNO3物质的量的比为8.76,空速为20031h-1
由表1可知,丙烷/硝酸比和空速相同,不同温度下的实验结果:430℃时由于硝酸分解产生大量的氮氧化物,并且检测不到丙烷的硝化物。在435℃~445℃之间,温度升高,2-硝基丙烷的选择性增大,1-硝基丙烷的选择性变化不规律,硝基乙烷、硝基甲烷的选择性变化不大。超过450℃,反应体系极易爆炸,考虑到安全性,同时由表1的结果升高温度对硝基丙烷的选择性提高没有明显的作用,所以没有做该条件下的实验。
(2)流量的影响
在反应装置上考察了反应物流量大小对选择性的影响,结果见表2。
由表2可知,温度相同,不同空速和丙烷/硝酸比下的实验结果:空速增大,1-硝基丙烷的选择性减小,2-硝基丙烷的选择性增大,硝基乙烷、硝基甲烷的选择性变化不规律。硝基丙烷总选择性和丙烷转化率均增加,硝基乙烷、硝基甲烷的选择性有所降低。
(3)反应物比例的影响
在反应装置上考察了反应物比例对选择性的影响,结果见表3。
表3是温度相同,不同空速和丙烷/硝酸比下的实验结果,由表3可知,HNO3流量保持0.2ml/min增大丙烷流量即增大丙烷/硝酸摩尔比,1-硝基丙烷选择性有所减小、2-硝基丙烷选择性有所增大,硝基乙烷、硝基甲烷的选择性都有所减小。HNO3流量保持0.3ml/min增大丙烷流量即增大丙烷/硝酸摩尔比,1-硝基丙烷选择性有所减小、2-硝基丙烷选择性有所增大,硝基乙烷、硝基甲烷的选择性都有所增大。硝酸的流量增大到0.4ml/min,同时丙烷的流量增大300ml/min,丙烷/硝酸摩尔比为8.79,1-硝基丙烷的选择性是最小,而2-硝基丙烷的选择性是最大,硝基乙烷、硝基甲烷选择性变化不明显。说明在保持摩尔比变化不大的情况下,空速增大有利于2-硝基丙烷的生成。与表2的结果一致。
(4)反应器的影响
在反应条件相同的情况下考察了不同反应器对选择性的影响,结果见表4。
实施例a:反应在图1所示反应器中进行,65%硝酸做氧化剂。
比较例b:反应在多室斯登该尔反应器中进行,反应过程中需要不断喷洒水蒸气或通入惰性气体作稀释剂,以导出多余的反应热,降低反应温度。[13]
由表4可知,本发明方法与传统固定床反应器相比,1-硝基丙烷和2-硝基丙烷的选择性有明显的提高。这主要是由于传热的改变,微反应器内在任何反应条件和不同时间温度的波动不超过2℃,而传统固定床反应器内很难得到比较均匀稳定的发应温度,反应物料摩尔比接近时,极易产生飞温,导致深度氧化,使硝基丙烷选择性降低。
4 结束语
微通道反应器用于化学反应具有传统反应器所不及的优点。而利用微通道反应器高比表面,良好的传质传热等特点,我们首先进行了将微通道反应器用于丙烷气相硝化的研究,采用普通浓度的硝酸作硝化剂和工业纯丙烷作原料,1-硝基丙烷的选择性由原来的40%提高到44%,2-硝基丙烷的选择性由原来的25%提高到38%,同时丙烷循环利用,充分降低成本,也提高原料的利用率和产物的时空产率。利用微反应器进行反应,降低了该反应的传质传热阻力,避免常规反应器热能量大易导致爆炸的危险,提高生产的安全性和可操作性。初步结果表明,微通道反应器是该反应实现工业化以及科学研究的良好的选择,具有较大的工业化价值。
致谢:文章得到了江苏徐州德隆化工有限公司的资助;实验中得到了倪平博士、李小华教授及杨伟华同学的大力帮助,在此一并深致谢意!
参考文献
[1]FLETCHER P D I ,HASWELL S J ,POMBO2VILLAR E, etal.Micro reactor :principles and applications in organic syn2thesis[J]. Tetrahedron ,2002,58(24):473524757.
[2]PENNEMANN H ,WATTS P ,HASWELL S J ,et al. Bench2making of microreactor applications[J].Org. Proc. Res. &Deve. ,2004,8(3):4222439.
[3]THAYER A M. Harnessing microreactions[J].Chem. &Eng. News,2005,83 (22):43252.
[4]DOKU GN ,VERBOOM W,REINHOUDTD N. et al. On2mi2croc
hip multiphase chemistry——a review of microreactor design principles and reagent contacting modes[J]. Tetrahe2 dron ,2005,61(11):273322742.
[5] HOLLADAYJ D ,WANG Y,JONES E. Review of develop2 ment in portable hydrogen production using microreactor technology[J]. Chem. Rev. ,2004,104(10):476724790.
[6]钟平,黄南平.微反应器技术在有机合成中的应用[J].化学试剂,2007,29(6):339-344.
[7]李斌.微反应器技术在精细化工中的应用[J].精细化工,2006(1).
[8]汉继程,顿静斌.低碳硝基丙烷的用途及生产状况[J].精细与专用化学品,2005,13(1):27-30.
[9]叶达恩.低碳烷烃制备硝基丙烷[J].化工时刊,1994(6):3-11.
[10]Tiggelaar R M , Loeters P W H , van Male P , OosterbroekR E , Gardeniers J G E ,De Croon M/ H J M ,Schouten JC ,Elwenspoek M C ,van den Berg A. Thermal and mechanical analysis of a microreactor for high temperaturecatalytic gas phase reactions Sensors and Actuators A,2004,112:267227.
[11]Centi G, Lanzafame P , Perat honer S1 Performances of Co2 based catalyst s for t he selective side chain oxidation of toluene in t he gas phase1 Catal1 Today,2005,99:1612170.
[12]葛皓,陈光文,袁权,等.微反应器内甲苯气相催化氧化反应动力学[J].化工学报,2007,58(8):1967-1972.
[13]陈赓良.低碳烷烃的硝化与硝基丙烷的生产[J].天然气工业,1990,10(2):60-64.

