中段食管癌原发灶和转移淋巴结中端粒酶表达水平及其相关性研究
张 云,张金岭,殷忠美,王守峰
(1.山东大学附属临沂市人民医院肿瘤科,山东 临沂 276000;
2.山东医学高等专科学校附属医院肿瘤科,山东 临沂 276000)
中段食管癌原发灶和转移淋巴结中端粒酶表达水平及其相关性研究
张云1,张金岭1,殷忠美2,王守峰1
(1.山东大学附属临沂市人民医院肿瘤科,山东 临沂 276000;
2.山东医学高等专科学校附属医院肿瘤科,山东 临沂 276000)
[摘要]目的利用分子生物学技术检测中段食管癌原发灶和各组转移淋巴结中端粒酶活性,探讨转移淋巴结与原发灶的相关性,为食管癌放疗分子靶区勾画和个体化精确放疗提供新思路。方法利用TRAP银染色法检测端粒酶活性,采用χ2检验端粒酶活性表达强度与食管癌临床病理间的关系,采用CMH χ2检验分析转移淋巴结、正常黏膜组织中端粒酶活性的差异,采用Spearman相关系数法分析原发灶和各组转移淋巴结端粒酶表达水平的相关性。结果150例食管癌中,端粒酶mRNA的阳性表达率为60.0%,各组转移淋巴结中端粒酶mRNA的阳性表达率处于1.3%~64.4%之间,按照108、107、7、2、3、109(淋巴结组)的顺序依次降低。结论端粒酶活性可以作为了解肿瘤的转移能力和食管癌淋巴结微转移的一个标志,可以为食管癌分子靶区的勾画提供新依据。
[关键词]食管癌;端粒酶;转移淋巴结
人体绝大多数的恶性肿瘤细胞呈端粒酶阳性,而人体正常细胞(除人体生殖细胞、某些淋巴细胞和造血干细胞外)却为阴性,提示端粒酶可成为恶性肿瘤的重要标志,且已有食管癌组织中的端粒酶活性明显增加的报道[1-5]。端粒酶活性与肿瘤细胞恶性程度密切相关,是诊断多数恶性肿瘤、判断愈后的良好指标,因此本研究应用TRAP法检测原发灶和转移淋巴结中端粒酶活性表达水平及其相关性,为食管癌放疗寻找精确靶区,提高患者生存率,以期为临床应用打下坚实基础。
1材料与方法
1.1材料选取2010年1月至2013年1月期间临沂市人民医院收治的中段食管癌且行手术切除治疗患者150例,病理类型明确且有淋巴结转移。取其术后原发病灶和转移淋巴结标本,快速取材,液氮速冻后转至-80 ℃低温冰箱中贮存。取原发灶癌旁>5 cm食管黏膜标本作为对照。所有标本包埋切片8 μm左右,每份标本6张切片。
患者纳入标准:1)无远处转移;2)术前未经放疗或者化疗;3)未侵犯心脏和气管、支气管。
1.2试剂TRAP-ezeTM端粒酶测定盒(美国Oncor公司);GAPDH(内参基因)和telomere DNA(目标基因)由上海捷瑞生物公司合成。
1.3方法
1.3.1端粒酶提取每例标本取100 mg组织,用冷的wash buffer(10 mmol·L-1Hepes-KOH、1.5 mmol·L-1MgCl2、10 mmol·L-1KCl、1 mmol·L-1DTT,pH 7.5)清洗后,置于90 mm组织研磨器中研磨成糊状,转至0.5 mL离心管中,低温离心去上清后,立即加入200 μL预冷的Lysis buffer(10 mmol·L-1Tris-HCl、1 mmol·L-1MgCl2、1 mmol·L-1EDTA、0.1 mmol·L-1PMSF、5 mmol·L-1β-Mercaptoethanol、0.5% CHAPS、10% Glycerol),混匀,冰浴匀浆物30 min后,4 ℃、16 000 r·min-1离心20 min,上清即所需提取液。
1.3.2端粒酶活性测定GAPDH(内参基因):上游引物5’-CCCCACACACATGCACTTACC-3’;下游引物5’-CCTAGTCCCAGGGCTTTGATT-3’。telomere DNA(目标基因):上游引物5’-CGGTTTGTTTGGGTTTGGGTTTGGGT-TTGGGTTTGGGTT-3’;下游引物5’-GGCTTGCCTTACCC-TTACCCTTACCCTTACCCTTACCCT-3’。
1.3.3端粒酶活性检测采用TRAP法检测端粒酶活性。反应体系48 μL,含1 μL 50×dNTPs mix,1.0 μL Ts引物,1.0μL TRAP Primer mix,2 u taq酶,39.6 μL dH2O,加端粒酶提取液2 μL,加入2~3滴石蜡油后,转至PCR扩增仪30 ℃延伸30 min后,马上转至94 ℃,然后进行PCR扩增,循环参数为94 ℃ 30 s,60 ℃ 30 s,共35个循环。每次检测均设阳性对照与阴性对照,以三蒸水作为阴性对照,阳性对照试剂盒内已提供。反应结束后,取15 μL反应产物加5 μL上样缓冲液经12%聚丙烯酰胺凝胶电泳4~5 h,电压125 V,电泳结束后,将凝胶置10%乙醇固定3 min,再用1%硝酸浸胶3 min后,0.2%硝酸银染胶20 min后,在显影液(80 mL H2O、20 mL Na2CO3、50 μL甲醛)中显色至全部条带显色而背景不过高为止,再行10%冰乙酸固定3 min,将胶用保鲜膜包裹后作永久保存。在凝胶成像系统中照相后使用凝胶分析软件进行结果分析。
1.4统计学处理利用SPSS 21.0分析数据结果,采用χ2检验分析端粒酶活性表达强度与食管癌临床病理间的关系,采用CMHχ2检验分析转移淋巴结、正常黏膜中端粒酶活性的差异,采用Spearman相关系数法分析原发灶和各组转移淋巴结端粒酶表达水平的相关性,检验水准α=0.05。
2结果
2.1淋巴结转移与食管癌临床病理参数的关系食管癌淋巴结转移与其肿瘤长度、分化程度以及肿瘤浸润深度显著有关(P<0.05)。见表1。
表1淋巴结转移与食管癌临床病理参数的关系
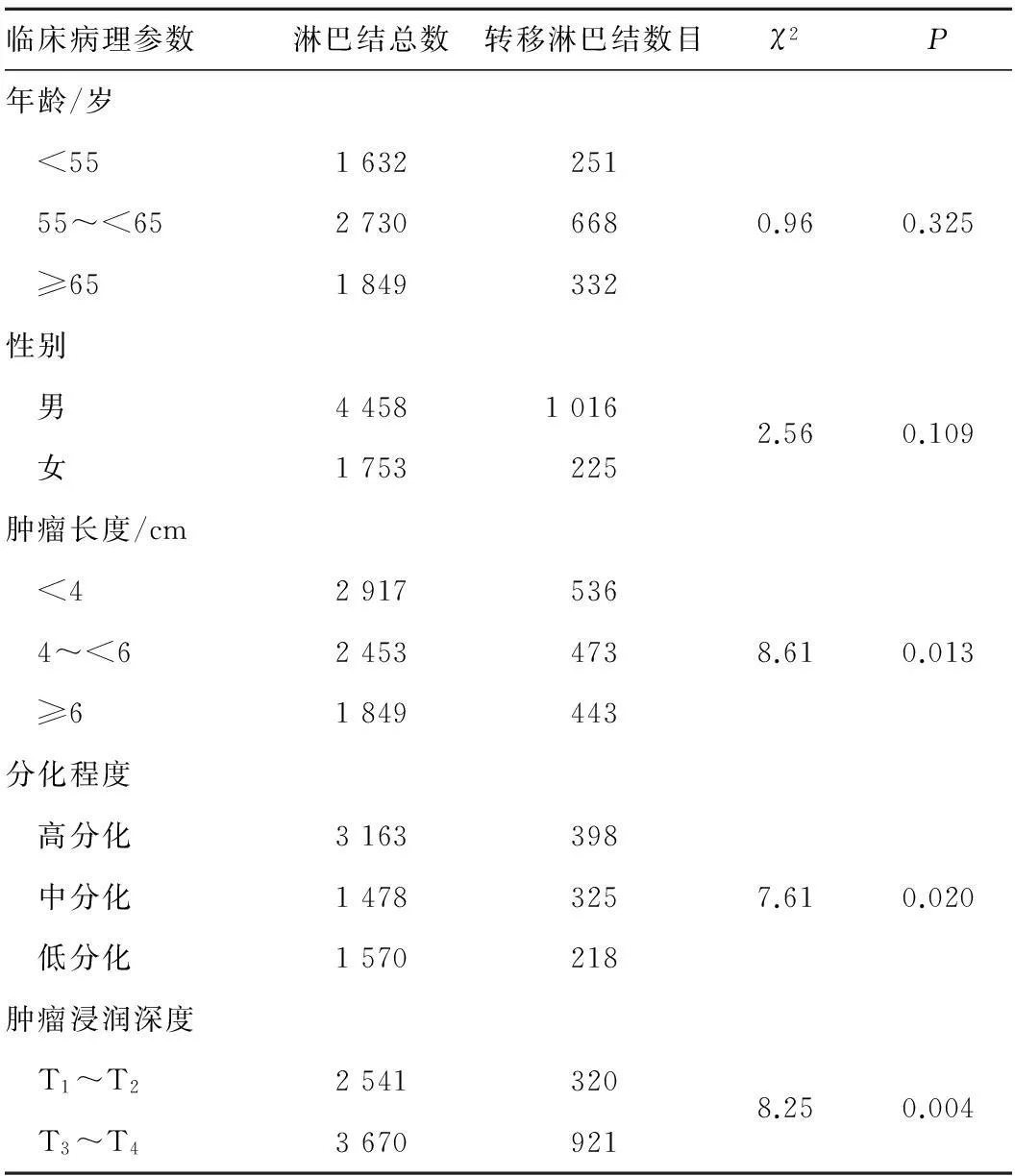
临床病理参数淋巴结总数转移淋巴结数目χ2P年龄/岁 <551632251 55~<6527306680.960.325 ≥651849332性别 男445810162.560.109 女1753225肿瘤长度/cm <42917536 4~<624534738.610.013 ≥61849443分化程度 高分化3163398 中分化14783257.610.020 低分化1570218肿瘤浸润深度 T1~T225413208.250.004 T3~T43670921
2.2转移淋巴结、正常食管黏膜组织中端粒酶的表达在150例食管癌中,各组转移淋巴结中端粒酶mRNA的阳性表达率为1.3%~64.4%,按照108、7、107、2、3、109的顺序依次降低。见表2。
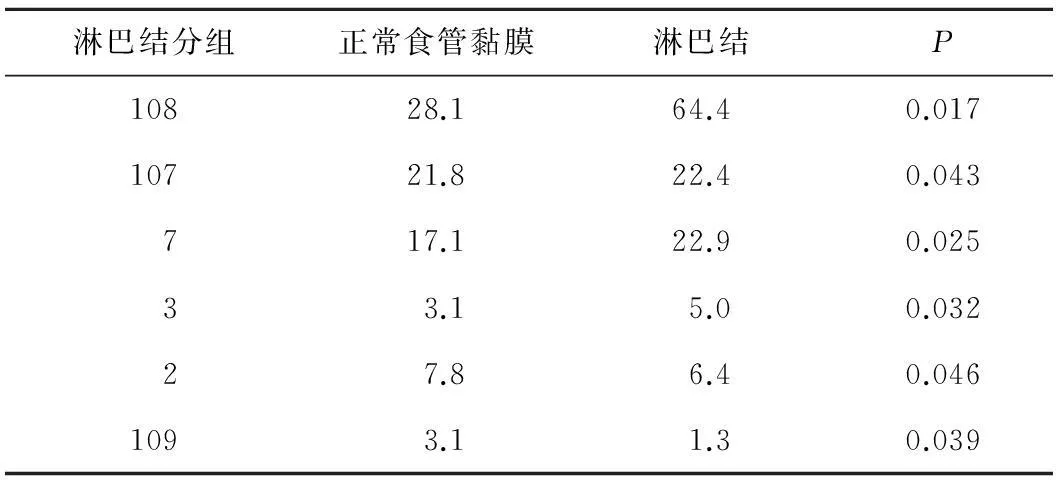
表2 转移淋巴结、正常食管黏膜组织中端粒酶的阳性表达率 %
2.3原发灶和各组转移淋巴结端粒酶表达水平的相关性108、107、7、3组淋巴结与原发灶端粒酶表达有相关性,而2、109组淋巴结则与原发灶端粒酶表达无相关性。见表3。
表3原发灶和各组转移淋巴结端粒酶表达水平的相关性
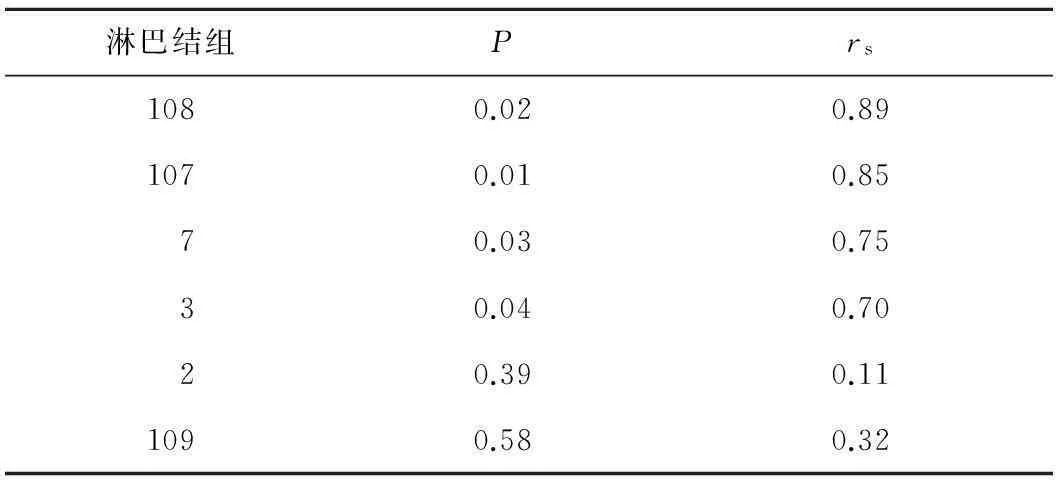
淋巴结组Prs1080.020.891070.010.8570.030.7530.040.7020.390.111090.580.32
3讨论
食管癌是我国高发病之一,在致死性肿瘤中排第6位,年龄标准化发病率为每10万人中19.7例[1]。其中,中段食管癌发病率最高,但是由于食管特殊的解剖结构,其极易发生淋巴结转移。淋巴结转移是影响食管癌患者整体生存率的重要因素,淋巴结转移情况的精确评价影响肿瘤放疗靶区的勾画,而放疗在食管癌中有非常重要的治疗地位,因此精确的肿瘤放疗靶区勾画是延长总体生存率的基本保障[2]。精确的肿瘤放疗靶区勾画需要准确了解肿瘤转移区域淋巴结的特点,但是一些早期微转移灶难以通过内镜以及影像检查发现[3],目前研究发现利用分子生物学评价肿瘤微转移比病理学更精确。
端粒是真核细胞染色体末端的DNA-蛋白质复合物,其功能是稳定染色体末端,避免染色体重组和末端被降解,防止染色体复制时缩短,端粒合成有赖于端粒酶的参与。端粒酶是由RNA和蛋白质组成的核糖核蛋白,能识别特定的端粒重复序列,并以自身RNA部分为模板,合成新的端粒重复序列并添加到染色体末端,从而保持端粒的长度与染色体的稳定性,使细胞获得永生化,甚至转化为无限分裂增殖的肿瘤细胞[4]。研究[5]发现,人体绝大多数的恶性肿瘤细胞呈端粒酶阳性,而人体正常细胞(除人体生殖细胞、某些淋巴细胞和造血干细胞外)却为阴性,提示端粒酶可成为恶性肿瘤的重要标志。Takubo等[6]检测了31例食管癌,其端粒酶活性为87%(27/31)。赵春芳等[7]研究发现食管鳞癌组织内端粒酶阳性检出率高达84.8%(28/33),与肝细胞肝癌、前列腺癌、胃癌相近。近年来关于端粒酶和食管癌的研究热点集中在两者的关系上,研究[8]发现端粒酶与食管癌预后密切相关。Hsu等[9]认为端粒酶水平的变化是食管癌转移和进展的重要机制和标志。Li等[10]也证明了端粒酶与食管癌的进展密切相关。总之,端粒酶活性与肿瘤细胞恶性程度密切相关,是诊断恶性肿瘤、判断愈后的良好指标,因此检测食管癌原发灶和转移淋巴结中端粒酶活性表达水平,了解各组淋巴结和原发病灶的相关性,是检测肿瘤微转移,优化食管癌放疗靶区的新思路。
本研究结果显示食管癌淋巴结转移与性别、年龄无关(P>0.05),而与肿瘤的长度、淋巴结转移、分化程度以及肿瘤浸润深度有关(P<0.05)与以往文献[11]报道一致。
胸段食管癌患者长期生存率不高,主要是由于较高的淋巴结转移发生率及局部复发率[12]。食管癌淋巴结转移发生时间早,分布广,可位于颈部和上腹部之间的任何区域。但各组淋巴结转移风险以及与原发病灶的关系尚存在争议,尤其在低分化癌、腺癌、小细胞癌等特殊病理类型中此问题尚不清楚。放疗是食管癌特别是进展期食管癌的主要治疗手段之一,是以食管癌各组淋巴结转移率的规律而设计靶区的。由于食管癌壁内核食管周淋巴结管网丰富,并且疾病早期往往存在壁内浸润和跳跃性转移,目前检查手段尚不能有效检测出亚临床病灶和微小转移病灶,因而依据淋巴结转移率的经验而设计的靶区带有一定程度的盲目性,各治疗中心在设野及制定放疗计划时存在明显差异,如何确定胸段食管癌淋巴结亚临床病灶是放疗的难点。本研究旨在通过检测食管癌转移淋巴结中端粒酶的活性,了解肿瘤微转移,从而可以客观和个体化评价食管癌各组淋巴结转移情况。
基于本研究的结果,我们发现,食管癌转移淋巴结中的端粒酶活性明显高于周围正常食管黏膜中的端粒酶活性(P<0.05),说明通过检测端粒酶活性了解淋巴结微转移有可行性。通过利用相关性分析,我们进一步了解到108、107、7、3组淋巴结与原发灶端粒酶表达明显相关(P<0.05),这与我们既往基于病理结果大样本的食管癌淋巴结转移规律结果相似,从侧面证实了通过检测食管癌转移淋巴结中端粒酶的活性了解肿瘤微转移的可行性。而且108、107、7、3组淋巴结中端粒酶的活性逐渐减低,也与基于病理结果的食管癌淋巴结转移规律结果相似,也说明了通过食管癌转移淋巴结中端粒酶的活性了解各组淋巴结和食管癌原发病灶的关系有可行性。基于本研究结果,有望下一步大样本的病例标本予以再次证实后,将试验步骤和条件进行试剂盒研发,为临床食管癌术后淋巴结微转移的大规模检测提供便利。
总之,从分子水平检测中段食管癌原发灶以及淋巴结肿瘤微转移,研究各组淋巴结转移的规律,可以为食管癌放疗分子靶区勾画和个体化精确放疗提供新思路。
参考文献:
[1]Parkin DM,Bray F,Ferlay J,et al.lobal cancer statistics,2002[J].CA Cancer J Clin, 2005,55(2):74-108.
[2]Natsugoe S,Matsumoto M,Okumura H,et al.Initial metastatic,including micrometastatic,sites of lymph nodes in esophageal squamous cell carcinoma[J].J Surg Oncol, 2005,89(1):6-11.
[3]Lowe VJ,Booya F,Fletcher JG,et al.Comparison of positron emission tomography,computed tomography,and endoscopic ultrasound in the initial staging of patients with esophageal cancer[J].Mol Imaging Biol, 2005,7(6):422-430.
[4]Catarino R,Araújo A,Coelho A,et al.Prognostic significance of telomerase polymorphism in non-small cell lung cancer[J].Clin Cancer Res, 2010,16(14):3706-3712.
[5]Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J].Eur J Epidemiol, 2010,25(9):603-605.
[6]Takubo K,Nakamura K,Izumiyama N,et al.Telomerase activity in esophageal carcinoma[J].J Surg Oncol, 1997,66(2):88-92.
[7]赵春芳,陈朝伦.食管癌组织端粒酶活性的研究[J].癌症,2000,19(2): 131-133.
[8]Meeker AK,Hicks JL,Iacobuzio-Donahue CA,et al.Telomere length abnormalities occur early in the initiation of epithelial carcinogenesis[J].Clin Cancer Res, 2004,10(10):3317-3326.
[9]Hsu CP,Lee LW,Shai SE,et al.Clinical significance of telomerase and its associate genes expression in the maintenance of telomere length in squamous cell carcinoma of the esophagus[J].World J Gastroenterol, 2005,11(44):6941-6947.
[10]Li H,Diao TY,Zhou ZY,et al.Relationship between the expression of hTERT and EYA4 mRNA in peripheral blood mononuclear cells with the progressive stages of carcinogenesis of the esophagus[J].J Exp Clin Cancer Res, 2009,28:145.
[11]Nakagawa S,Kanda T,Kosugi S,et al.Recurrence pattern of squamous cell carcinoma of the thoracic esophagus after extended radical esophagectomy with three-field lymphadenectomy [J].J Am Coll Surg, 2004,198(2):205-211.
[12]Shimada H,Kitabayashi H,Nabeya Y,et al.Treatment response and prognosis of patients after recurrence of esophageal cancer[J].Surgery, 2003,133(1):24-31.
Expression of Telomerase in Primary Lesion and Metastatic Lymph Nodes of the Middle Esophageal Carcinoma and Their Correlation
Zhang Yun1,Zhang Jinling1,Yin Zhongmei2,Wang Shoufeng1
(1.DepartmentofOncology,theLinyiPeople’sHospitalAffiliatedtoShandongUniversity,Linyi276000,China;2.DepartmentofOncology,theAffiliatedHospitalofShandongMedicalCollege,Linyi276000,China)
[Abstract]ObjectiveTo investigate the telomerase activity in the primary lesion and metastatic lymph nodes of the middle esophageal carcinoma and to explore the correlation between the lymph nodes and the primary lesion of tumor.To provide a new method identifying the molecular tumor area of individualized esophageal cancer radiotherapy.MethodsTRAP silver staining method was used to detect telomerase activity.Chi-squre test was used to explore the relation between the clinicpathological parameter and the lymph node metastasis.CMH Chi-squre was used to evaluate the difference of telomerase activity between the normal tissue and lymph node.Spearman Rank test was used to explore the relation between primary lesion and lymph nodes.ResultsIn the 150 cases of esophageal carcinoma,the positive expression rate of telomerase mRNA was 60.0%.The positive expression rate of telomerase mRNA in the lymph node stations was from 1.3% to 64.4%,and the decreased as the sequence of 108,107,7,2,3,109.ConclusionTelomerase activity can be used as a marker of tumor micro-metastasis and provide a new basis for the molecular target treatment of esophageal carcinoma.
[Key words]esophageal carcinoma; telomerase; lymph node metastasis
(收稿日期:2015-12-31)
[中图分类号]R735.1;R730.23
[文献标识码]A
[文章编号]1673-5412(2016)02-0102-04
DOI:10.3969/j.issn.1673-5412.2016.02.003
作者简介:张云(1969-),女,副主任医师,主要从事食管癌的基础与临床研究。E-mail:zhangyunsdly@126.com。通信作者:张金岭(1980-),男,博士,主治医师,主要从事食管癌的基础与临床研究。E-mail:jinlingzhang_931@163.com。

