菠萝AcHMGR基因的克隆与表达分析
李运合 孙光明 吴青松


摘 要 以菠萝(Ananas comosus L. cv. Comte de Paris)果实为材料,采用RT-PCR结合RACE方法得到3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因(命名为AcHMGR)的cDNA及基因组DNA全长。AcHMGR的cDNA全长2 407 bp,其开放读码框长度为1 740 bp,编码579个氨基酸;其基因组DNA全长为4 115 bp,从起始密码子到终止密码子的长度为3 764 bp,含有4个外显子和3个内含子。荧光定量PCR结果表明,对照的菠萝果实中,AcHMGR基因表达量在花后0 d最高,从花后30 d开始,其表达量急剧下降,之后维持在一个较低水平直到果实成熟。经20 mg/L N-(2-氯-4-吡啶基)-N'-苯基脲(CPPU)处理后,显著提高了AcHMGR基因在花后30 d果实中的相对表达量,为同期对照的1.8倍;但其他时期的相对表达量与对照相比无明显差异。研究结果表明,AcHMGR基因在菠萝果实早期发育过程中表达量较高,CPPU处理提高了AcHMGR基因的相对表达量并显著提高果实的重量,说明CPPU处理后AcHMGR基因可能在促进果实重量的增加中起着重要作用。
关键词 菠萝;AcHMGR基因;细胞分裂;CPPU
中图分类号 S668.3 文献标识码 A
我国是世界菠萝(Ananas comosus L.)生产大国,主要集中在华南地区,2012年产量约为100万t,位居世界第8位[1]。但我国菠萝平均单产与国外相比有很大差距,2012年平均单产居世界第27位,只有18 869 kg/hm2,低于世界平均水平,尚不及世界最高单产国家(124 534 kg/hm2)的1/6[1]。菠萝果实为头状花序自茎顶端叶丛抽出,发育而成的聚合果;每个植株上只有1个果实,因此在密度达到一定程度后,菠萝单果重(大小)决定了最终产量。果实的大小是许多作物如菠萝的一个重要经济指标,其受内部发育信号和环境因素影响[2-4]。菠萝果实大小受多种因素调控,与种植密度、催花时植株大小、水肥管理等多种因素均密切相关[5],最终果实细胞数目、细胞体积和小果(果眼)数目共同决定了果实的最终大小[6]。
3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGR)催化HMG-CoA产生甲羟戊酸(mevalonic acid, MVA),这是类异戊二烯(isoprenoid)生物合成途径中的关键一步[7-9];这步反应是不可逆的,因此认为HMGR是MVA途径中的一个限速关键酶[10]。类异戊二烯参与了植物的多个生物进程,包括固醇和植物生长调节剂(生长素、脱落酸、赤霉素、油菜素内酯)的合成等[11-12]。
前人研究表明,番茄(Solanum lycopersicum)[13]、鳄梨(Persea americana Mill. cv Hass)[11]、荔枝(Litchi chinensis)[14]果实的早期发育都有3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGR)的参与;甜瓜(Cucumis melo L.)HMGR基因(CmHMGR基因)的相对表达量和酶活性在授粉后的果实发育早期均明显提高[15],而过量表达CmHMGR基因的转基因甜瓜株系,其果实重量相比对照增加了20%[16-17]。这些研究都表明HMGR基因在决定果实大小中起着重要的作用。另一方面,在农业生产上合理使用植物生长调节剂提高作物产量与品质已有大量报道。N-(2-氯-4-吡啶基)-N′-苯基脲[N-(2-chloro-4-pyridyl)-N′-phenylurea, CPPU]是一种人工合成的苯基脲类细胞分裂素,具有促进细胞分裂和增大等多种功能[18-19]。已有的研究表明,在猕猴桃(Actinidia deliciosa C.F. Liang et A.R. Ferguson cv. Qinmei)[20]、甜柿(Diospyros kaki Linn)[21]、日本柿 (Diospyros kaki Thunb.)[22]等多种果树的花期或幼果期外施CPPU,均能起到提高果实重量或改善果实品质的效果;而对菠萝外施一定浓度的CPPU,也能显著提高其果实重量[23]。本试验以菠萝果实为材料,克隆分离了菠萝AcHMGR基因,并对其施用CPPU后的表达模式变化进行了研究,以期为研究菠萝果实大小的调控机制打下一定的理论基础。
1 材料与方法
1.1 材料及CPPU处理
试验于2013年8~11月在广东省湛江市南亚热带作物研究所进行,菠萝品种为皇后类的巴厘种(‘Comte de Paris)。CPPU为BBI公司产品,纯度>98%;参考李运合等[23]的试验结果,在本试验中的CPPU的使用浓度为20 mg/L。
在菠萝谢花后15 d和30 d,对菠萝果实喷施20 mg/L的CPPU,以清水为对照。处理和对照各150个果。喷施量以果实表面有溶液自然下淌为止。
在花后75 d左右,菠萝果实成熟,此时分别测定90个对照及95个CPPU处理的果实重量。
1.2 方法
1.2.1 AcHMGR基因的克隆 PrimeScript II 1st Strand cDNA Synthesis Kit、LA Taq酶、TaKaRa Agarose Gel DNA Purification Kit Ver.4.0、感受态细胞DH5α、dNTP mixture以及克隆载体pMD18-T vector等都购于宝生生物工程(大连)有限公司。
在NCBI数据库中搜索HMGR基因的氨基酸序列,选择与菠萝亲缘关系相对较近的8个序列,利用iCODEHOP v1.1程序[24]设计一对简并引物即AcHMGRSP1和AcHMGRSP2(表1)。取开花30 d 后的菠萝果实,按照Fu等[25]的方法提取RNA,然后以Oligo T为引物,参照说明书的方法用PrimeScript II 1st Strand cDNA Synthesis Kit將其反转录成cDNA。再以此cDNA为模板,以AcHMGRSP1和AcHMGRSP2为引物进行PCR扩增。PCR反应体系及条件参考Li等[26]的实验结果。
在获得中间片段后,用SMARTerTM RACE cDNA Amplification Kit(Clontech)进行5′ RACE和3′ RACE反应,获得其5′和3′末端。反应条件参照试剂盒说明书,所用引物序列见表1及说明书。
用Plant DNAout kit(Tiandz, Beijing, China)提取菠萝基因组DNA,在通过RACE方法获得AcHMGR基因的全长后,在其5′-UTR和3′-UTR分别设计引物,分别以cDNA和基因组DNA为模板进行PCR,分别对AcHMGR基因cDNA全长进行验证及基因组DNA全长的获取。反应条件同Li等[26]的方法。
PCR反应结束后,将获得的目的条带通过电泳进行分离,用TaKaRa Agarose Gel DNA Purification Kit Ver.4.0进行割胶回收纯化,将其与pMD18-T Vector连接后转化DH5α感受态细胞,经蓝白斑筛选和双酶切,挑取阳性菌落进行培养,送菌液至广州Invitrogen公司进行序列测定。获得测序结果后通过GenBank进行BLAST搜索对比。
1.2.2 生物信息学分析 核酸序列和其推导的氨基酸序列及开放阅读框(Open reading frame,ORF)通过NCBI(http://www.ncbi.nlm.nih.gov)进行在线分析。通过pI/MW Tool(http://www.expasy.org/tools/protparam.html)计算获得AcHMGR的分子量及等电点。推导的氨基酸序列在NCBI的保守域数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)进行分析来寻找保守域。通过ClustalW(http://www.ebi.ac.uk/clustalw/)对氨基酸序列进行对比,将获得的对比结果上传到BOXSHADE(http://www.ch.embnet.org/software/BOX_form.html)进行格式整理,之后用MEGA 4.1构建HMGR蛋白系统进化树。
1.2.3 荧光定量PCR 利用实时荧光定量PCR技术分析AcHMGR在菠萝果实的不同发育阶段的表达变化。以菠萝Actin基因[26]作为内参(表1)。从开花后0 d开始,将处理和对照不同发育时期的果实提取RNA后,用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa Bio Inc., Dalian, China)对其反转录获得cDNA后储存于-20 ℃进行备用。实时荧光定量PCR试剂盒为Thermo Scientific DyNAmo ColorFlash SYBR Green qPCR Kit(Thermo),仪器为Roche LightCyclerR 480II荧光定量PCR仪,反应体系及条件参照试剂盒说明书。实时荧光定量PCR中所用引物见表1。
1.3 数据分析
采用SPSS 16.0进行数据分析,实时荧光定量PCR 结果用平均值±标准误(Means±S.E.)表示,对照与处理之间显著性差异分析通过paired-samples t test 进行。
2 结果与分析
2.1 CPPU对菠萝果实重量的影响
在花后15 d和30 d分别对菠萝果实喷施20 mg/L的CPPU,对果实重量影响明显。清水对照单果平均重830.2 g,CPPU处理果实平均增重11.87%,为928.7 g。这点与前期试验结果相类似,对花后20 d和35 d的菠萝果实,喷施20 mg/L CPPU,果实增重9.1%[23],说明适宜浓度的CPPU处理,能提高菠萝果实的重量。
2.2 AcHMGR的克隆及序列分析
以花后30 d的菠萝果实RNA反转录cDNA为模板,以AcHMGRSP1和AcHMGRSP2(表1)为引物,进行PCR后得到1个长度为1 259 bp的片段,通过BLAST分析发现其属于植物HMGR基因家族。之后利用RACE方法分别得到此片段的5′和3′末端序列,拼接这些序列后得到了其cDNA全长,全长2 407 bp。经过BLAST及进化分析,命名为AcHMGR(GenBank登录号分别为KM062072),其开放读码框长度为1 740 bp,编码579个氨基酸,推导的AcHMGR蛋白分子量为60.8 ku,等电点为7.51。
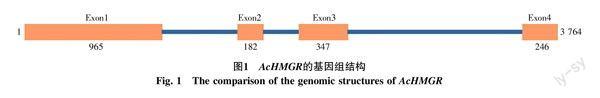
在获得AcHMGR基因的cDNA全长后,分别在其3′-UTR和5′-UTR设计引物,以提取到的菠萝基因组DNA为模板进行PCR,获得AcHMGR的基因组DNA全长,其长度为4 115 bp,从起始密码子到终止密码子的长度为3 764 bp(GenBank登录号为KX375811)。比较AcHMGR mRNA与其基因组DNA全长后发现,从起始密码子到终止密码子,AcHMGR含有3个内含子(Intron)和4个外显子(Exon),各个外显子长度及位置如图1所示。
2.3 AcHMGR蛋白结构及序列分析
在NCBI对AcHMGR序列进行Blastx后发现,其编码的氨基酸与多种植物的3-hydroxy-3-methylglutaryl-coenzyme A reductase(HMGR)相似度较高,其中AcHMGR与小果野蕉(Musa acuminata,
XP_009387500)、水稻(Oryza sativa Japonica Group,XP_015648250)、二穗短柄草(Brachypodium distachyon,XP_003572378)、节节麦(Aegilops tauschii,EMT29532)、 棕櫚(Elaeis guineensis,XP_010927300)相似度较高,分别为85%、85%、83%、83%、82%。部分氨基酸序列对比结果见图2。
將AcHMGR基因推导的氨基酸序列提交到NCBI的保守域数据库(Conserved Domain Database,CDD)进行搜索,发现AcHMGR含有1个HMG-CoA_
reductase_classI(cd00643)保守域,位于第154-557个氨基酸(图3)。
为了确定AcHMGR的系统进化位置,通过搜索NCBI数据库,选取了30个与AcHMGR蛋白同源性较高的其他植物的HMGR氨基酸序列,用MEGA4.1通过Neighbor joining(NJ)法构建了系统发育树。结果显示AcHMGR与小果野蕉(Musa acuminata)、棕榈(Elaeis guineensis)、砂仁(Amomum villosum)遗传距离较近(图4)。
2.4 菠萝果实发育过程中AcHMGR的表达变化
对于对照的菠萝果实,AcHMGR基因的表达量在花后0 d最高,从花后30 d开始,其表达量急剧下降,只为花后0 d的1/3左右,之后其相对表达量不再有明显变化,直到果实成熟(图5)。
20 mg/L的CPPU处理后,显著提高了AcHMGR基因在花后30 d的果实中的相对表达量(p<0.05),为同期对照的1.8倍;但其他时期的相对表达量与对照相比并无明显差异(图5)。
3 讨论
本研究从菠萝果实中克隆得到了1个AcHMGR的cDNA及基因组DNA全长。氨基酸序列多重比对及系统发育树结果显示AcHMGR与EgHMGRR、MaHMGR、AvHMGR有较高的同源性,且具有HMG-CoA_reductase_classI保守域,这些结果表明,AcHMGR为HMGR家族的同源基因,可能与其他HMGR具有相似的结构和功能。
荧光定量PCR结果表明,AcHMGR基因在花后0 d的相对表达量最高,之后急剧下降,这也与前人的研究相吻合[11,14-15]。荔枝LcHMGR2在花期的0 d的相对表达量还较低,但是在花期第7天其表达量急剧上升,达到顶峰,然后在花期14 d后其表达量急剧下降,之后一直维持着一个较低的表达水平,两个LcHMGR基因都在荔枝果实早期发育期间表达量最高,而这个时期是荔枝果实的细胞快速分裂期[14]。菠萝果实为聚合果,小花开放是自下而上,大约持续半个月左右, 从开花开始到花期结束后30 d,果实都处于一个快速的细胞数目增长期[6],AcHMGR基因在花后0 d的表达量最高,也说明了AcHMGR基因可能与菠萝果实细胞分裂相关。
本试验中,20 mg/L的CPPU处理显著提高菠萝的果实,但AcHMGR基因只有在花后30 d的相对表达量与对照相比显著提高,这可能与花后45 d后,菠萝果实细胞分裂已经进入一个平台期有关[6],即CPPU仅能促进AcHMGR基因在细胞快速分裂期的表达。这意味着可以将CPPU的施用时间提早到花后0 d甚至刚开始开花时,因为这个时期菠萝果实正处于细胞快速分裂期[6],这样可能更有利于促进菠萝果实细胞表达,从而有可能提高果实重量。
不同的植物生长调节剂可能通过不同的机制提高果实重量。前期试验结果表明,50 mg/L的赤霉素(GA3)显著提高菠萝果实重量,通过细胞学观察和流式细胞仪检测发现,其主要是通过增大细胞体积从而提高果实重量的[27]。而日本柿喷施CPPU后,延长了薄壁细胞的膨大期并促进了细胞膨大速率,因此提高了果实重量[22]。另一方面,CPPU促进猕猴桃果实发育,其原因可能就是增强了果实调运光合产物的能力,使细胞分裂加快和延长,并促使细胞膨大[20]。在本实验中,CPPU处理增加了AcHMGR基因的相对表达量,同时提高了菠萝果实重量,这说明AcHMGR基因的相对表达量可能与菠萝果实重量相关。但CPPU是通过增大细胞大小还是提高细胞数目的方式从而提高菠萝果实重量,尚需在后续试验中采用组织学观察等方法加以确认。
参考文献
[1] FAO. http://faostat.fao.org/site/567/default.aspx. 2012.[OL]. 2016-05-10.
[2] Mizukami Y. A matter of size: developmental control of organ size in plants[J]. Curr Opin Plant Biol, 2001, 4(6): 533-539.
[3] Chevalier C. 12 Cell cycle control and fruit development[J]. Annual Plant Reviews, Cell Cycle Control and Plant Development, 2007, 32: 269-293.
[4] Tsukaya H. Controlling size in multicellular organs: focus on the leaf[J]. PLoS Biol, 2008, 6(7): e174.
[5] Bartholomew D P, Paull R E, Rohrbach K G. The pineapple: botany, production, and uses[M]. Wallingford, UK: CABI, 2003.
[6] Li Y H, Zhang Z, Sun G M. Changes in cell number and cell size during pineapple(Ananas comosus L.)fruit development and their relationship with fruit size[J]. Aust J Bot, 2010, 58(8): 673-678.
[7] Chappell J. The biochemistry and molecular biology of isoprenoid metabolism[J]. Plant Physiol, 1995, 107: 1-6.
[8] Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 1995, 46(1): 521-547.
[9] McGarvey D J, Croteau R. Terpenoid metabolism[J]. Plant Cell, 1995, 7(7): 1 015-1 026.
[10] Learned R M, Fink G R. 3-Hydroxy-3-methylglutaryl-coenzyme A reductase from Arabidopsis thaliana is structurally distinct from the yeast and animal enzymes[J]. Proc Natl Acad Sci USA, 1989, 86(8): 2 779-2 783.
[11] Cowan A K, Moore-Gordon C S, Bertling I, et al. Metabolic control of avocado fruit growth(isoprenoid growth regulators and the reaction catalyzed by 3-hydroxy-3-methylglutaryl coenzyme A reductase)[J]. Plant Physiol, 1997, 114(2): 511-518.
[12] Lange B M, Rujan T, Martin W, et al. Isoprenoid biosynthesis: the evolution of two ancient and distinct pathways across genomes[J]. Proc Natl Acad Sci USA, 2000, 97(24): 13 172-13 177.
[13] Narita J O, Gruissem W. Tomato hydroxymethylglutaryl-CoA reductase is required early in fruit development but not during ripening[J]. Plant Cell, 1989, 1(2): 181-190.
[14] Rui X, Caiqin L, Wangjin L, et al. 3-Hydroxy-3-methylglutaryl coenzyme A reductase 1(HMG1)is highly associated with the cell division during the early stage of fruit development which determines the final fruit size in Litchi chinensis[J]. Gene, 2012, 498(1): 28-35.
[15] Ezura H, Hiwasa-Tanase K. Fruit development[M]. // Pua E C, Davey M R(eds). Plant developmental biology - biotechnological perspectives, vol 1. Springer, Berlin, 2010: 301-318.
[16] Kobayashi T, Kato-emori S, Tomita K, et al. Transformation of tomato with the melon 3-hydroxy-3-methylglutaryl coenzyme A reductase leads to increase of fruit size[J]. Plant Biotech, 2003, 20(4): 297-303.
[17] Omura T, Watanabe S, Iijima Y, et al. Molecular and genetic characterization of transgenic tomato expressing 3-hydroxy-3-methylglutaryl coenzyme A reductase[J]. Plant Biotechnol, 2007, 24(1): 107-115.
[18] Paroussi G, Voyiatzis D G, Paroussis E, et al. Growth, flowering and yield responses to GA3 of strawberry grown under different environmental conditions[J]. Sci Hort, 2002, 96(1): 103-113.
[19] Shargal A, Golobovich S, Yablovich Z, et al. Synthetic cytokinins extend the phase of division of parenchyma cells in developing pear(Pyrus communis L.)fruits[J]. J Hortic Sci Biotechnol, 2006, 81(5): 915-920.
[20] 方金豹, 黃宏文, 李绍华. CPPU对猕猴桃果实发育过程中糖、酸含量变化的影响[J]. 果树学报,2002,19(4): 235-239.
[21] 范国荣, 肖会员, 刘善军, 等. N-(2-氯-4-吡啶基)-N'-苯基脲(CPPU)对甜柿果实中淀粉、 还原糖含量和淀粉酶活性的影响[J]. 植物生理学通讯, 2006, 42(3): 454-456.
[22] Hamada K, Hasegawa K, Ogata T. Strapping and a synthetic cytokinin promote cell enlargement in ‘Hiratanenashi Japanese persimmon[J]. Plant Growth Regul, 2008, 54(3): 225-230.
[23] 李运合, 孙光明. 喷施外源CPPU和GA对菠萝果实品质的影响[J]. 热带作物学报, 2009, 30(9): 1 252-1 255.
[24] Boyce R, Chilana P, Rose T M. iCODEHOP: a new interactive program for designing COnsensus-DEgenerate Hybrid Oligonucleotide Primers from multiply aligned protein sequences[J]. Nucleic Acids Res, 2009, 37: W222-W228.
[25] Fu X, Deng S, Su G, et al. Isolating high-quality RNA from mangroves without liquid nitrogen[J]. Plant Mol Biol Rep, 2004, 22(2): 197-197.
[26] Li Y H, Wu Q S, Huang X, et al. Molecular cloning and characterization of four genes encoding ethylene receptors associated with pineapple(Ananas comosus L.)flowering[J]. Front Plant Sci, 2016, 7: 710.
[27] Li Y H, Wu Y J, Wu B, et al. Exogenous gibberellic acid increases the fruit weight of ‘Comte de Paris pineapple by enlarging flesh cells without negative effects on fruit quality[J]. Acta Physiol Plant, 2011, 33(5): 1 715-1 722.

