山东小麦蠕孢根腐病病原鉴定及致病力分析
张眉 姜珊珊 吴斌 王升吉 赵玖华 辛相启

摘要:本研究首先利用形态学和分子生物学方法,对25株在山东采集分离的小麦根腐病菌进行了鉴定,后采用刺伤接种法对菌株的致病性进行了测定。鉴定结果表明,25个菌株均为麦根腐离蠕孢[Bipolaris sorokiniana (Sacc.) Shoemaker],属半知菌亚门离蠕孢属真菌。接种试验表明,25个麦根腐离蠕孢菌株均具有致病性,但从系统聚类图可以看出,不同菌株间存在致病力分化,可分为强、中、弱3种致病力类型,其中,中等致病力菌株为优势菌株。同时,菌株的致病力强弱与其地理来源没有相关性。
关键词:小麦根腐病;麦根腐离蠕孢;病原鉴定;致病力分析
中图分类号:S435.121.4+7文献标识号:A文章编号:1001-4942(2016)10-0117-04
小麦根腐病(Wheat common rot)是小麦生产上的重要病害之一,可造成小麦苗枯、叶枯、穗枯,给小麦产量带来重大损失。该病害在我国各麦区均有发生,近年来在山东有逐年加重的趋势。20世纪70年代之前,人们认为小麦根腐病病原物是单一病菌长蠕孢[1],之后国内外研究却发现,该病是由多种病原物混合侵染引起的,主要病原物有蠕孢菌、镰孢菌、丝核菌、链格孢菌等[1-4]。张德珍等[5]研究结果表明,山东小麦根腐病病原物主要为麦根腐离蠕孢[Bipolaris sorokiniana (Sacc.) Shoemaker]和镰孢属(Fusarium sp.)真菌,其中,B.sorokiniana为优势菌群。真菌的致病性研究为病菌遗传变异、病菌致病机理、病害防治等方面提供理论依据,但从现有报道来看,有关山东地区小麦根腐病蠕孢菌的致病性研究较少,而能够准确鉴定得到蠕孢菌株是研究其致病性的关键。真核生物的核糖体内转录间隔区(Internal transcribed space, ITS)在种内相对保守,在科、属、种水平上具有序列特异性,已被广泛用于病原诊断、微生物分类鉴定、系统发育等研究[5,6]。因此,本研究利用传统形态学与rDNA-ITS序列分析相结合的方法,鉴定得到了25个小麦根腐病离蠕孢菌株,通过苗期小麦接种,明确了山东小麦根腐离蠕孢菌的致病性特点,以期为探明该菌的致病机理、培育抗病品种等研究奠定理论基础,为山东地区小麦品种布局和根腐病防治提供参考。
1材料与方法
1.1供试菌株
在山东不同地区采集小麦根腐病病样,分离纯化得到25个菌株,见表1。
1.2病原菌鉴定
1.2.1形态学鉴定将25株供试菌株接种于PDA培养基平板,28℃黑暗培养,观察菌落形态。用接种针挑取菌体,在光学显微镜下观察分生孢子梗和分生孢子形态。
1.2.2分子鉴定收集25株菌株菌丝体,用美国Omega Bio-Tek公司的HP Fungal DNA Kit试剂盒提取菌株基因组作为模板,用通用引物ITS1F(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4R(5′-TCCTCCGCTTATTGATATGC-3′)扩增rDNA-ITS序列。PCR扩增条件为:94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸33 s,30个热循环;72℃终延伸10 min。用上海生工公司的SanPrep柱式DNA胶回收试剂盒回收目的片段,连接T载体转化大肠杆菌感受态DH5α,送由上海博尚公司完成测序。通过NCBI对ITS序列进行Blast分析。
1.3菌株致病性测定
将25株菌株分别接种于PDA培养基,28℃黑暗培养15 d。选用小麦济南15作为接种寄主,待小麦长至4叶1心期,用接种针挑取离蠕孢菌,然后在小麦茎部刺伤接种。每个菌株接种20株小麦,不带菌刺伤接种作负对照。接种后伤口处喷水以利于病菌侵染。将接种小麦放置于塑料箱体中,箱体顶部覆盖塑料膜。光照条件为8 h光照16 h黑暗,相对湿度控制在80%左右。接种7 d后,统计发病植株数量,测量病斑长度,计算发病率和平均病斑长度。发病率(%)=发病植株数量/总接种植株数量×100,平均病斑长度=∑(每个接种植株的病斑长度)/总接种植株数量。
利用DPS 7.05软件中的Duncans新复极差法对不同菌株的平均病斑长度进行显著性差异分析,并采用UPGMA法对菌株致病力进行系统聚类分析。
2结果与分析
2.1菌株的形态学鉴定
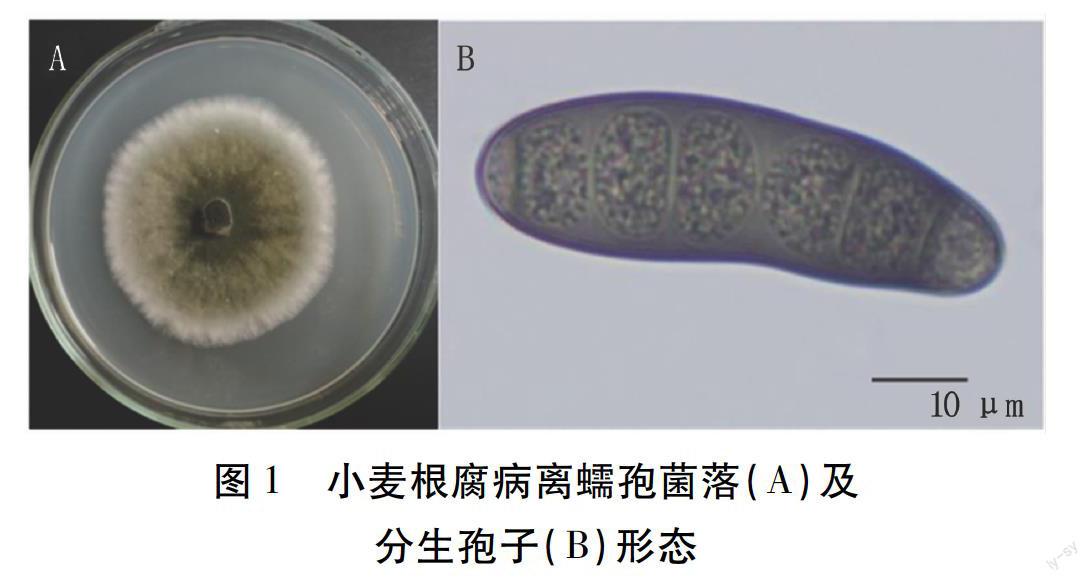
供试菌株在PDA培养基上28℃培养,菌落近圆形,深榄褐色,菌落边缘菌丝白色,气生菌丝生长繁茂,白色(图1A)。镜检观察,分生孢子梗细长,多隔膜,无分支,上部呈屈膝状弯曲。分生孢子多细胞,具假隔膜,黑褐色,长梭形或纺锤形,直或弯曲,两端渐细(图1B)。初步确定,供试25个菌株为麦根腐离蠕孢[Bipolaris sorokiniana(Sacc.)Shoemaker],属半知菌亚门离蠕孢属真菌。
2.2菌株的分子鉴定
用通用引物ITS1F/ITS4R扩增得到一条约600 bp的条带(图2),测序结果显示供试25个菌株的rDNA-ITS序列均为586 bp。在NCBI上进行Blast分析,结果表明,所有菌株的ITS序列均与GenBank中登录号为KM066949.1的Bipolaris sorokiniana高度同源,同源性在99%以上。说明,25个菌株均为小麦根腐离蠕孢菌。同时,菌株间比对发现,ITS序列有99%以上都是一致的,由此看来,山东省不同地理来源的小麦根腐病离蠕孢菌在种内遗传上是高度保守的。
2.3菌株致病力
供试麦根腐离蠕孢菌株接种7 d后调查发现,所有菌株接种发病率均为100%,说明25个菌株均有致病性。由图3可以看出,这些菌株虽然都有致病性,但平均病斑长度有所不同,其中LL1菌株平均病斑长度最长,可达4.37 cm,而HY3菌株最小,仅为0.4 cm。显著性水平分析结果表明,25个菌株致病力存在差异,说明,山东不同小麦根腐病离蠕孢菌株存在致病力分化现象。
对25个麦根腐离蠕孢菌株的致病力进行聚类分析,由图4可以看出,大致可聚类为3个分支。第Ⅰ分支有CQ1、CQ2、HY1、HY3、HY6、CY2、CY4、HM3和ZF2共9个菌株,均为弱致病力菌株,占供试菌株的36%;第Ⅱ分支有6个菌株,分别是LL1、HY2、HY4、HY5、CY6和HM2,均为强致病力菌株,占供试菌株的24%;第Ⅲ分支为中等致病力菌株,共10个菌株,占供试菌株的40%。因此,山东小麦根腐病离蠕孢菌可分为强、中、弱3种致病力类型菌株,其中,中等致病力菌株占优势。
此外,由图4还可以看出,潍坊昌邑(CY)、德州惠民(HM)和烟台海阳(HY)均有强、中、弱3种致病力类型的菌株,也就是说,同一地理来源的不同菌株致病力存在分化。同时,在同一致病力类型中,包含有来自不同地理来源的菌株。由此说明,小麦根腐病离蠕孢菌株的致病力强弱与菌株的地理来源没有相关性。
3讨论与结论
真核生物rDNA的18S、5.8S和28S序列高度保守,ITS是位于18S-5.8S-28S之间的非编码转录间隔区,其在进化过程中承受的选择压力较小,相对进化速度较快,因此,ITS序列既具有保守性,又具有序列多态性,能够有效地用于病原微生物的分类鉴定。本研究首先通过传统形态学鉴定,对25个小麦根腐病菌株的菌落、分生孢子梗及分生孢子的形态进行观察,初步确定均为麦根腐离蠕孢。进一步利用分子鉴定方法扩增其rDNA-ITS序列进行Blast比对分析,结果表明,所有菌株的ITS序列与登录号为KM066949.1的Bipolaris sorokiniana同源性在99%以上,因此,这25个菌株被鉴定为小麦根腐离蠕孢菌,与形态学鉴定结果一致。张德珍等[5]也利用形态学鉴定方法和扩增ITS序列的分子鉴定方法,成功地对山东省小麦根腐病病原蠕孢菌进行了鉴定。
本研究通过刺伤接种法,将麦根腐离蠕孢接种于小麦幼苗,结果表明,25个小麦根腐病离蠕孢菌都有致病性,但存在致病力差异,可分为强、中、弱3种致病力类型,其中,中等致病力菌株为优势菌,占总菌株数的40%。目前,普遍认为Bipolaris sorokiniana是一种致病性具有较高变异水平的真菌[7,8]。Jaiswal[7]、Aggarwal[9]等在研究中都发现,供试B.sorokiniana菌株均有致病性,但致病力有所不同,这与本研究结果一致。对于麦根腐离蠕孢易于变异的特点,Tinline[10]认为这是由B.sorokiniana的异核现象和准性循环造成的,同时,Chand等[8]研究还发现,有两个细胞核的菌株致病力较强,其他致病力程度的菌株多为3~4个细胞核,因此他们认为,B.sorokiniana表现出的致病力多样性可能与细胞核的不同组合有关。本研究还可以看出,在25个小麦根腐病离蠕孢菌株中,HY3菌株的致病力最弱,其侵染后的平均病斑长度仅有0.4 cm。因此,我们可以将该菌株作为一个抗性评价菌株,用于小麦根腐病的抗病育种研究。此外,我们还发现,采自同一地区的不同菌株的致病力存在差异,而属于同一致病力类型的菌株也可以是来自不同地区,由此说明,山东省不同小麦根腐病离蠕孢菌株的致病力差异与其地理来源没有相关性。又因麦根腐离蠕孢菌在致病性上有较高的变异性,故而增加了小麦根腐病的防治困难,因此,在生产上选用抗病品种、定期轮换品种是防治小麦根腐病的有效手段。
参考文献:
[1]张庆平,李子钦,张建平,等. 国内外小麦根腐病研究概况[J]. 内蒙古农业科技,1996(4):7-11.
[2]Hill J P, Fernandez J A, McShane, M S. Fungi associated with common root rot of winter wheat in Colorado and Wyoming[J]. Plant Disease, 1983, 67: 795-797.
[3]袁淑芳. 小麦根腐病蠕形菌寄主范围试验[J]. 植物保护,1983(2):19.
[4]冯之杰,郭会芳,徐瑞福. 高产麦区小麦根腐病病原菌鉴定及综合防治技术[C]//马万杰,原国辉,李洪连. 河南省植保学会第十次、河南省昆虫学会第九次、河南省植病学会第四次会员代表大会暨学术讨论会论文集. 洛阳:河南省植物保护学学会、河南省昆虫学会、河南省植物病理学会出版,2013:12-14.
[5]张德珍,李鹏昌,陈晓霞,等.山东省小麦根腐病病原菌的分离鉴定[J]. 植物保护学报,2016,43(2):233-240.
[6]徐丽,陈新,魏海蓉,等. 核桃种质资源rDNA-ITS 序列分析[J]. 山东农业科学,2016,48(3):1-4.
[7]Jaiswal S K,Sweta, Prasad L C, et al.Identification of molecular marker and aggressiveness for different groups of Bipolaris sorokiniana isolates causing spot blotch disease in wheat (Triticumaestivum L.)[J]. Current Microbiology, 2007, 55: 135-141.
[8]Chand R, Pandey S P, Singh H V, et al. Variability and its probable cause in the natural populations of spot blotch pathogen Bipolaris sorokiniana of wheat (T.aestivum L.)in India[J]. Journal of Plant Diseases and Protection, 2003, 110: 27-35.
[9]Aggarwal R, Singh V B, Gurjar M S, et al. Intraspecific variations in Indian isolates of Bipolaris sorokiniana infecting wheat based on morphological,pathogenic and molecular characters[J]. Indian Phytopath, 2009, 62(4): 449-460.
[10]Tinline R D.Cochliobolus sativus: V. heterokayosis and parasexualtity[J]. Canadian Journal of Botany, 1962, 40: 425-437.

