基于吉布斯弯曲界面相平衡判据的开尔文方程推导
肖赛君* 章 俊 尹振兴 王 振 刘 健(安徽工业大学冶金工程学院,安徽 马鞍山 243002)
基于吉布斯弯曲界面相平衡判据的开尔文方程推导
肖赛君*章 俊 尹振兴王 振刘 健
(安徽工业大学冶金工程学院,安徽 马鞍山 243002)
摘要:对两种界面热力学处理方法(古根海姆法与吉布斯法)进行了介绍。采用吉布斯界面热力学方法建立了存在界面相时两相平衡的热力学判据,并以此为基础提出了一种新的开尔文方程推导方法。
关键词:开尔文方程;古根海姆界面热力学;吉布斯界面热力学
开尔文方程是界面现象中的一个重要公式。现有的物理化学教材对其推导方法可以分成两大类[1],第一类是以基于古根海姆界面热力学方法(简称古根海姆法)的弯曲界面相平衡热力学判据进行推导[2];第二类是基于始终态相同时不同途径其状态函数的改变量相同的方法进行推导[3–8]。本文作者在教学中发现,第一类方法和第二类方法均直接或间接使用了吉布斯界面热力学方法(简称吉布斯法),于是,本文采用吉布斯界面热力学方法建立了存在界面相时两相平衡的热力学判据,并以此为基础提出了一种新的开尔文方程推导方法。该方法直接从相平衡的热力学第二定律出发进行推导,热力学意义明确,推导过程简洁明了。
1 建立界面热力学的两种方法
界面热力学的研究方法有吉布斯法和古根海姆法,在表面化学的教材中一般称为相界面法和界面相法[9]。吉布斯提出的表面热力学方法早于古根海姆,但考虑到古根海姆法建立的模型相对于吉布斯法更直观易懂,本节首先介绍古根海姆法。
古根海姆法的关键之一是承认一个具有一定体积的界面相存在,其物理模型见图1。假设一个由和两个体相以及一个界面相构成的热力学系统。界面相存在一定的厚度,一般为纳米级。对于溶液,界面相自身的浓度介于两个体相浓度之间,其强度性质由相到相是逐渐变化的。
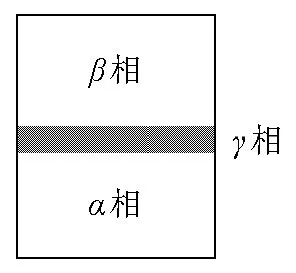
图1 存在界面相时两相平衡示意图
按照常规的热力学处理思路,可以将整个体系看成由3个独立的相组成,各相自由能的变化即为体系自由能的变化,见式(1)。

由于界面相的厚度和物质的量等无法确定,具体每一相的吉布斯自由能的变化很难定量求解。定性上考虑,每一相吉布斯自由能微分表达式见式(2)–式(4)。


图2 吉布斯假想界面两相平衡示意图

图2 吉布斯假想界面两相平衡示意图
以上方法被称为古根海姆法[3]。
吉布斯法的关键在于提出了一种界面相模型,并在此基础上建立了吉布斯界面热力学理论。如图2所示,吉布斯将图1中的界面相抽象为无厚度、无体积的几何界面相,用表示。
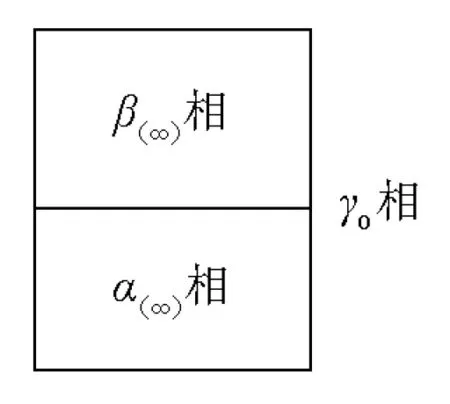
图2 吉布斯假想界面两相平衡示意图
在图2所示假想相界面的基础上,吉布斯认为在恒温恒压与物质的量不变的时候,外力做功使得体系表面积增加。该过程中,整个体系吉布斯自由能的变化可以认为仅仅是由于表面积的增大而增加了(式(5)),而和两相的吉布斯自由能在该表面积变化过程中保持不变。

所以,对恒温恒压以及物质的量不变,仅体系的表面积变化的过程,整个体系吉布斯自由能的微分表达式见式(6)和式(7)。

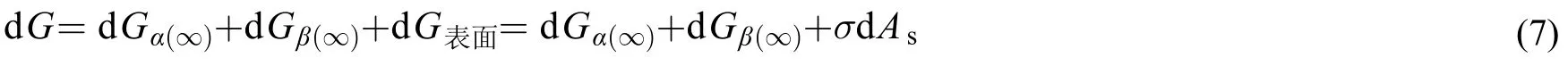
式(6)和式(7)即吉布斯界面热力学的基本公式。该公式巧妙地避开了图1所示界面相的厚度问题,不直接求解其吉布斯自由能的具体表达式和具体值,而只考虑整个三相体系总的吉布斯自由能变化值。在应用热力学第二定律时,只需要知道体系的总自由能变化值即可,由此,也可以看出热力学方法自身的特点。
2 有界面相时两相相平衡的热力学判据
既然界面热力学存在两种研究方法,在建立弯曲界面相平衡判据时,也可以采用两种方法分别建立。在王竹溪[2]著《热力学简程》中,对有界面相时两相平衡的热力学判据进行了推导,其依据的热力学方法是以图1为界面模型的古根海姆法。所得的结论为:对于平界面和弯曲界面,相平衡的条件是两个体相A和B化学势相等,其中A为气体,B为液体(式(8))。

既然依据古根海姆法可以建立有界面相时两相相平衡判据,那么采用吉布斯法应该也可行。开尔文方程是描述弯曲液体的饱和蒸气压变化,所以本节以气液两相平衡为例,采用吉布斯界面热力学基本方程来推导。
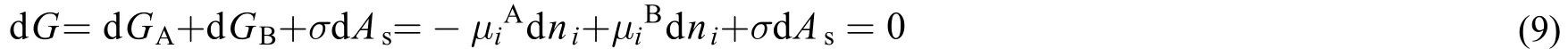
2.1 界面相为平面
当相界面为平面时,气相A中的某组元进入液相B中,并没有使界面相的面积增加,所以。这表明,当界面相为平面时,物质转移没有使表面相面积增加或减小,相平衡的热力学判据与不考虑界面相相同,见式(10)。

2.2 界面相为弯曲面
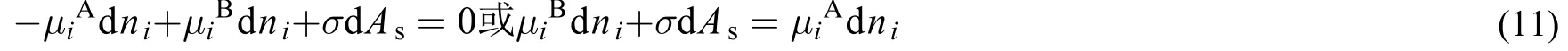
式(10)和式(11)就是考虑界面相时两相达到平衡的热力学判据,在此我们称之为基于吉布斯法的界面相相平衡判据。
在国内教材中,胡英[4]编著的《物理化学》专门指出了界面相为平面时,两相平衡的条件仍是化学势相等,即式(10),也指出了界面相为弯曲面时,平衡条件有所变化。很可惜的是,该教材没有介绍以吉布斯法为基础的弯曲界面相平衡条件,即式(11)。在推导开尔文方程时,也没有从相平衡的热力学判据出发。
3 基于吉布斯弯曲界面相平衡判据的开尔文方程推导
本节采用吉布斯法建立的弯曲界面相平衡判据公式(式(11))进行开尔文方程推导,并与现有开尔文方程推导方法进行对比分析。
3.1开尔文方程推导新方法
下面将开尔文方程用于描述液体存在弯曲界面时,与之平衡的气相饱和蒸气压增加的现象。假设存在弯曲面的液滴为纯物质,当与气相达到平衡时,依据式(11),可以得出式(12)。


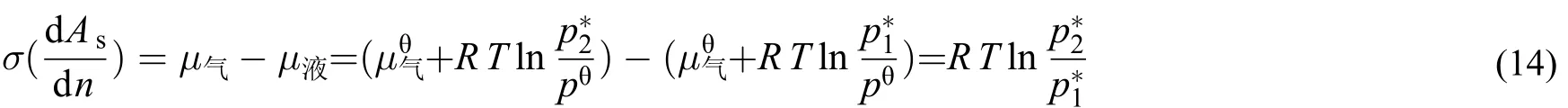

式(15)即开尔文方程。
上述推导方法是直接以气液平衡为研究对象,采用从热力学第二定律推导的相平衡热力学判据(即式(11)提供的平衡判据)进行分析。
3.2其他开尔文方程推导方法分析
开尔文方程的推导方法较多[2–8],李爱昌[1]曾对此进行总结,开尔文方程的推导方法大致可以分为两类:第一类是基于气液平衡时化学势相等的方法,该方法的依据是以古根海姆法为基础建立的有界面相时两相相平衡判据;第二类是基于始终态相同时不同途径其状态函数的改变量相同的方法。
在王竹溪[2]所著《热力学简程》中,采用了第一类方法推导开尔文方程,该推导过程需要采用拉普拉斯公式计算附加压力,而拉普拉斯公式的热力学推导方法是吉布斯法。如果能够直接从吉布斯法建立的弯曲面相平衡判据出发,在抓住两相平衡热力学本质的前提下,可使推导方法更加简洁,思路更加清晰。毕竟相比于古根海姆法,吉布斯法在处理界面热力学时更方便。
相比于第一类推导方法,第二类推导方法为大多数教材所采用[3–7]。该方法采用等温循环方法推导(图3)。在过程Ι中,有dn的平面液滴变成了蒸气。
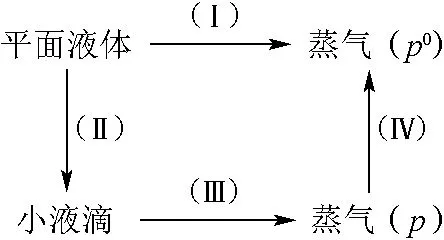
图3 基于始终态相同的不同热力学途径构造[1]
该类推导方法的主要区别在于平面液体变为小液滴时(过程ΙΙ)吉布斯自由能变化的计算。文献[6]认为,该计算方法的依据是吉布斯法建立的界面热力学。文献[7]认为dn的平面液体变成小液滴之后,压强增加了,所以,。不同计算过程得到的结果是相同的,因为计算附加压力的拉普拉斯公式也可由吉布斯法推导。第二类推导方法尽管采用了吉布斯界面热力学,但没有从相平衡的热力学判据出发,使得推导过程物理意义不明确,较难理解。
4 结 论
① 依据吉布斯界面热力学,当界面相为平面时,两相平衡的热力学判据为;当?界面相为曲面时,两相平衡的热力学判据为
② 基于吉布斯界面热力学理论及其推演得到的存在界面相时相平衡热力学判据可以推导出开尔文方程。该推导过程基于相平衡的热力学第二定律,物理模型清晰,推导过程简洁,热力学意义明确。
参 考 文 献
[1]李爱昌. 大学化学, 2013, 28 (2), 81.
[2]王竹溪. 热力学简程. 北京: 人民教育出版社, 1964.
[3]傅 鹰. 化学热力学导论. 北京: 科学出版社, 1964.
[4]胡 英. 物理化学. 第5版. 北京: 高等教育出版社, 2007.
[5]傅献彩, 沈文霞, 姚天扬, 侯文华. 物理化学(下册). 第5版. 北京: 高等教育出版社, 2006.
[6]李松林, 周亚平, 刘俊吉. 物理化学(下册). 第5版. 北京: 高等教育出版社, 2009.
[7]印永嘉, 奚正楷, 张树永, 张忠诚, 范世领. 物理化学简明教程. 第4版. 北京: 高等教育出版社, 2007.
[8]Berg, J. C. An Introduction to Interfaces of Colloids: The Bridge to Nanoscience; World Scientific Publishing Co. Pte. Ltd.: Singapore, 2009.
[9]顾惕人. 表面化学. 北京: 科学出版社, 1994.
• 师生笔谈•
Derivation of Kelvin Equation for the Phase Equilibrium between the Curved Interface Based on Gibbs Thermodynamics
XIAO Sai-Jun*ZHANG Jun YIN Zhen-Xing WANG Zhen LIU Jian
(School of Metallurgy Engineering, Anhui University of Technology, Ma’anshan 243002, Anhui Province, P. R. China)
Abstract:In this paper, two interface thermodynamics methods, the Guggenheim method and the Gibbs method, are introduced. The thermodynamic criterion of the two-phase equilibrium is established using Gibbs interface thermodynamics, and a new method for derivation of Kelvin equation is put forward based on the thermodynamic criterion of the two-phase equilibrium.
Key Words:Kelvin Equation; Guggenheim interface thermodynamics; Gibbs interface thermodynamics
基金资助:国家自然科学基金(51204001,51404001)
*通讯作者,Email: jxddroc@126.com
doi:10.3866/pku.DXHX20160159www.dxhx.pku.edu.cn
中图分类号:O64;G64

