不同制剂类型胸腺五肽药效成分含量稳定性分析*
薛洪宝, 常华兰, 梁丽丽, 张 晖, 马 涛, 金荣富, 张成陕, 宫文武
(1 蚌埠医学院,安徽 蚌埠 233030;2 安徽宏业药业有限公司,安徽 蚌埠 233045;3 安徽省蚌埠市食品药品监督管理局,安徽 蚌埠 233000)
不同制剂类型胸腺五肽药效成分含量稳定性分析*
薛洪宝1, 常华兰1, 梁丽丽1, 张 晖1, 马 涛1, 金荣富2, 张成陕2, 宫文武3
(1 蚌埠医学院,安徽 蚌埠 233030;2 安徽宏业药业有限公司,安徽 蚌埠 233045;3 安徽省蚌埠市食品药品监督管理局,安徽 蚌埠 233000)
采用反相高效液相色谱法分别对胸腺五肽三种制剂类型:水针、粉针、固体制剂的各10个批次制剂成品进行药效成分含量测定,并对其药效成分的含量进行合格评定。经研究发现,水针、粉针剂型药效成分含量较高,而固体制剂部分含量偏低,可能是由于水针、粉针剂型为无菌制剂,胸腺五肽在无菌条件下,且基质成分单一情况下不易分解变质,而固体制剂肠溶片,为非无菌制剂,另外,片剂对应的药用辅料成分较为错综复杂,对胸腺五肽稳定性有不利影响。开发能使胸腺五肽固体制剂药效成分稳定的辅料成分,对提高胸腺五肽固体制剂生物利用度有较高应用价值。
胸腺五肽;稳定性;高效液相色谱法;注射液;固体制剂
胸腺生成素Ⅱ是从胸腺激素中分离出来的单一多肽类化合物[1],由49个氨基酸组成,而其中第32~36位的5个氨基酸残基片段组成的肽链片段,仍具有与胸腺生成素Ⅱ相同的生理功能,因而称此五肽片段为胸腺五肽(thymopentin),其分子结构如图 1所示,纯品为白色冻干疏松块状物或粉末。胸腺五肽具有胸腺生成素的生物学活性及胸腺肽的生理功能与药效。
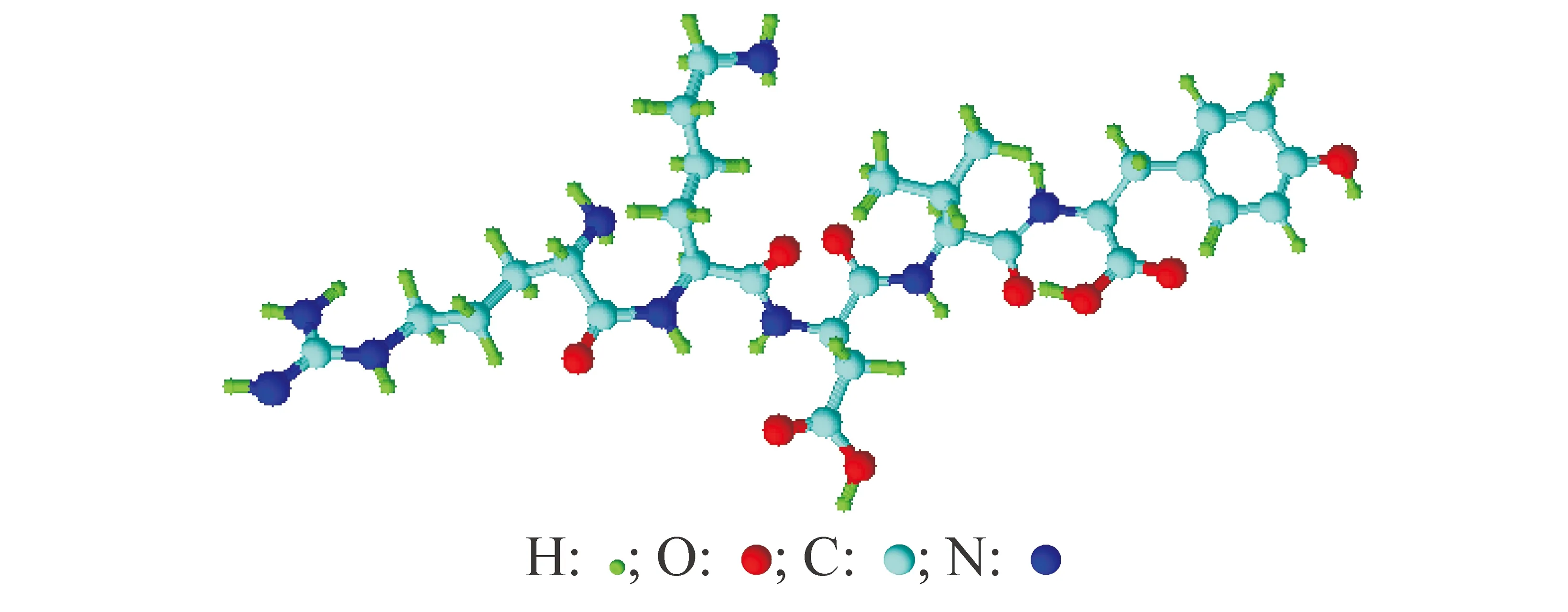
图1 胸腺五肽分子结构图[2]Fig.1 Molecular structure of thymopentin
胸腺五肽在临床上主要用于治疗恶性肿瘤辅助治疗、慢性肝炎、自身免疫功能紊乱性疾病、儿童先天性免疫缺陷病、类风湿性关节炎、系统性红斑狼疮等[4]。胸腺五肽的作用之一是诱导T细胞分化[5],它可选择性地诱导Thy-1-的前胸腺细胞转化为Thy-1+的T细胞,其T细胞分化作用由胞内cAMP水平升高介导。胸腺五肽的另一基本作用是对成熟外周血T细胞的特异受体结合,能使胞内cAMP水平上升,进而诱发一系列胞内反应,此为其免疫调节功能基础[6]。在正常机体状态下胸腺五肽表现为免疫刺激作用,能显著增高脾淋巴细胞的E玫瑰花结形成率及转化率,对免疫应答的初次或再次反应的不同阶段均有增强作用,能增多IgM类型和IgG或IgA类型的抗体形成细胞。胸腺五肽还可增强巨噬细胞的吞噬功能,增加多形核嗜中性白细胞的酶和吞噬功能,升高循环抗体含量,增强红细胞免疫功能。胸腺五肽能活化CD4和CD8阳性细胞,使专一的Tc细胞寿命维持更长时间,同时也可活化Th细胞,诱导Ts细胞的功能。胸腺五肽的抗感染力和治疗作用与其能增进TC细胞活性相关[7]。在抗感染免疫中适量胸腺五肽可明显增加干扰素的产生,诱导和促进T细胞分化成熟,调节T淋巴细胞亚群比例使CD4/CD8趋于正常[8],增强巨噬细胞吞噬功能,增强红细胞免疫功能,提高自然杀伤细胞的活力,提高白介素-2的产生水平与受体表达水平,增强外周血单核细胞γ干扰素的产生,增强血清中SOD活性。可用于恶性肿瘤病人经放疗、化疗后,免疫功能损伤者;乙型肝炎的治疗;重大外科手术及严重感染;自身免疫性疾病,如类风湿性关节炎,红斑狼疮;Ⅱ型糖尿病、更年期综合征;年老体衰免疫功能低下者等病患群体[9]。
胸腺五肽注射于人体后,会很快被蛋白酶和氨肽酶降解为游离氨基酸,其药物原型半衰期很短,仅为30 s,临床给药方式为每日1次静脉或皮下注射。将胸腺五肽制成长效缓释制剂,能有效解决药物口服生物利用度低以及注射频繁等问题,提高了患者用药质量[10]。目前,市场销售的胸腺五肽制剂以水针注射剂为主,此外包括粉针剂、片剂等。关于注射胸腺五肽(水针、粉针)稳定性和胸腺五肽肠溶片含量稳定性的研究报道较少,而在此类制剂制备过程中,常涉及到影响药物稳定性因素。因此,采用高效液相色谱法对注射胸腺五肽液(水针、粉针)及固体制剂肠溶片含量稳定性进行初步考察,为相关制剂的研发、制备奠定基础[11-12]。
1 实验部分
1.1 仪器与试剂
仪器:Agilent 1260 LC型高效液相色谱仪系统(G1312C VL型二元梯度泵,G1329B型自动控温及自动进样系统,配有G1330B型自动进样器恒温模块,G4121A/B型二极管阵列检测器,Agilent Technologies Co., Ltd. USA);雷磁PHSJ-5型pH计(精度:0.001 pH值单位,上海仪电科学仪器股份有限公司);BSM-220.4型万分之一电子天平(精度:0.000 1 g,上海卓精电子科技有限公司);微孔膜过滤器及相应滤膜(0.45 μm, 江苏省盐城市超宇电子科技有限公司);UP100HE型数控通用超声波清洗机(南京垒君达超声电子设备有限公司)。
试剂:胸腺五肽标准对照品(thymopentin,MW为680, 上海广锐生物科技有限公司);注射用胸腺五肽水针10个批次(每支10 mg,批号见表1,北京某药业股份有限公司出品);注射用胸腺五肽粉针10个批次(每支10 mg,批号见表1,广东某特药有限公司出品);胸腺肽肠溶片10个批次(每片20 mg,批号见表1,黑龙江某药业集团有限公司出品);仪器稳定性验证光谱标准样对照品:苯、甲苯、邻二甲苯、间二甲苯、对二甲苯(光谱纯,广州市仪德科学仪器有限公司);甲醇(色谱纯,Fisher Scientific实验器材(上海)有限公司);二水磷酸二氢钠(NaH2PO4·2H2O,分析纯);十二水磷酸一氢钠(Na2HPO4·12H2O,分析纯);二次蒸馏水。
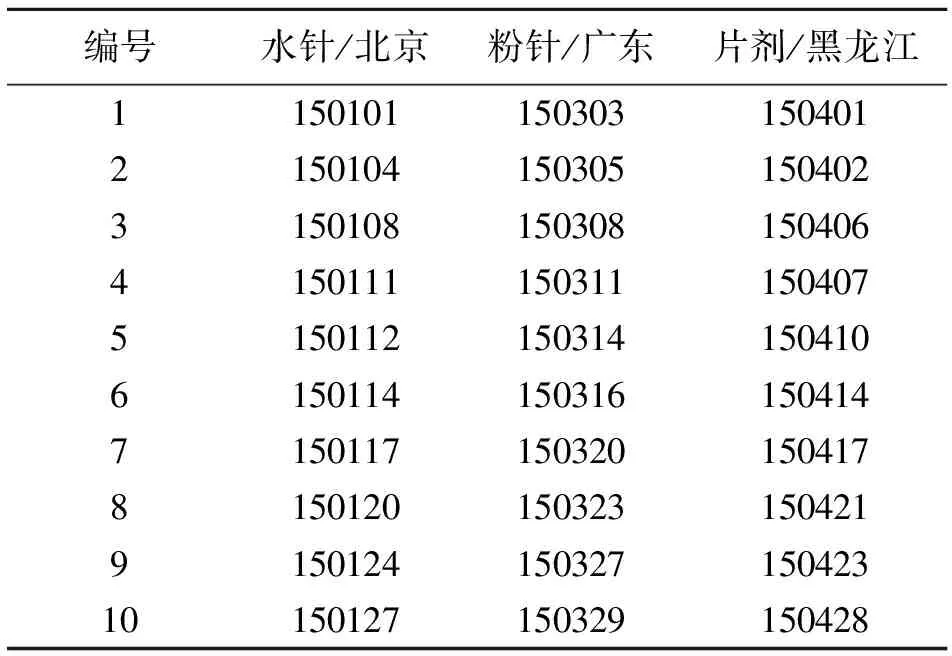
表1 不同剂型、产地的胸腺五肽产品批号
1.2 相关溶液的配制
1.2.1 色谱流动相的配制 方法验证使用的流动相为φ=100%色谱纯甲醇,不需配制,直接使用;胸腺五肽测定所用流动相为:NaH2PO4-Na2HPO4缓冲液(pH7.0)/甲醇,体积比为90∶10,采用如下方法配制:分别准确称取NaH2PO4·2H2O71.6g,Na2HPO4·12H2O31.2g,用二次蒸馏水配制成1 000mL溶液,即得到0.2mol/L溶液。再分别取配好后的NaH2PO4溶液约38mL,用pH计测定溶液pH值,再加入配好后的Na2HPO4约62mL,使缓冲溶液pH值为7.0左右,再在缓冲溶液中加入1/9体积的甲醇,即得要求的色谱流动相,流动相使用前应超声脱气。
1.2.2 标准品及样品溶液的配制 准确称取一定量的苯、甲苯、邻二甲苯、间二甲苯、对二甲苯(精确到0.000 1g),用甲醇溶解,定容,配制成标准溶液。采用类似的方法准确称取胸腺五肽标准对照品适量(精确到0.000 1g),用色谱流动相(NaH2PO4-Na2HPO4缓冲液(pH7.0)/甲醇,体积比为90∶10)配制成标准对照品溶液。采用上述方法准确量取或称取各个批次的胸腺五肽水针制剂、粉针制剂和固体制剂,分别配制成待分析样品溶液。将上述溶液置于4 ℃下保存待测,分析测定前用0.45μm滤膜过滤。
1.3 实验方法
根据国家药典要求[13-14],并对其方法进行适当优化,采用优化后的胸腺五肽含量分析色谱条件:色谱柱:ZorbaxEclipseXDB-C18250mm×4.6mm, 5μmColumn(P/N993967-902/5063- 6600)填料色谱柱;柱温:25 ℃;检测器:二极管阵列检测器,检测波长:254nm(方法验证),275nm(含量测定);流速:1.0mL/min;色谱分析流动相:φ=100%甲醇(方法验证),NaH2PO4-Na2HPO4缓冲液(pH7.0)/甲醇,体积比为90∶10(含量测定)。
分别取上述标准对照品和待测样品等溶液20μL,进行高效液相色谱分离分析,记录色谱分析结果。在稳定的流动相洗脱条件下,方法验证中标准样保留时间长短与样品对称性和支链情况有关,对称性好、支链多的样品在C18柱上保留时间长,后出峰,其中保留时间,甲苯约为3.36min,邻二甲苯为3.59min,间二甲苯为3.86min,苯为4.15min,对二甲苯为4.35min。而对应的胸腺五肽保留时间在4.48~4.61min范围内。各组分的色谱峰面积采用面积归一化法计算。
1.4 数据处理
实验所得数据结果采用Excel进行汇总、统计、分析,采用Origin8.0软件处理、作图。
2 结果与讨论
2.1 高效液相色谱法稳定性验证
为了保证分析测定结果准确可靠,对分析方法进行科学性验证[13]。证明分析方法符合分析检测的目的和要求。以苯、甲苯、邻二甲苯、间二甲苯、对二甲苯等苯及其同系物为高效液相色谱仪系统稳定性验证标准品,进行仪器稳定性验证。因苯环共轭结构,在254nm处具有较强紫外吸收,灵敏度较高。因此,稳定性验证紫外检测波长选择254nm。
取方法验证标准混合溶液,重复进样分析10次,所得色谱图见图2。得出苯、甲苯、邻二甲苯、间二甲苯、对二甲苯的色谱峰定量参数:保留时间、峰面积(面积归一化法计算)、峰高、峰宽、对称因子及峰面积百分含量等,将其结果列入表2中。10次试验中,5种物质各定量参数的相对标准偏差RSD均小于3.9%,说明本仪器及方法重现性好、精密度高。能满足实验测定要求RSD≤5%。
另取不同浓度的方法验证标准对照品甲苯、邻二甲苯混合溶液,逐级稀释。并对其进行分析检测,当浓度较小的甲苯色谱峰面积接近空白基线的3倍噪声(S/N= 3,检测下限)所达到的峰面积时停止稀释,并重复测定3次,结果见图3:a,b。
根据面积归一化法计算甲苯、邻二甲苯的色谱峰定量参数:保留时间、峰面积、峰高、峰宽、对称因子及峰面积百分含量等,将结果列入表 3中。保留时间实验结果显示:高浓度和低浓度条件下,甲苯保留时间基本一致,平均保留时间为3.358和3.327 min;邻二甲苯3.590和3.565 min。低浓度下,甲苯峰面积4.0为最低检测下限峰面积。甲苯、邻二甲苯各色谱峰定量参数的相对标准偏差RSD很小(均小于1.1%),说明仪器稳定性好,精密度高,符合分析检测要求RSD≤5%。
本方法稳定性验证能证实试验方法的准确、灵敏、专属和重现。
2.2 胸腺五肽标准对照品定性定量分析检测
由胸腺五肽分子结构图 1可知:组成胸腺五肽的氨基酸有酪氨酸,而酪氨酸分子中具有苯环结构,且苯环上又连有羟基,具有酚类结构,是p-π共轭体系,共轭体系增大,出现红移现象,最大吸收波长在275 nm左右。因此,对胸腺五肽的分析检测波长选择275 nm最佳,亦与药典方法要求一致[14]。
取胸腺五肽标准对照品溶液,重复进样分析5次,再分别取胸腺五肽标准对照品最低浓度和最高浓度样品进样分析,所得色谱图见图4。得出胸腺五肽色谱峰定量参数:保留时间、峰面积(面积归一化法计算)、峰高、峰宽、对称因子及峰面积百分含量等,将其结果列入表 4中。5次试验中,各定量参数的相对标准偏差RSD均低于0.5%,说明本仪器及方法重现性好、精密度高。能满足定量分析要求RSD≤5%。
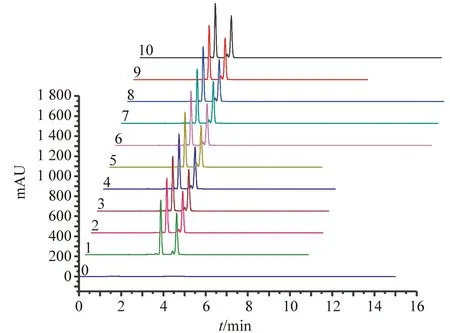
图2 方法验证标准对照品色谱图Fig.2 Standard samples chromatograms for method validation0:空白;1-10:标准混合样品重复分析(n = 10)
表2 方法验证标准对照品定量分析结果(n= 10)
Table 2 The quantitative analysis results of the standard samples for method validation (n= 10)
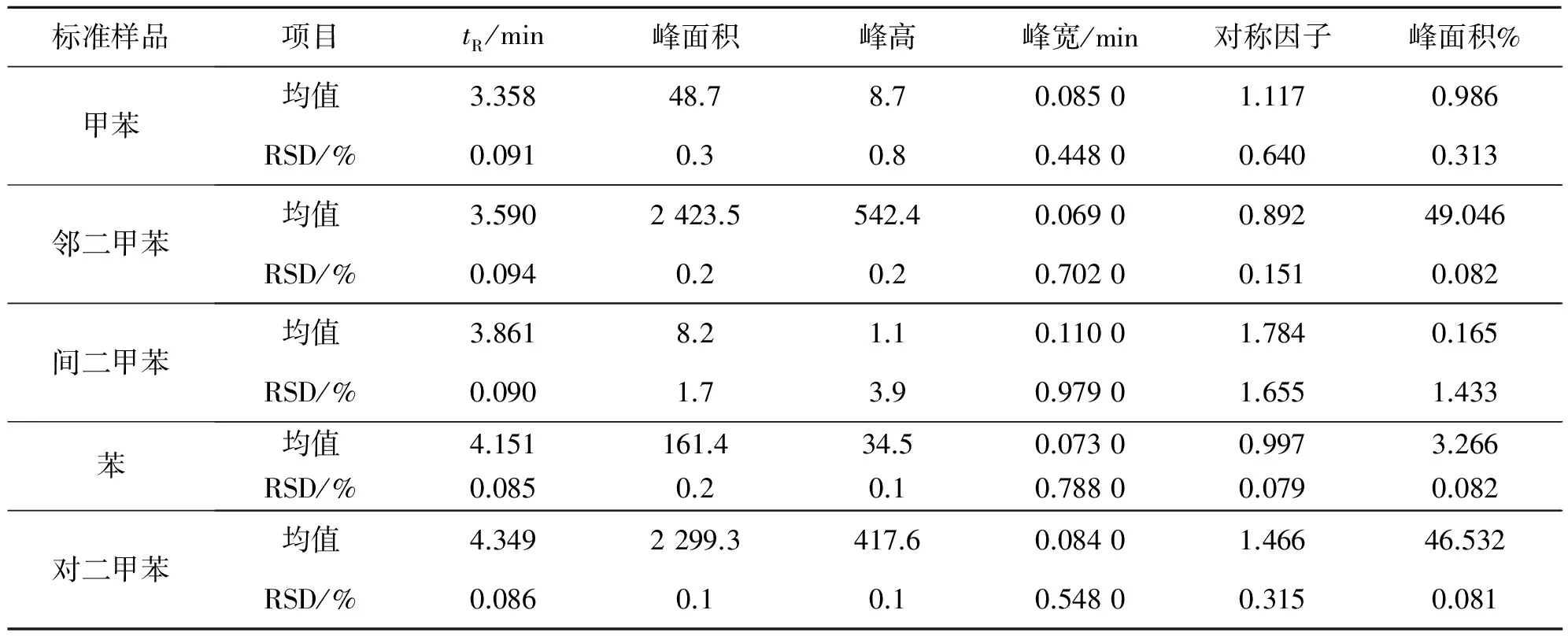
标准样品项目tR/min峰面积峰高峰宽/min对称因子峰面积%甲苯均值3.35848.78.70.08501.1170.986RSD/%0.0910.30.80.44800.6400.313邻二甲苯均值3.5902423.5542.40.06900.89249.046RSD/%0.0940.20.20.70200.1510.082间二甲苯均值3.8618.21.10.11001.7840.165RSD/%0.0901.73.90.97901.6551.433苯均值4.151161.434.50.07300.9973.266RSD/%0.0850.20.10.78800.0790.082对二甲苯均值4.3492299.3417.60.08401.46646.532RSD/%0.0860.10.10.54800.3150.081
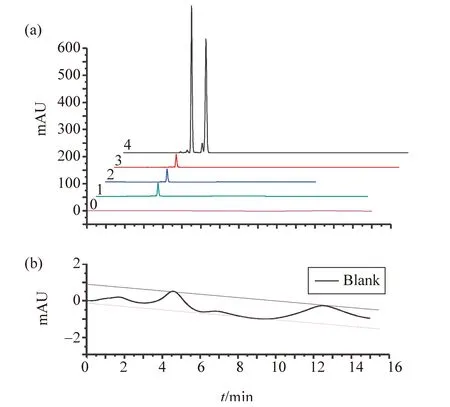
图3 方法验证标准对照品最小检测浓度(a)及基线漂移噪声测定(b)色谱图Fig. 3 Minimum detectable concentration determination for standard samples (a) and baseline drift noise (b) chromatograms for method validation0:空白;1-3:最小浓度样品;4:标准对照品

图4 胸腺五肽标准对照品重现性测定色谱图Fig.4 Reproducibility chromatograms on standard control samples assay for thymopentin
2.3 注射胸腺五肽水针药效成分定量分析检测
分别取溶剂空白、胸腺五肽标准溶液和10批次的注射胸腺五肽水针样品溶液,在相同色谱分析条件下分析测定,所得结果见图5:a。
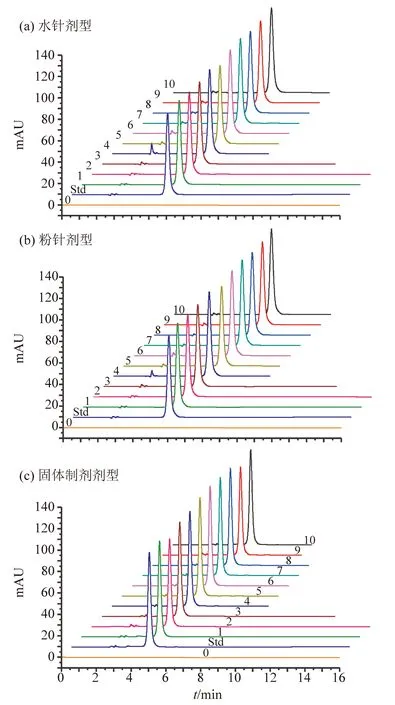
图5 胸腺五肽药效成分含量测定色谱图Fig.5 Chromatograms of component content assay for thymopentin
表3 方法验证标准对照品最小检测浓度参数结果(n= 3)
Table 3 The parameter results of minimum detectable concentration determination for standard samples (n= 3)
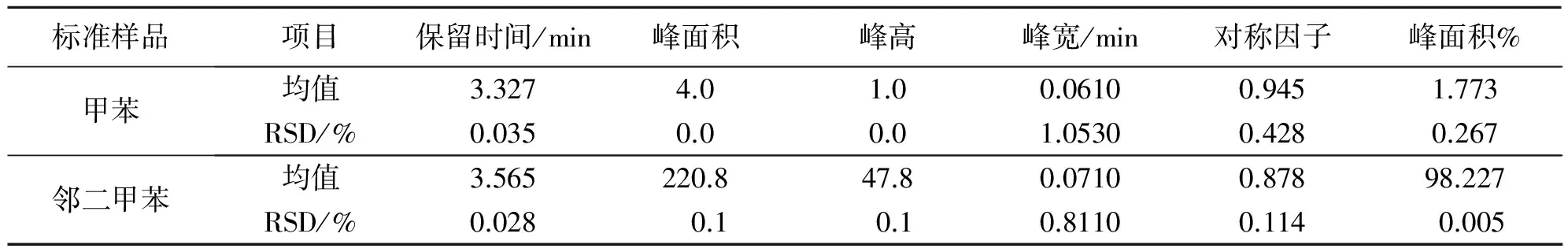
标准样品项目保留时间/min峰面积峰高峰宽/min对称因子峰面积%甲苯均值3.3274.01.00.06100.9451.773RSD/%0.0350.00.01.05300.4280.267邻二甲苯均值3.565220.847.80.07100.87898.227RSD/%0.0280.10.10.81100.1140.005
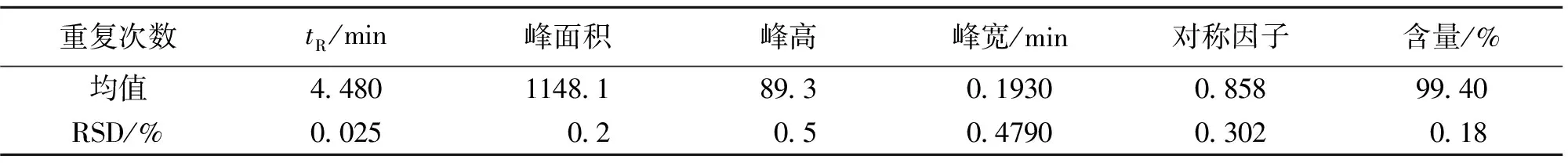
表4 胸腺五肽标准对照品重现性测定结果(n = 5)
采用面积归一化法计算色谱峰面积,记录相关色谱峰定量参数:保留时间、峰面积、峰高、峰宽及对称因子等,将结果列入表5中。根据注射液取用量折算出每支胸腺五肽注射液有效成分质量,列入表中。根据注射液生产质量管理规范[15],有效成分质量规格,每支10 mg的制剂,合格产品范围10.0±(10.0×5%)=10.0±0.5,合格范围即为每支9.5~10.5 mg。其中第10批产品,有效成分含量偏高,超出合格范围,其余均为合格产品。各批次的相对标准偏差RSD均低于2.3%,说明制剂生产的灌装工艺条件稳定。
2.4 注射胸腺五肽粉针药效成分定量分析检测
采用上述相同方法取溶剂空白、胸腺五肽标准溶液和10批次的注射胸腺五肽粉针样品溶液,在相同色谱分析条件下分析测定,所得结果见图5:b。
以面积归一化法计算色谱峰面积,记录相关色谱峰定量参数:保留时间、峰面积、峰高、峰宽及对称因子等,将结果列入表6中。根据注射粉针取用量折算出每支胸腺五肽粉针有效成分质量,列入表中。根据注射粉针生产质量管理规范[15],合格产品范围与水针制剂相同,即为每支9.5~10.5 mg。其中第7和第10批产品,有效成分质量偏高,超出合格范围,其余均为合格产品。各批次的相对标准偏差RSD均低于2.72%,说明粉针制剂生产的灌装及冻干工艺条件稳定。
2.5 胸腺五肽固体制剂药效成分定量分析检测
以相同的方法取溶剂空白、胸腺五肽标准溶液和10批次的胸腺五肽固体制剂待测溶液,在同一色谱分析条件下分析测定,所得结果见图5:c。
以面积归一化法为色谱峰面积计算依据,记录相关色谱峰定量参数:保留时间、峰面积、峰高、峰宽及对称因子等,将结果汇总于表7中。根据固体制剂的取用量折算出每片中胸腺五肽有效成分质量,列入表中。根据固体制剂生产质量管理规范[15],有效成分质量规格为每支20 mg的制剂,合格产品范围20.0±(20.0×5%)=20.0±1.0,合格范围即为每片19.0~21.0 mg。其中第2和第9批产品,有效成分质量偏低,低于合格范围,其余均为合格产品。各批次的相对标准偏差RSD均低于4.3%,说明固体制剂生产的造粒工艺条件稳定。
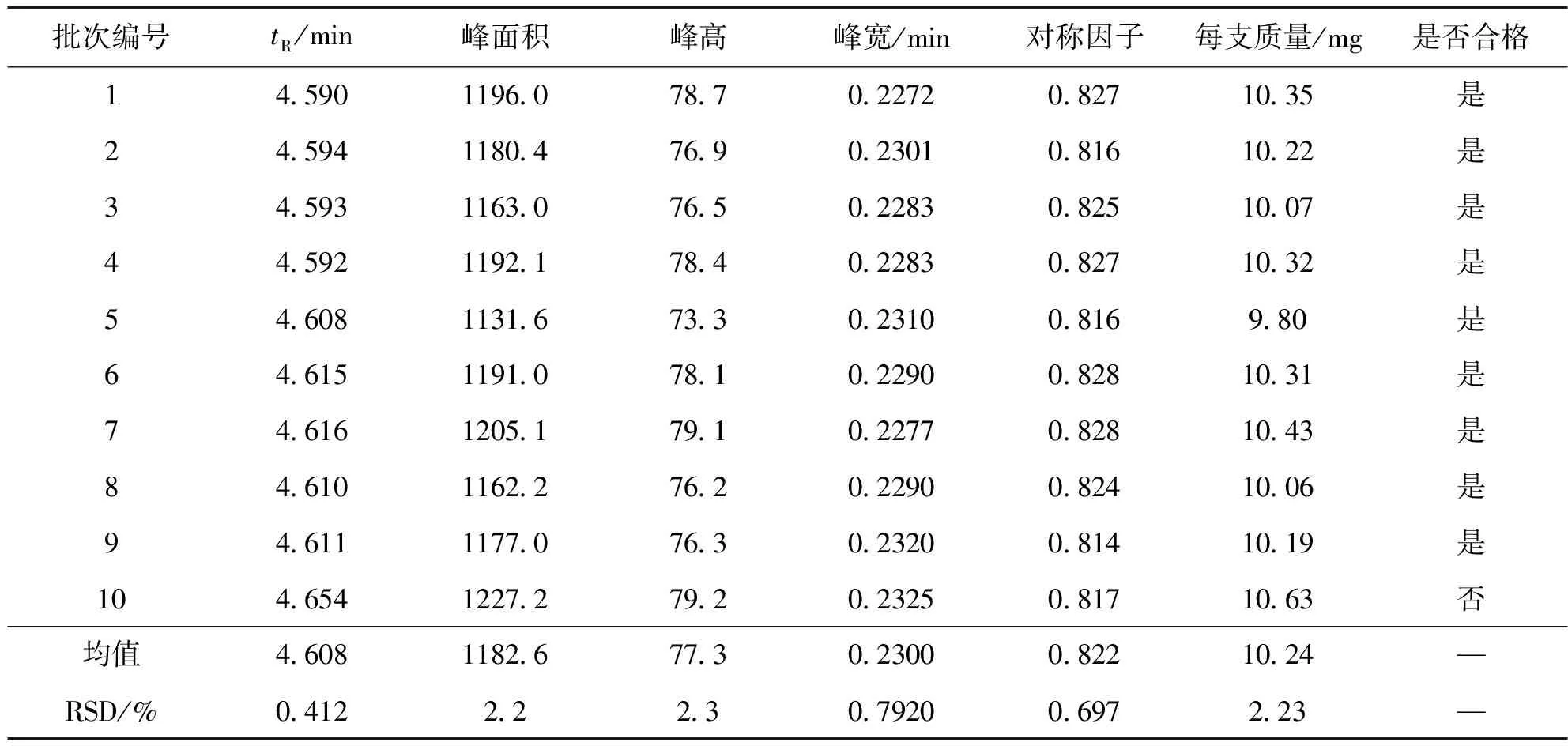
表5 注射胸腺五肽水针药效成分含量测定结果
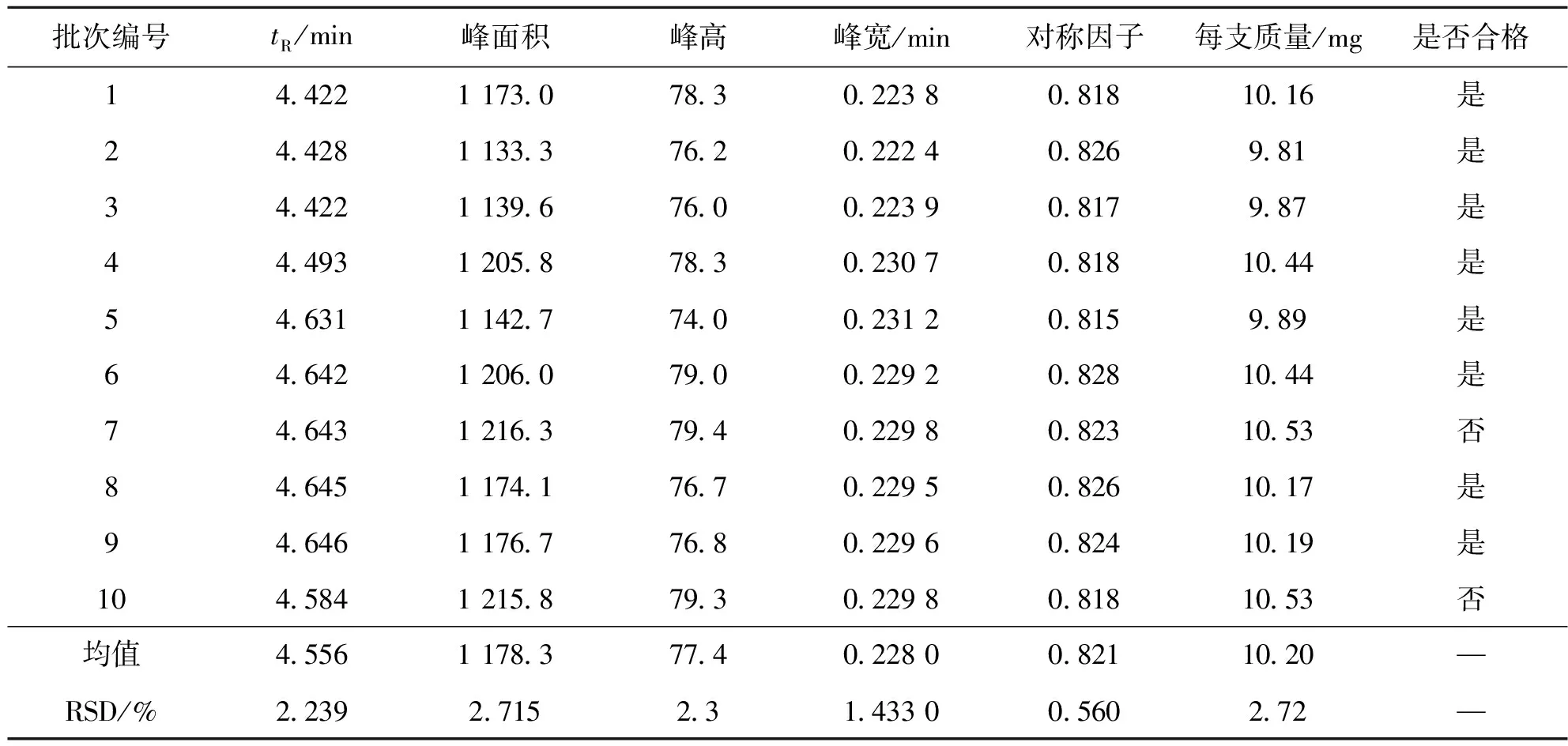
表6 注射胸腺五肽粉针药效成分含量测定结果
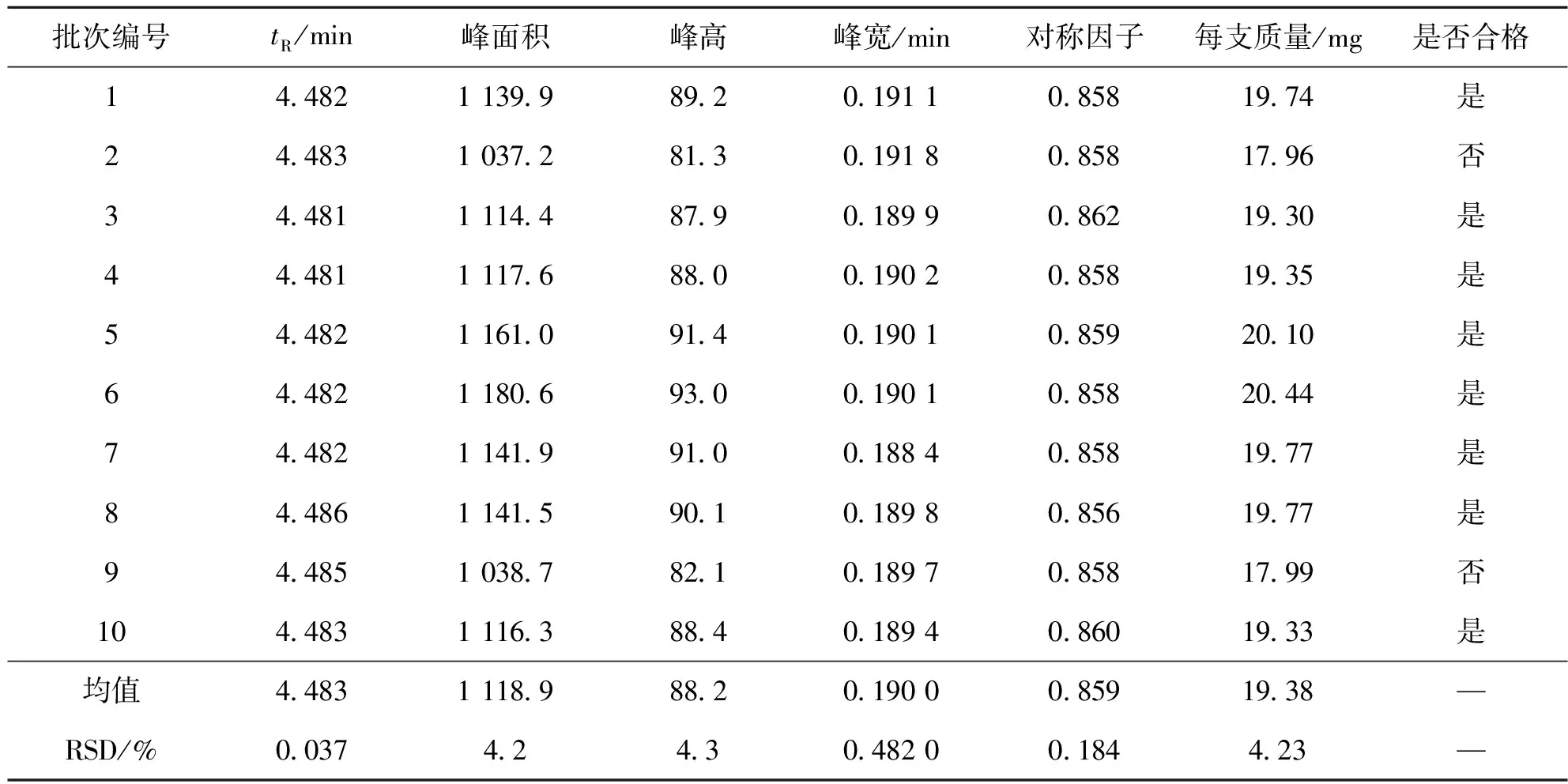
表7 胸腺五肽固体制剂含量均匀度测定结果
3 结 论
采用反相高效液相色谱法,分别对胸腺五肽三种制剂类型:水针、粉针、固体制剂的各10个批次制剂成品进行药效成分含量测定,并对其药效成分的含量进行合格评定[16- 17]。经研究发现:水针和粉针剂型药效成分含量较高,而固体制剂部分含量偏低,可能是由于水针和粉针剂型为无菌制剂,胸腺五肽在无菌条件下,且基质成分单一情况下不易分解变质,而固体制剂肠溶片为非无菌制剂,另外,片剂对应的辅料成分较为错综复杂,不利于胸腺五肽稳定存在。开发能使胸腺五肽固体制剂药效成分稳定的辅料成分,对提高胸腺五肽固体制剂生物利用度有较高应用价值[10]。研究同时发现三种制剂类型的灌装、冻干、造粒等制剂生产工艺过程稳定。
[1] 何兆雄, 唐永业, 许敦复, 等. 动物生化制药基础 [M]. 北京:中国商业出版社, 1985: 269-272.
[2] LIU Z, ZHENG X, WANG J, et al. Molecular analysis of thymopentin binding to HLA-DR molecules [J]. PLoS ONE, 2007, e1348 (12): 1-8.
[3] BIRGIT S, RICHARD H R, BRADFORD W G, et al. MS-assign, automated assignment and nomenclature of tandem mass spectra of chemically crosslinked peptides [J]. Journal of the American Society for Mass Spectrometry, 2003, 14: 834-850.
[4] 蒋定文, 李楚芳, 郭明秋. 胸腺五肤研究进展 [J]. 国外医学(预防、诊断、治疗用生物制品分册), 1999, 22(2): 69-72.
[5] GOSO C, FRASCA D, DORIA G, et al. Effect of synthetic thymic humoral factor (THF-y2) on T cell activities in immunodeficient ageing mice [J]. Clinical & Experimental Immunology, 1992, 87: 346-351.
[6] 周小妮. 胸腺五肽联合常规化疗治疗复治菌阳肺结核的疗效及对患者呼吸功能和免疫功能的影响 [J]. 海南医学院学报, 2016, 22(4): 343-345, 349.
[7] 谢婷,陶廷婷,梁宁生. 胸腺五肽及其衍生肽的杀菌活性研究 [J]. 中国药房, 2015, 26(28): 3918-3920.
[8] TAPAN A, MARGRIT P S, GIDEON G. Contrasting biological activities of thymopoietin and splenin, two closely related polypeptide products of thymus and spleen (thymopentin / splenopentin / immunoregulation) [J]. Proceedings of the National Academy of Sciences, 1984, 81: 2847-2849.
[9] 马丽. 胸腺五肽对晚期宫颈癌血清IL-17 表达水平的影响 [J]. 中国医学工程, 2015, 23(9): 124-127.
[10] 何伟玲, 张志荣, 蒋学华, 等. 制剂工艺条件下的胸腺五肽稳定性评价 [J]. 四川大学学报(医学版), 2003, 34(2): 292-294.
[11] 尹雅姝, 陈大为, 乔明曦, 等. RP-HPLC法测定胸腺五肽溶液的稳定性 [J]. 沈阳药科大学学报, 2007, 24(2): 89-93.
[12] 贺沁婷, 李振江, 李鑫, 等. 胸腺五肽的分离新工艺 [J]. 高校化学工程学报, 2008, 22(4): 709-713.
[13] 国家药典委员会. 中华人民共和国药典(2010年版一部) [M]. 北京:中国医药科技出版社, 2010: 附录36-附录38.
[14] 国家药典委员会. 中华人民共和国药典(2015年版二部) [M]. 北京:中国医药科技出版社, 2015: 1160-1162.
[15] 国家药典委员会. 中华人民共和国药典(2015年版三部) [M]. 北京:中国医药科技出版社, 2015: 通则7-通则10.
[16] 李松涛. 柱前衍生RP-HPLC法测定胸腺五肽的氨基酸组成 [J]. 承德医学院学报, 2015, 32(4): 327-328.
[17] CAI C, WANG L, DONG W, et al. Influence of potential inhalation carriers on stability of thymopentin in rat bronchoalveolar lavage fluid [J]. Drug Deliv, 2014, 21(6): 495-500.
Stability of efficacy composition content of different thymopentins
XUEHongbao1,CHANGHualan1,LIANGLili1,ZHANGHui1,MATao1,JINRongfu2,ZHANGChengshan2,GONGWenwu3
(1. Department of Chemistry, Bengbu Medical College, Bengbu 233030, China;2. Anhui Hongye Pharmaceutical Limited Company, Bengbu 233045, China;3. Bengbu Food & Drug Administration in Anhui, Bengbu 233030, China)
Reversed phase high performance liquid chromatography was used to analyze three types of the 10 batches thymopentin preparation: water injection, powder injection and solid preparation, and their efficacy assessments were processed through composition content determination. The result indicated that the efficacy composition contents of water and powder injection drugs were higher than that of solid preparation. This could be due to water and powder injection preparation forms were sterile products. The thymopentin composition was not easy to decompose and metamorphic with single matrix components under aseptic conditions. Several factors are not conducive thymopentin solid preparation to stability: solid preparation as enteric-coated troche are non-sterile products, in addition, the troche of the corresponding supplementary material composition is complex relatively. The ingredient material make the thymopentin solid preparation composition stable, and the efficacy could be developed. The high value for application could be obtained by improve the bioavailability thymopentin solid preparation.
thymopentin; stability; high performance liquid chromatography (HPLC); injection; solid preparation
10.13471/j.cnki.acta.snus.2016.04.015
2016-02-25
安徽省高等学校省级优秀青年人才基金重点资助项目(2013SQRL051ZD);安徽省高等教育振兴计划重大教学改革研究资助项目(2015zdjy101);蚌埠市社会科学规划资助项目(BB16B019);蚌埠市领导圈定课题资助项目(BBSQ16A04);安徽省省级质量工程教学研究资助项目(2014jyxm211);安徽省高等教育振兴计划资助项目(2014zytz014);国家级大学生创新创业训练计划资助项目(201410367014, 201510367003);蚌埠医学院教学研究资助项目(jyxm1506)
薛洪宝(1979年生 ),男;研究方向:制药工程;通信作者:梁丽丽;E-mail:hongbaoxueqhd@126.com
R944
A
0529-6579(2016)04-0087-08

