2型糖尿病性勃起功能障碍大鼠模型的构建*
李 浩黄展森胡志明齐 涛
陈地灵3应 颖4张 宇1张 滨1陈 俊1**
1. 中山大学附属第三医院不育与性医学科 (广州 510630);
2. 广东省梅州市人民医院泌尿外科; 3. 广东省微生物研究所; 4. 深圳大学医学院
2型糖尿病性勃起功能障碍大鼠模型的构建*
李 浩1△黄展森1△胡志明2齐 涛1
陈地灵3应 颖4张 宇1张 滨1陈 俊1**
1. 中山大学附属第三医院不育与性医学科 (广州 510630);
2. 广东省梅州市人民医院泌尿外科; 3. 广东省微生物研究所; 4. 深圳大学医学院
目的探究2型糖尿病性勃起功能障碍(T2DED)大鼠模型的构建方法。方法SD大鼠30只,随机分为两组:对照组10只,饲养普通饲料;实验组20只,饲养高脂饲料。饲养8周后,实验组腹腔注射小剂量链脲佐菌素(streptozotocin,STZ,30mg/kg),对照组注射同等剂量的柠檬酸钠-柠檬酸缓冲液。腹腔注射3d后采用剪尾法测定随机血糖,≥16.7mmol/L则认为2型糖尿病(T2DM)建模成功。糖尿病(DM)成模后于2、4、6、8周各测定一次随机血糖及体质量;于糖尿病成模后4、8周进行进行腹腔葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT),及腹腔胰岛素耐量试验(intraperitoneal insulin tolerance test,IPITT);于糖尿病成模后8周行阿扑吗啡(apomorphine,APO)实验,并测定每只大鼠的阴茎海绵体内压力(intracavernous pressure,ICP)。测压完成后,收集大鼠的血清,进行甘油三酯(triglyceride,TG),总胆固醇(total cholesterol,TC),高密度脂蛋白胆固醇(high density lipoprotein cholesterol ,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)含量的测量。结果(1)高脂喂养及小剂量STZ注射后,实验组20只大鼠有17只血糖>16.7mmol/L,与对照组相比,在注射后第2、4、6、8周实验组大鼠血糖均明显升高(P<0.05)。(2)IPGTT试验提示糖尿病大鼠存在胰岛素抵抗;IPITT试验提示糖尿病大鼠对胰岛素的敏感性下降。与对照组相比,实验组血清中的TG、TC、HDL-C、LDL-C含量显著升高(P<0.05);(3)APO实验提示对照组大鼠勃起率为100%,实验组中STZ注射后2只大鼠死亡,余15只大鼠有2只可观察到勃起。行ICP测定,实验组大鼠的ICP最大值明显低于对照组大鼠(P<0.05)。结论高脂喂养联合小剂量STZ注射可成功构建T2DED的大鼠模型,APO实验可以有效可靠地筛选ED动物模型。
糖尿病, 2型; 勃起功能障碍; 大鼠
糖尿病性勃起功能障碍(diabetic erectile dysfunction,DED)是难治性ED,严重影响患者及其配偶的生活质量。研究表明,在男性糖尿病(diabetes mellitus,DM)人群中ED的患病率高达50%,是非DM人群的3倍左右,且随着患者年龄的增长以及DM病程的延长,ED患病率明显升高[1]。在DM人群中,2型糖尿病(type 2 diabetes mellitus,T2DM)患者占据绝大多数,随着患者人群的大幅增长,由T2DM导致的ED(T2DED)问题将愈发突出,现有的药物疗效不佳,5型磷酸二酯酶抑制剂(phosphodiesterase type-5 inhibitors,PDE5i)有效率仅为50%左右,更为棘手的是迄今为止其发病机制尚不清楚[2]。因此,亟需进一步对T2DED的发病机制进行研究,以寻找有效的早期预警指标及治疗靶点,而建立动物模型是进行相关研究的必要条件。
目前大多数有关 DED的基础和应用研究均集中在T1DED模型上,但由于T1DM与T2DM的发病过程存在明显的差异,且T1DM仅占少数,因此探究与T2DM的自然发病过程更为吻合的T2DED模型构建方法具有更为重要的意义。然而,在已有的T2DED模型报道中,建模的方法并没有形成统一的标准,模型的筛选多采用阿扑吗啡(APO)实验,鲜有应用更为客观的指标——阴茎海绵体内压(Intracavernuous pressur,ICP)进行评价,且不同的实验室所报道的成模率存在较大的差异。因此,本研究旨在进一步探究验证T2DED动物模型的构建方法,同时采用ICP测定的方法对动物成模率进行验证,评估APO实验的可靠性,以期为后续的T2DED研究打下基础。
材料与方法
一、实验动物
30只成年雄性无特定病原体级(SPF)SD大鼠(广东省医学实验动物中心提供),体质量200g左右,交配实验证实其勃起功能正常。
二、主要试剂及仪器
链脲佐菌素(streptozotocin,STZ,Sigma公司),柠檬酸钠-柠檬酸缓冲液(pH=4.0,江莱生物科技有限公司),罗氏血糖仪和罗氏卓越型血糖试纸(德国罗氏诊断有限公司)。葡萄糖,胰岛素(中山大学附属第三医院)。甘油三酯(triglyceride,TG)试剂盒,总胆固醇(total cholesterol,TC)试剂盒,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒和低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)试剂盒(南京建成生物工程研究所)。阿扑吗啡(上海源叶生物科技有限公司),肝素溶液(上海研域生物科技有限公司),BL-420S生理记录仪(成都泰盟科技有限公司)。
三、方法
(一)实验分组
实验开始前30只大鼠适应性喂养1周后,使用随机数字表法将大鼠随机分为两组,对照组10只,实验组20只。对照组给予普通饮食(按照热卡百分比计算,碳水化合物占70%,蛋白质占20%,脂肪占10%),实验组给予高脂饮食(按照热卡百分比计算,碳水化合物占20%,蛋白质占20%,脂肪占60%),所有大鼠均自由饮水、摄食。饲养8周后,禁食8h,以30mg/kg剂量给予实验组大鼠腹腔注射链脲佐菌素(STZ),对照组大鼠同时注射同剂量的柠檬酸钠-柠檬酸缓冲液。腹腔注射3d后采用剪尾法测定随机血糖,≥16.7mmol/L则认为2型糖尿病建模成功。于糖尿病成模后每2周分别测定两组大鼠的体质量、血糖;于糖尿病成模后第4、8周从两组中各随机挑选5只大鼠进行IPGTT及IPITT;于糖尿病成模后第8周进行APO实验,3d后,禁食12h分别测定每一只大鼠的ICP,测压完成后,经腹主动脉采血,离心,取上清,进行TG、TC、HDL-C、LDL-C含量的测量。
(二)STZ溶液的配制
将600mg的STZ溶解于100mL浓度为0.1mol/L的柠檬酸钠-柠檬酸缓冲液(pH=0.4)中,浓度为6mg/ mL,现配现用,注意在冰浴中完成操作,并尽量保持避光。
(三)APO溶液的配制
APO 2 mg 溶解于0.5mg /kg维生素C 及生理盐水中,调整浓度为40 μg /mL。
(四)大鼠空腹血糖的测定
大鼠禁食24h后,采用剪尾法取静脉血,用罗氏血糖仪及配套的血糖试纸进行测定。
(五)胰岛素抵抗的评估
IPGTT可以评估胰岛素抵抗的情况,具体方法如下:2组大鼠禁食12h后行IPGTT。经剪尾法测定空腹血糖后,接着给予腹腔注射葡萄糖(2g/kg),于注射葡萄糖后30、60、90、120min经剪尾法测定血糖水平。IPITT可以评估胰岛素敏感性的情况,具体方法如下:2组大鼠禁食4h后,经剪尾法测定空腹血糖后,继而按1unit/kg 给予腹腔注射胰岛素,于注射胰岛素后30、60、90、120min 经剪尾法测定血糖水平[3,4]。
(六)生化指标的测量
ICP测量完成后,使用负压采血管进行腹主动脉采血,静置,离心,取上清,-80℃保存。每组分别取5只大鼠的血清,进行TG、TC、HDL-C、LDL-C含量的测量,具体方法按照南京建成生物工程研究所的说明书进行。
(七)大鼠勃起功能的评价
1. 阿扑吗啡(APO)实验:两组大鼠饲养8周后,将每只大鼠放至透明观察箱中,室内保持安静,调整灯光亮度至仅够观察,适应环境15min,然后在大鼠颈部松弛皮肤下注射APO 100μg /kg,观察30min,并记录每组大鼠阴茎勃起次数。阴茎膨大、包皮后退、阴茎头充血、露出即为1 次有效的阴茎勃起。勃起次数≥1 次,则认为是勃起实验阳性,表明该大鼠勃起功能正常;反之,则为ED大鼠[5,6]。
2. 阴茎海绵体内压(ICP)及颈动脉压的测定:配制5%的戊巴比妥钠溶液,按30mg/kg的剂量进行腹腔注射麻醉。沿腹白线作腹部正中切口打开腹腔,于前列腺背外侧找到盆神经节,仔细辨认并游离出长约5mm的海绵体神经。剪开阴茎根部皮肤,暴露两侧阴茎脚,将注有250IU/mL肝素溶液的23G头皮针插入左侧阴茎海绵体,远端连接生理记录仪(成都泰盟)。利用不锈钢双钩电极钩住海绵体神经进行刺激,刺激参数为:电压5V,波宽0.2ms,频率20Hz,每次持续时间为60s。同时分离左侧颈动脉,用预先充满250 IU/mL肝素溶液的PE50管插入颈动脉,远端接入生理记录仪(成都泰盟),测定大鼠的颈动脉压后,计算其平均颈动脉压(mean carotid arterial pressure, MAP)。
四、统计学处理
用SPSS 22.0统计软件进行统计学处理。两组大鼠的血清脂类含量水平,用t检验;组间比较用方差分析,P<0.05为有统计学差异。
结 果
一、实验动物一般情况
经过8周的高脂喂养,实验组大鼠体质量增加较明显,体型较为肥胖,活动量有所减少。STZ注射3d后有3只大鼠血糖不达标(<16.7mmol/L),予以剔除。随着糖尿病病程进展,实验组大鼠开始出现多饮、多食、多尿、消瘦,毛发干枯、脱毛,反应迟钝、活动减少等症状,部分出现烂尾现象。STZ注射2周后2只实验组大鼠因糖尿病并发症死亡。对照组大鼠毛发光亮柔顺、反应灵敏、好动,体质量增加。
二、随机血糖及体质量变化的比较
与对照组相比,实验组STZ注射后第6周、第8周两个时间点的体质量下降,差异有统计学意义(P<0.05),其余时间点差异无统计学意义。随着造模时间推移,对照组大鼠体质量逐渐增加,对照组柠檬酸缓冲液注射后第4、6、8周与第3天的体质量比较差异均有统计学意义(P<0.05);实验组大鼠于STZ注射后,各时间点之间的体质量无明显差异(P>0.05),见表1。与对照组相比,STZ注射后第3天、第2周、第4周、第6周、第8周血糖均明显升高,差异有统计学意义(P<0.05)。对照组内与实验组组内不同时间比较差异均无统计学意义(P>0.05),见表2。
三、胰岛素抵抗评估结果
IPGTT和IPITT的结果如图1所示,其变化符合2型糖尿病的特征。与对照组相比,实验组血清中的TG、TC、HDL-C、LDL-C含量显著升高(P<0.05)。
表1 STZ注射后各时间点大鼠体质量的变化

表1 STZ注射后各时间点大鼠体质量的变化
与对照组比较,*为P<0.05;与对照组第3天相比,△P<0.05
第3天 第2周 第4周 第6周 第8周对照组 544.90±52.79 592.00±55.89 631.00±64.20△659.55±77.33△689.00±78.06△实验组 578.65±70.65 576.67±55.54 584.00±54.55 570.67±57.91*549.00±58.83*
表2 STZ注射后各时间点大鼠血糖值的变化

表2 STZ注射后各时间点大鼠血糖值的变化
与对照组比较,*为P<0.05
第3天 第2周 第4周 第6周 第8周对照组 5.73±0.64 5.93±0.48 5.91±0.55 5.89±0.86 5.95±0.44实验组 20.45±2.21*19.24±1.64*19.14±2.37*19.29±3.59*20.49±2.63*

图1 胰岛素抵抗评估
四、勃起功能评价
在注射STZ后第8周对两组大鼠进行APO实验,其中对照组大鼠均可观察到明显的阴茎勃起,阳性率高达100%(10/10)。实验组中有2只大鼠可观察到较为明显的阴茎勃起,阳性率为13.3%。
在进行APO实验后第3天我们测定了两组大鼠的ICP,见表3,图2。实验组大鼠的ICP最大值明显低于对照组大鼠(分别为38.65±18.23和95.38±20.61),ICP/MAP比值同样呈现显著的差异(实验组为0.29±0.8,对照组为0.76±0.16),表明在糖尿病成模后第8周实验组大鼠出现明显的勃起功能障碍。
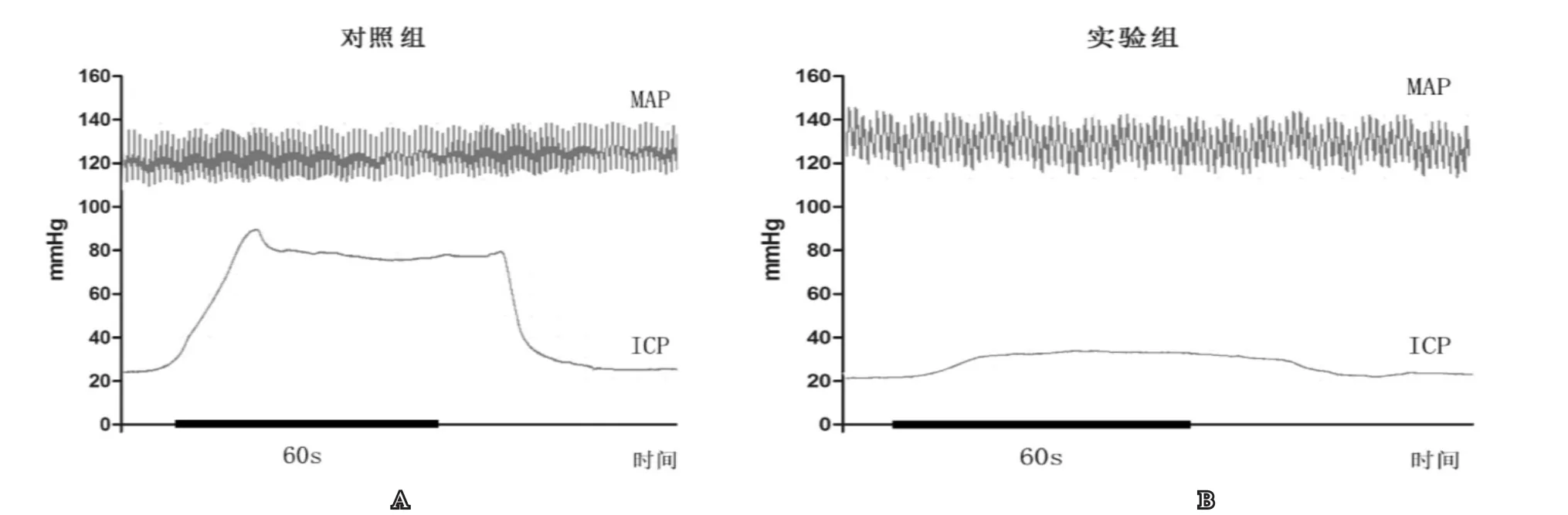
图2 对照组(A)及实验组(B)大鼠阴茎海绵体内压力(ICP)及颈动脉压

表3 两组ICP和MAP测定结果
讨 论
糖尿病(DM)主要以胰岛素分泌相对或绝对不足,伴或不伴胰岛素抵抗为病理生理基础和显著特征,导致机体的碳水化合物、脂质和蛋白质代谢紊乱,临床上以慢性高血糖为主要标志。糖尿病可分为2种类型:胰岛素依赖型糖尿病(1型糖尿病,T1DM),多见于青少年,胰岛素分泌绝对不足;胰岛素非依赖型糖尿病(2型糖尿病,T2DM),多见于中老年人,胰岛素分泌相对不足,同时伴有胰岛素抵抗。近年来,随着人们生活水平的不断提高,饮食结构以及生活方式发生了明显的变化,糖尿病患者数量急剧增加。全球糖尿病流行病学调查报告显示[7]:2000年全世界DM患者的总人数为1.71亿 ,2012年达到3.71亿,预计到2030年,全球DM患者总人数将高达4.39亿。在我国,糖尿病的患病率也正在逐年快速增长。据一项全国糖尿病流行病学研究报道[8],国内糖尿病的患病率高达9.7%,换算之后约为9 240万人次。糖尿病及其并发症显然已严重影响患者的生活质量,并造成巨大的经济及社会负担。
勃起功能障碍(ED)作为DM的主要并发症之一,在DM人群中的患病率约为35%~90%[9]。DM患者一般比非DM患者早10~15年发生ED[10]。由于在DM患者中T2DM占据绝大多数,约为90%~95%[11],因此由T2DM所带来的ED问题将日益突出,然而其发病机制迄今尚不清楚,现有的治疗手段疗效均不能令人满意,所以有必要进一步对其发病机制进行研究,而建立动物模型是进行基础研究的必备条件,故在本研究中主要探索T2DED模型的构建。
用于构建DED模型的动物主要有大鼠、小鼠、狗、猴、猫和兔等。其中大鼠由于具备易于购买和饲养、抗感染能力强、繁殖能力强、对性激素感受能力高等优点而应用最为广泛。目前有关DED的研究较多采用的是T1DM大鼠模型,其造模方法已十分成熟,即用大剂量STZ(60~70mg/kg)腹腔注射进行诱导,因STZ可特异性损伤胰岛β细胞,使胰岛素分泌减少,从而引发糖尿病症状,这与T1DM所具备的胰岛素绝对缺乏的特性相吻合。随着T2DM患者人群急剧增长,人们开始将目光转向T2DM及其并发症的研究,这便对T2DM动物模型的构建提出了要求。迄今报道的T2DM模型主要分为两类:一类是以遗传因素占主导地位的模型,如肥胖Zucker大鼠、瘦素缺乏的肥胖ob/ob小鼠、KK小鼠[12]、自发性糖尿病GK-Wistar大鼠等,它们一般表现为类似于成人2型糖尿病的轻度高血糖、肥胖、高血脂等症状;另一类是利用小剂量STZ联合高脂饲料喂养诱导的模型[13]。其中高脂饲料喂养可引起大鼠体内产生胰岛素抵抗,而小剂量STZ则可进一步使胰岛细胞轻度损伤,能够更好地模拟人类2型糖尿病的发病过程,相对于第一类中以遗传因素占主导的模型更为经济,且易于复制以及饲养。因此在本研究中,我们拟采用该法建立T2DM模型。此外,对于STZ的使用剂量,目前尚没有统一的标准。魏占英等[14]采取不同的高脂喂养时间及不同STZ注射剂量(分别为高脂喂养4周+STZ35mg/kg;高脂喂养4周+STZ38mg/kg;高脂喂养8周+STZ25mg/ kg;高脂喂养8周+STZ30mg/kg;高脂喂养10周+STZ25mg/kg)进行T2DM模型的构建,发现随着高脂喂养时间和STZ注射剂量的增加,T2DM大鼠的成模率和死亡率均呈上升趋势,而8周的高脂喂养时间联合30mg/kg的STZ注射可同时具备高成模率及低死亡率以及血糖稳定等优点;程祎等[15]采用不同剂量的STZ(40mg/kg、60mg/kg、80mg/kg)进行造模,结果发现40mg/kg组与60mg/kg组的成模率存在显著差异,而60mg/kg组与80mg/kg组之间差异无统计学意义,认为注射60mg/kg的STZ为构建T1DM模型的最适剂量。结合上述已报道的1型和T2DM造模方法以及两种类型糖尿病的病理生理过程,我们认为60mg/kg的剂量可造成胰岛β细胞功能明显损伤,符合T1DM的病理特点,而T2DM的胰岛仅有轻度受损,因此在本实验中我们拟采用半量30mg/kg作为STZ的注射剂量,目的是模拟胰岛的轻度损伤过程,同时联合高脂饲料喂养以使大鼠体内产生胰岛素抵抗。
对于糖尿病后ED成模的时间点,目前尚没有统一的标准。程祎等[15]认为利用APO筛选ED模型的最适时间应为糖尿病成模后2周;Qiu等[16]认为在糖尿病成模后第4周可作为DED研究的最适时间点。然而既往大多数研究多采用8~10周作为时限,程晨等[17]研究发现糖尿病发病后第8周大鼠的ED发生率达65.4%,满足进一步实验的需求。刘贵华等[18]在糖尿病后第10周进行APO实验,其报道的ED成模率为68%。苏宏伟等[19]分别研究了糖尿病成模后第8周、12周、16周的ED发生率,尽管第16周时大鼠成模率更高,但结合各时间点的成模率、死亡率以及实验周期等问题,他们认为第8周可作为最适的研究时间点。在本研究中,我们以第8周作为研究时间点,对糖尿病大鼠的ED成模率以及ED筛选方法作进一步的验证及研究。
目前用于评估模型动物勃起功能的方法主要有APO实验以及ICP测定。APO是一种合成吗啡衍生物,作为一种短效多巴胺受体激动剂,其可诱发中枢性勃起反应,同时不伴麻醉或镇痛作用[20,21]。已有许多研究[5,22,23]利用APO实验进行ED动物模型的筛选,采用的是颈部松弛皮肤下注射的方法,创伤小且为一过性效应,故经筛选合格的动物可直接进入下一阶段的研究。但该方法需要一定的观察时间,且受实验者主观感受的影响,只能作为ED评估的定性指标。ICP测定则可以直观地反映动物阴茎海绵体压力的变化,作为定量指标为ED的评估提供较为准确客观的衡量标准[24],但进行该操作时需对动物进行麻醉,操作结束后动物通常会牺牲,不利于进一步的研究。为了验证APO实验在ED筛选中的可靠性,我们同时进行了APO实验以及ICP测定,发现对照组大鼠APO实验100%阳性,而实验组中阳性率为13.3%(2/15),实验组中2只APO(+)大鼠所对应的ICP值分别为80.8mmHg和86.9mmHg,对应的ICP/MAP比值为0.48和0.5,达到正常大鼠水平,表明两者的结果基本相吻合。然而,在实验组大鼠中,我们还发现其中2只大鼠的ICP值接近60mmHg,ICP/MAP比值接近0.45,高于实验组中ED大鼠的平均水平,但APO实验结果却为(-),分析其可能的原因包括:(1)此时大鼠勃起功能已然受损,但未达完全性ED的水平,而ICP作为一个定量指标,可以展现出这样一种中间状态。相反地,APO实验是一个定性指标,结果只能为阳性或者阴性,从而导致了存在假阴性的可能;(2)也不排除由于观察时间较短、实验人员主观因素等造成误差的可能性,这有待后续实验进一步研究验证。
综上所述,采用高脂喂养联合小剂量STZ注射的方法可成功构建2型糖尿病性勃起功能障碍的大鼠模型,成模率较高,且具备经济、稳定等优点,而利用APO实验则可以有效地对ED动物模型进行筛选,从而为进一步的ED研究提供理想的模型。
1 Seftel AD, Sun P, Swindle R. The prevalence of hypertension, hyperlipidemia, diabetes mellitus and depression in men with erectile dysfunction. J Urol 2004; 171(6 Pt 1): 2341-2345
2 Ng KK, Lim HC, Ng FC, et al. The use of sildenafil in patients with erectile dysfunction in relation to diabetes mellitus-a study of 1,511 patients. Singapore Med J 2002; 43(8): 387-390
3 Albersen M, Lin G, Fandel TM, et al. Functional, metabolic, and morphologic characteristics of a novel rat model of type 2 diabetes-associated erectile dysfunction. Urology 2011; 78(2): 476.e1-e8
4 Zhang M, Lv XY, Li J, et al. The characterization of highfat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model. Exp Diabetes Res 2008; 2008: 704045
5 Lee J H, Ko M, Chae MR, et al. Radiotelemetric assessment of intracavernosal pressure in apomorphineinduced erection: hypercholesterolemic rats vs normal control. Int J Impot Res 2014; 26(2): 41-44
6 Bernabe J, Rampin O, Sachs BD, et al. Intracavernouspressure during erection in rats: an integrative approach based on telemetric recording. Am J Physiol 1999; 276(2 Pt 2): R441-R449
7 Wild S, Roglic G, Green A, et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care 2004; 27(5): 1047-1053
8 Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China. N Engl J Med 2010; 362(12): 1090-1101
9 Malavige LS, Jayaratne SD, Kathriarachchi ST, et al. Erectile dysfunction among men with diabetes is strongly associated with premature ejaculation and reduced libido. J Sex Med 2008; 5(9): 2125-2134
10 Feldman HA, Goldstein I, Hatzichristou DG, et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study. J Urol 1994; 151(1): 54-61
11 Tripathi BK, Srivastava AK. Diabetes mellitus: complications and therapeutics. Med Sci Monit 2006; 12(7): RA130-RA147
12 Song GY, Gao Y, Di YW, et al. High-fat feeding reduces endothelium-dependent vasodilation in rats: differential mechanisms for saturated and unsaturated fatty acids?. Clin Exp Pharmacol Physiol 2006; 33(8): 708-713
13 Reed MJ, Meszaros K, Entes LJ, et al. A new rat model of type 2 diabetes: The fat-fed, streptozotocin-treated rat. Metabolism 2000; 49(11): 1390-1394
14 魏占英, 沈丽, 冯晓慧, 等. 高脂饲料喂养时间和STZ剂量对建立2型糖尿病大鼠模型的影响. 医学研究杂志2014; 43(2): 42-46
15 程袆, 韦安阳, 李煜罡. 糖尿病性勃起功能障碍大鼠模型的建立. 南方医科大学学报 2008; 28(4): 564-566
16 Qiu X, Sun C, Yu W, et al. Combined strategy of mesenchymal stem cell injection with vascular endothelial growth factor gene therapy for the treatment of diabetesassociated erectile dysfunction. J Androl 2012; 33(1): 37-44
17 程晨, 林英立, 陈业刚, 等. 大鼠糖尿病性勃起功能障碍模型的实验研究. 中国男科学杂志 2010; 24(8): 33-35, 41
18 刘贵华, 孙祥宙, 陈羽, 等. 大鼠糖尿病性勃起功能障碍模型的建立. 广东医学 2009; 30(6): 844-846
19 苏宏伟, 李向东, 李凤岐, 等. 链脲菌素诱导糖尿病性勃起功能障碍大鼠模型的建立. 河北北方学院学报•医学版 2010; 27(3): 21-23
20 Argiolas A, Hedlund H. The pharmacology and clinical pharmacokinetics of apomorphine SL. BJU Int 2001; 88 Suppl 3: 18-21
21 Richards N, Wayman C, Allers KA. Electrophysiological actions of the dopamine agonist apomorphine in the paraventricular nucleus during penile erection. Neurosci Lett 2009; 465(3): 242-247
22 Sachs BD, Akasofu K, Citron JH, et al. Noncontact stimulation from estrous females evokes penile erection in rats. Physiol Behav 1994; 55(6): 1073-1079
23 Schmidt MH, Valatx JL, Sakai K, et al. Corpus spongiosum penis pressure and perineal muscle activity during refexive erections in the rat. Am J Physiol 1995; 269(4 Pt 2): R904-R913
24 Cellek S, Bivalacqua TJ, Burnett AL, et al. Common pitfalls in some of the experimental studies in erectile function and dysfunction: a consensus article. J Sex Med 2012; 9(11): 2770-2784
(2016-03-08收稿)
Establishment of type 2 diabetes mellitus rats model with erectile dysfunction*
Li Hao1△, Huang Zhansen1△, Hu Zhiming2, Qi Tao1,
Chen Diling3, Ying Ying4, Zhang Yu1, Zhang Bin1, Chen Jun1**
1. Department of Infertility and Sexual Medicine, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou, 510630, China; 2. Department of Urology, Guangdong Meizhou People's Hospital; 3. Guangdong Institute of Microbiology; 4. Medical College, Shenzhen University
Chen Jun, E-mail: jchen121121@hotmail.com
ObjectiveTo investigate the establishment method for type 2 diabetes mellitus (T2DM) rats model with erectile dysfunction.MethodsThirty sprague -dawley rats were randomly divided into two groups. The rats in the control group (n=10) were fed with normal diet and the rats in experimental group (n=20) were fed with high fat diet. Eight weekslater, the rats in the experimental group were injected intraperitoneally with low-dose Streptozotocin (STZ, 30mg/kg), while the rats in the control group were given the same dose of vehicle citrate buffer. After seventy two hours, tail-vein blood were collected for monitoring blood glucose levels, and only rats with a random blood glucose level over 16.7 mmol/L were considered as T2DM rats model. Random blood glucose and body weight of the rats were examined every two weeks. On week 4, 8 after diabetes, intraperitoneal glucose tolerance test (IPGTT) and intraperitoneal insulin tolerance test (IPITT) were analyzed. On week 8 after diabetes, apomorphine (APO) test was conducted and the intracavernosal pressure (ICP) of each rat was measured. When the measurement of ICP fnished, the serums of rats were collected. Serum triglycerides (TG), total cholesterol(TC), high density lipoprotein cholesterol(HDL - C), low density lipoprotein cholesterin(LDL - C) were measured.Results(1) Under high fat diet and low-dose STZ injection, seventeen rats with T2DM modeling in the experimental group were successfully established. Compare with that of the control group, the blood glucose level in the experimental group were elevated signifcantly on week 2, 4, 6, 8 after STZ injection (P<0.05). (2)IPGTT suggested that insulin resistance existed in diabetic rats and IPITT showed that insulin sensitivity of diabetic rats decreased. Compared with those of the control group, the contents of TG, TC, HDL-C, LDL-C were signifcantly increased in the experimental group (P<0.05). (3)APO test showed that rats in the control group had no ED, while 2 of 15 (2 rats were dead due to hyperglycemia) rats in the experimental group had penile erection. The max ICP of the experimental group rats were lower than that of the control group rats signifcantly (P<0.05).ConclusionType 2 diabetes mellitus rats model with erectile dysfunction were successfully established by high fat diet combined with low-dose STZ injection, and APO test was an effective and reliable method for ED model evaluation.
diabetes mellitus, type 2; erectile dysfunction; rats
10.3969/j.issn.1008-0848.2016.10.006
R 698.1; R 587.1
资助:国家自然科学基金项目(编号:81370705,81471450)和广东省科技计划项目(编号:2013B021800204)的资助
**通讯作者,E-mail: jchen121121@hotmail.com
△为共同第一作者

