艾灸对溃疡性结肠炎大鼠结肠TLR4和TNF-α蛋白及其mRNA表达影响的研究*
王晓梅,黄 艳,王圆圆,刘雅楠,祁 琴,金 凤,华雪桂,吴焕淦**
(1.上海市针灸经络研究所 上海 200030;2.上海中医药大学 上海 201203;3.复旦大学附属肿瘤医院 上海 200032)
艾灸对溃疡性结肠炎大鼠结肠TLR4和TNF-α蛋白及其mRNA表达影响的研究*
王晓梅1,黄 艳1,王圆圆2,刘雅楠2,祁 琴2,金 凤3,华雪桂1,吴焕淦1**
(1.上海市针灸经络研究所 上海 200030;2.上海中医药大学 上海 201203;3.复旦大学附属肿瘤医院 上海 200032)
目的:观察艾灸对溃疡性结肠炎大鼠结肠Toll样受体4(TLR4)和肿瘤坏死因子α(TNF-α)蛋白及其mRNA表达的影响,进一步探讨艾灸治疗溃疡性结肠炎的作用机制。方法:将40只SD大鼠随机分为正常组、模型组、隔药灸组和柳氮磺胺吡啶(Sulfasalazine,SASP)组。采用隔药灸天枢和气海穴及SASP灌胃进行干预。干预结束后,应用HE染色光镜下观察各组大鼠结肠病理学变化,分别采用Western blot法和FQ-PCR法检测大鼠结肠TLR4和TNF-α蛋白及其mRNA表达。结果:造模大鼠存在结肠组织病理学损伤,隔药灸组和SASP组大鼠结肠病理学与模型组相比均有一定的改善;与正常组比较,模型组大鼠结肠TLR4和TNF-α蛋白及其mRNA表达均显著增加(P<0.05);经隔药灸和SASP干预后,大鼠结肠TLR4和TNF-α蛋白及其mRNA表达均显著降低(P<0.05)。结论:TLR4、TNF-α可能在溃疡性结肠炎中发挥炎症损伤作用,隔药灸能下调溃疡性结肠炎大鼠结肠TLR4和TNF-α的表达,提示其机制可能是通过下调 TLR4和TNF-α表达介导的级联反应达到艾灸治疗溃疡性结肠炎的目的。
艾灸 溃疡性结肠炎 Toll样受体4 肿瘤坏死因子α
溃疡性结肠炎(Ulcerative Colitis,UC)和克罗恩病(Crohn’s Disease,CD)统称炎症性肠病,是一种病因不明的慢性直肠和结肠炎症性疾病,临床以腹痛、腹泻、黏液或脓血便为特征,病变主要限于黏膜层和黏膜下层。UC在欧美发达国家发病率较高,近期的研究表明,西欧IBD的发病率是东欧的2倍[1],美国妇女UC的发病率为10/10万[2],美国儿童UC的发病率也不断升高[3],匈牙利人UC的发病率为11.9/10万[4]。近年来,澳大利亚UC发病率为23.67/10万,亚洲国家UC发病率逐年增加,中国UC的发病率约为3.44/10万[5]。
Toll样受体-4(Toll-like Receptors-4,TLRs-4)是固有免疫系统中的细胞跨膜受体及病原模式识别受体之一,它主要通过识别病原相关分子模式来启动免疫反应。已发现TLRs在炎症、细胞信号转导、细胞凋亡、肿瘤等发生过程中扮演重要角色[6],在肠黏膜免疫中发挥重要作用[7]。TLRs家族包括10个成员,其中TLR4在IBD发病中发挥重要角色,在CD和UC结肠组织中均有表达[8-10],TLR4可通过核因子κB信号通路诱导肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)等炎症介质的表达[11]。
前期研究表明,隔药灸对UC患者有良好的疗效,不仅有效改善UC患者结肠异常的免疫反应[12],下调UC患者结肠黏膜IL-8和ICAM-1蛋白和基因的表达[13],还可以调节UC模型大鼠结肠TLR2[14]及TLRs信号传导通路下游因子KGF、TNF-α、IL-12和IL-6表达[15,16]。本研究采用免疫学方法并加局部刺激制备UC大鼠模型[17],并利用Western blot法及FQ-PCR法,观察UC大鼠结肠组织的TLR4和TNF-α蛋白及其mRNA表达水平,探讨TLRs在UC发病过程中的作用,揭示艾灸治疗UC的关键信号分子和作用机制。
1 材料和方法
1.1 实验动物
清洁级Sprauge-Dawley(SD)雄性大鼠40只,体质量183±10 g,由复旦大学医学院动物实验中心提供。实验动物在实验前适应性饲养3天,饮食、饮水、精神状况正常者纳入实验。
1.2 分组与模型制备
将40只大鼠随机分正常组、模型组、隔药灸组和柳氮磺胺吡啶(Sulfasalazine,SASP)组,每组10只。
除正常组外其余3组采用免疫学方法合并局部刺激制备UC大鼠模型[17]。将UC患者术后新鲜结肠黏膜,加适量生理盐水制成黏膜匀浆,冷冻24 h溶解后,以3 000 r·min-1离心30 min,取上清液提纯测定蛋白质含量,并与完全弗氏佐剂混匀配成乳剂。造模大鼠首次于足趾内注射抗原液0.3 mL(蛋白含量6 mg),并分别于第10、17、24、31天,于足趾、背部、腹股沟、腹腔内注射抗原0.3 mL(蛋白含量6 mg,末次注射不加完全弗氏佐剂);至第38天,造模大鼠用10%水合氯醛腹腔注射麻醉后,3%甲醛2 mL灌肠,留置1 h,用生理盐水灌肠冲洗,再用含24 mg·mL-1蛋白的抗原液灌肠,留置2 h,用生理盐水再灌肠冲洗。正常组SD大鼠注射生理盐水,处理步骤与造模组相同。
造模结束后,分别取正常组2只和造模大鼠组1只进行模型鉴定,组织病理学结果提示造模成功。治疗过程中隔药灸组和SASP组大鼠各死亡1只,模型组大鼠死亡2只。
1.3 治疗
正常组(n=10):同步饲养,无任何干预,只做与各干预组相同的抓取固定。
模型组(n=10):造模后无其它干预,只做与各干预组相同的抓取固定。
隔药灸组(n=10):造模结束即日起开始干预,取天枢(双)、气海穴,将附子、肉桂、丹参等药研末(上海中医药大学附属岳阳中西医结合医院药剂科提供)过100目筛,加黄酒拌成厚糊状,用模具压制而成直径0.5 cm,厚0.3 cm的药饼,置于所选穴位上,选用精制艾绒(南阳汉医艾绒厂)制约90 mg 重艾炷,置于药饼上,点燃施灸,每次每穴灸2壮,每日1次,共14次。
SASP组(n=10):柳氮磺胺吡啶肠溶片(上海三维制药有限公司,批号:200807C30)溶液灌胃。每日投药量按成人(体重70 kg)与大鼠(体重200 g)1:0.018的比例(据《药理实验方法学》)配制SASP溶液,每日2次,共14次。
1.4 标本采集
治疗结束后,大鼠24 h禁食、不禁水,按照50 mg·kg-1剂量2%戊巴比妥钠腹腔注射,待大鼠麻醉后,剖腹取大鼠远端结肠6 cm左右。沿肠系膜纵行剖开,用预冷的4℃生理盐水冲洗后,将截取的结肠分为两段,其中一段液氮中保存,待测;另一部分以10%的中性甲醛溶液固定,待测。
1.5 免疫印迹法检测大鼠结肠组织的TLR4和TNF-α
将大鼠结肠组织从-80℃冰箱中取出,置入匀浆器中,把组织剪切成细小的碎片;按照每20 mg组织加入100 μL裂解液的比例加入RIPA裂解液;冰浴匀浆,充分裂解后,12 000 rpm离心5 min,取上清;取部分上清蛋白用BCA蛋白浓度测定试剂盒测定蛋白浓度;取蛋白提取液40 μL加至样品孔中,留一孔加10 μL预染的Marker,接通电源,先用70 V恒压电泳,约30 min,后改用90 V恒压电泳1.5 h,当指示剂到达距凝胶下端约0.5 cm处时关闭电源,取出胶板;将胶浸泡于转移缓冲液中平衡15 min,按黑面(负极)→海绵→滤纸→胶→PVDF膜→滤纸→海绵→红面(正极)的顺序制备转膜“三明治”,每层铺好后先赶走气泡再铺另一层。在转移缓冲液中制备三明治可避免气泡的产生;接上正负极,按膜向正极的方向将转移盒放入电转仪中,加入转膜缓冲液;将电转仪置于冰水中,200 mA恒流转膜30 min、90 min;转膜结束后,快速取出PVDF膜,放入5%BSA室温封闭2 h;取出膜,于摇床上用TBST洗膜5 min×3次;孵育袋中加入封闭液稀释的TLR4 (weiao 1:1 000)、TNF-a (weiao 1:500 )和GAPDH(weiao 1:2 000),4℃孵育过夜;TBST洗膜5 min×3次,辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jackson 1:2 000)和辣根过氧化物酶(HRP)标记的羊抗小鼠二抗(Jackson 1:2 000)室温孵育2 h;TBST洗膜15 min×5次。膜于化学发光检测试剂(试剂A:试剂B=1:1)反应2 min,取出膜,甩去多余的液体,用保鲜膜包好PVDF膜,暗室中用X胶片感光、显影、定影。
1.6 大鼠结肠组织TLR3、TLR4 mRNA的FQPCR检测
从结肠组织抽提总RNA,按FQ-PCR试剂盒(QIAGEN公司,批号:QIAGEN204054)说明书进行逆转录反应合成cDNA,按ABI ViiA7 PCR仪(美国ABI 公司)的说明书将cDNA 进行PCR扩增。RNA提取:在绿豆大小的组织中加1 mL Trizol,用Tissue Ruptor匀浆器1 min,室温放置10 min;加200 μL氯仿,充分混匀,15 000转离心5-7 min;取上清,至1.5 mL Eppendorf管加600 μL氯仿,混匀,15 000转离心5 min;取上清,至1.5 mL Eppendorf管加500 μL异丙醇,混匀,15 000转离心10 min;弃上清,用75%乙醇1 mL冲洗,高速离心5 min;弃上清,RNA沉淀于空气中干燥(2-3 min);将干燥后的RNA溶解于RNA-free Water中;取1 μL总RNA测OD260,并定量。逆转录:在1.5 mL离心管中依次加入下列反应物(体积为12.5 μL):DEPC水(8-x)μL,RNA酶抑制剂(50 U·μL-1)0.5 μL,随机引物(50 pM·μL-1)2 μL,RNA x μL(2 μg)。65℃恒温处理5 min,室温放置10 min,高速(高于5 000 g)离心5 s;依次在1.5 mL离心管加入下列反应物(加入之后总体积为20 μL):RNA酶抑制剂(50 U·μL-1)0.5 μL,5× buffer(invitrogen)4 μL,dNTP MIX(10 mM/each)2 μL,DTT 2 μL,AMV(200 U·μL-1)1 μL,水浴40℃下反应1 h;90℃处理5-10 min;冰浴5 min;高速离心5 s。
荧光定量PCR扩增:序列与引物设计的序列参照Gene Bank 数据库中各目的基因的序列(见表1),引物由ABI公司的Primer Express Software v2.0设计,由华大基因公司合成。PCR反应体系(16 μL):H2O 5 μL,2×SYBGEEN PCR mix 8 μL,Primer(10 pM·μL-1)1 μL,Primer(10 pM·μL-1)1 μL,cDNA 1 μL。反应条件:95℃ 2 min,94℃ 10 s,60℃ 10 s,72℃ 40 s,循环40次。
1.7 统计学处理
数据采用SPSS for Windows 18.0统计软件进行统计学处理。计量资料采用均数±标准差表示,对数据作正态性检验。数据符合正态分布,采用One-way ANOVA,方差齐同时采用LSD比较组间差异性,方差不齐时用Games-Howell比较组间差异性,P<0.05作为差异有统计学意义;数据不符合正态分布,采用Mann-Whitney检验非参数检验。
2 结果
2.1 大鼠结肠组织病理学观察
在光学显微镜下,正常组结肠黏膜结构清晰,肠腺排列整齐、规则,结肠黏膜上皮完整,固有层可见散在淋巴细胞,无明显的炎性细胞浸润。模型组结肠黏膜可见黏膜缺损,黏膜绒毛破坏或缺失,黏膜及黏膜下层有大量单核细胞、巨噬细胞浸润,局部有充血水肿、腺体破坏或消失、溃疡形成。隔药灸组和SASP组结肠黏膜上皮及肠腺结构较为清楚,排列较模型组规则,溃疡已基本愈合,表面由新生上皮细胞所覆盖,部分仍有黏膜下水肿,炎性细胞浸润(见图1)。由此可知,与模型组比较,隔药灸组和SASP组大鼠结肠组织病理学损伤均有一定的改善。
2.2 大鼠结肠黏膜TLR4和TNF-α蛋白表达
模型组UC大鼠结肠黏膜TLR4和TNF-α的相对表达量明显高于正常组,隔药灸组与SASP组模型大鼠结肠黏膜TLR4和TNF-α的相对表达量较模型组明显下调(见表2、图2)。
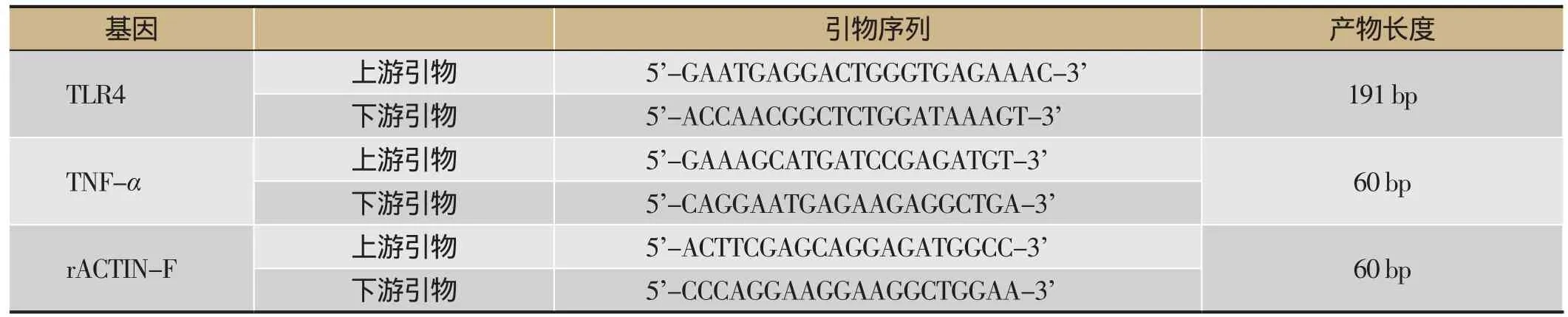
表1 引物探针序列
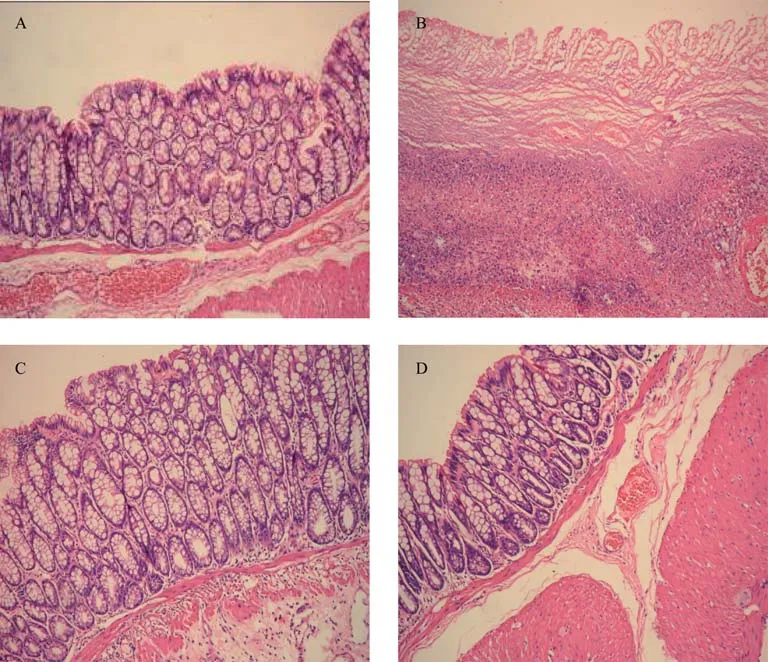
图1 各组在光学显微镜下的组织
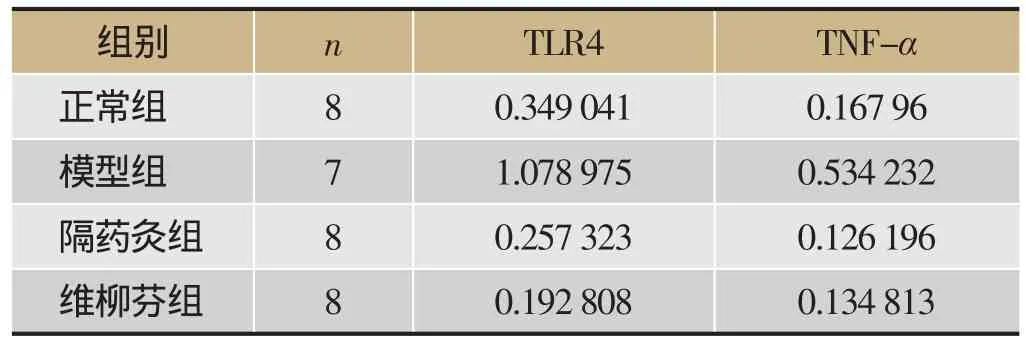
表2 大鼠结肠黏膜TLR4和TNF-α的相对表达量

图2 TLR4和TNF-α的相对表达情况
2.3 大鼠结肠黏膜TLR4 mRNA表达
与正常组相比,模型组大鼠结肠黏膜的TLR4 mRNA的表达明显升高(P<0.01);隔药饼灸组和SASP组大鼠结肠黏膜的TLR4 mRNA的表达明显低于模型组(P<0.01);隔药饼灸组结肠黏膜TLR4 mRNA表达与SASP组相比差异无统计学意义(P>0.05)。见表3。
2.4 大鼠结肠黏膜TNF-α mRNA表达
与正常组相比,模型组大鼠结肠黏膜的TNF-αmRNA的表达明显升高(P<0.05);隔药饼灸组和SASP组大鼠结肠黏膜的TNF-αmRNA的表达明显低于模型组(P<0.05);隔药饼灸组结肠黏膜TNF-αmRNA表达与SASP组相比差异无统计学意义(P>0.05)。见表4。
3 讨论
TLRs是与UC关系密切的模式识别受体。肠道粘膜上皮细胞、内分泌细胞、固有层的巨噬细胞、树突状细胞、纤维母细胞,以及微血管内皮细胞均表达该受体,在肠粘膜免疫中发挥重要作用[18-20]。目前的研究认为,TLRs是在UC发生中扮演重要角色[21],内毒素(Lipopolysaccharide,LPS)介导的细胞信号转导通路在UC的炎症反应中起了至关重要的作用,TLR4是第一个被发现存在于人细胞表面与LPS跨膜信号转导密切相关的TLR,是LPS跨膜信号转导的关键受体之一[22,23]。有关研究显示,UC患者的TLR4表达上调[24]。本研究发现,UC大鼠结肠组织TLR4的蛋白和mRNA表达明显上调,艾灸干预后TLR4的蛋白和mRNA表达均下调,这表明艾灸可能通过调节TLR4的表达从而改善UC肠道炎症反应。
表3 大鼠结肠黏膜TLR4 mRNA表达的影响
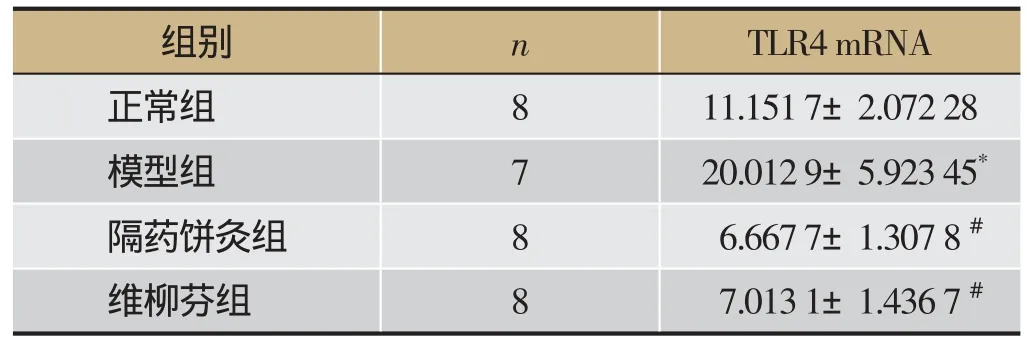
表3 大鼠结肠黏膜TLR4 mRNA表达的影响
注:与正常组相比,*P<0.01,与模型组相比,#P<0.01。
表4 大鼠结肠黏膜TNF-α mRNA表达的影响
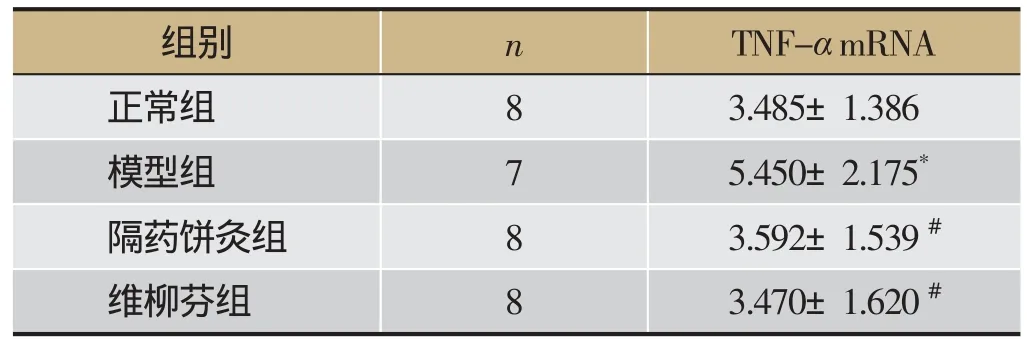
表4 大鼠结肠黏膜TNF-α mRNA表达的影响
注:与正常组相比,*P<0.05,与模型组相比,#P<0.05。
TNF-α是促炎症细胞因子,是机体炎症反应和免疫应答的重要调节因子[25]。TNF-α通过诱导一氧化氮合酶(inducible Nitric Oxide Synthase,iNOS),使NO增加,引起炎症,并通过刺激单核细胞和巨噬细胞合成和释放IL-1和IL-8等使炎症进一步加重,在UC的发病中发挥重要作用[26]。本研究发现,UC大鼠结肠组织TNF-α的蛋白和mRNA表达明显上调,这表明TNF-α参与了UC肠道炎症反应;艾灸干预后TNF-α的蛋白和mRNA表达均下调,这表明艾灸可能通过调节TNF-α的表达抑制UC肠道炎症反应。
根据其主症,UC归属于中医学的“肠澼”、“下利”、“久泄”、“久痢”等病症范畴,其病机是脾胃虚弱为本,湿热留滞为标。本研究采用隔药灸疗法进行干预治疗,药饼采用附子、肉桂、丹参、红花、木香、黄连等配制而成,方中附子和肉桂均可温阳散寒除湿,木香行气调中止痛,三药共伍可温阳健脾,理气和中以治其本;佐以黄连、丹参、红花等药而奏清热利湿、理气化瘀之效。因此,针灸治疗UC不仅可以改善其临床症状和病理特征,还可促进其炎性反应吸收和溃疡修复,保护肠黏膜,促进肠黏膜的修复[27,28],并能明显改善UC模型大鼠肠道有益菌群的含量[16]以及菌群的多样性[29],对UC大鼠肠道微生态的保护作用。前期研究也发现,艾灸能有效地抑制UC模型大鼠TLR2信号通路中的上下游信号分子的异常表达,调节结肠黏膜局部过激的免疫反应,促进结肠黏膜损伤的修复[14]。本研究发现,UC模型大鼠结肠黏膜TLR4和TNF-α蛋白及mRNA表达均显著增加,推测UC可通过TLR4信号通路产生炎性反应;隔药灸和SASP均能下调溃疡性结肠炎大鼠结肠TLR4和TNF-α的蛋白及其mRNA表达。因此,本研究认为对TLR4和TNF-α表达的调节可能是隔药灸治疗UC的重要机制之一。
总之,TLRs及其信号通路不仅参与了UC的发病过程,还在介导UC肠道黏膜免疫反应中发挥重要作用,而艾灸不仅能改善UC的结肠组织病理学改变,还通过调节TLRs受体及其介导的信号通路发挥免疫调节作用,促进UC结肠黏膜损伤的修复。
1 Burisch J, Munkholm P. Inflammatory bowel disease epidemiology.Curr Opin Gastroenterol, 2013, 29(4): 357-362.
2 Ananthakrishnan A N, Khalili H, Konijeti G G,et al. Long-term intake of dietary fat and risk of ulcerative colitis and Crohn’s disease.Gut, 2014, 63(5): 776-784.
3 Pant C, Anderson M P, Deshpande A, Grunow J E,et al. Trends in hospitalizations of children with inflammatory bowel disease within the united states from 2000 to 2009.J Investig Med. 2013, 61(6): 1036-8.
4 Lakatos L, Kiss L S, David G,et al. Incidence, disease phenotype at diagnosis, and early disease course in inflammatory bowel diseases in Western Hungary, 2002-2006.Inflamm Bowel Dis. 2011, 17(12): 2558-65.
5 Ng S C, Tang W, Ching J Y,et al. Asia–Pacific Crohn’s and Colitis Epidemiologic Study (ACCESS) Study Group. Incidence and phenotype of inflammatory bowel disease based on results from the Asia-pacific Crohn’s and colitis epidemiology study.Gastroenterology. 2013, 145(1): 158-165.
6 Seya T, Miyake K. Toll-like Receptors.John Wiley & Sons,Ltd, 2009.
7 Bogunovic M, Davé S H, Tilstra J S,et al. Enteroendocrine cells express functional Toll-like receptors.Am J Physiol Gastrointest Liver Physiol, 2007, 292(6): 1770-1783.
8 Oostenbrug L E, Drenth J P, de Jong D J,et al. Association betweenToll-like receptor 4 and inflammatory bowel disease.Inflamm Bowel Dis, 2005, 11(6): 567-575.
9 Heimesaat M M, Fischer A, Jahn H K,et al. Exacerbation of murine ileitis by Toll-like receptor 4 mediated sensing of lipopolysaccharide from commensal Escherichia coli.Gut, 2007, 56(7): 941-948.
10 Cario E, Podolsky D K. Differential alteration in intestinal epithelial cell expression of toll-like receptor 3 (TLR3) and TLR4 in inflammatory bowel disease.Infect Immun. 2000, 68(12): 7010-7017.
11 陈晓,王启之,梁冰,等. Toll样受体4、肿瘤坏死因子-α在溃疡性结肠炎大鼠结肠组织中的表达及意义. 蚌埠医学院学报, 2013, 38(2): 134-136.
12 Wu H G, Chen H P, Hua X G,et al. Clinical therapeutic effect of drug-separated moxibustion on chronic diasrrhea and its immunologic mechanisms.J Tradit Chin Med, 1997, 17(4): 253-258.
13 Zhou E H, Liu H R, Wu H G,et al. Down-regulation of Protein and mRNA Expression of IL-8 and ICAM-1 in Colon Tissue of Ulcerative Colitis Patients by Partition-Herb Moxibustion.Dig Dis Sci, 2009, 54: 2198-2206.
14 Wang X M, Liu Y N, Dong H S,et al. Herb-partitioned Moxibustion Regulates the TLR2/NF-κB Signaling Pathway in a Rat Model of Ulcerative Colitis.Evidence-Based Complementary and Alternative Medicine, 2015, 2015: 949065.
15 Chen Z, Wang X M, Wang J H,et al. Effect of Moxibustion on the Expressions of Protein KGF-1, KGF-2 and IL-6 in Rats’ Colon with Ulcerative Colitis.World J Gastroentero, 2012, 10(3): 138-145
16 Wang X M, Lu Y, Wu L Y,et al. Moxibustion inhibits interleukin-12 and tumor necrosis factor alpha and modulates intestinal flora in rat with ulcerative colitis.W J Gastroentero, 2012, 18(46): 6826-6835.
17 Xu SY, Bian RL, Chen X. Methodology of Pharmaceutical Experiment.Beijing: People’s Medical Publishing House, 2002.
18 Kenji Kurokawal, Kyoung-Hwa Ryu, RieIchi kawa,et al. Novel bacterial lipoprotein structures conserve dinlow-GC content Grampositive bacteria are recognized by Toll-like receptor 2.J Biol Chem. 2012, 287(16): 13170-13181.
19 TheoS Plantinga, WendyW Cvan Maren, Jeroenvan Bergenhenegouwen, et al. Differential Toll-like recept or recognition and induction of cytokine profile by Bifidobacterium breve and Lactobacillus strains of probiotics.Clinical and Vaccine Immunology, 2011,18: 621- 628 .
20 Thomas C M, Hong T, van Pijkeren J P,et al. Derived from Probiotic Lactobacil lusreuteri Suppresses TNF-a Modulation of PKA and ERK Signaling.PLoS One, 2012, 7: e31951 .
21 Heuschen G, Leowardi C, Hinz U,et al.Differential expression of tolllike receptor 3 and 5 in ileal pouch mucosa of ulcerative colitis patients.Int J Colorectal Dis, 2007, 22(3): 293-301.
22 Poltorak A, He X, Smirnova I,et al. Defective LPS signaling in C3H /HeJ and C57BL /10ScCr mice: mutations in Tlr4 gene.Sci, 1998, 282(4): 2085-2088.
23 Gioannini T L, Weiss J P. Regulation of interactions of Gram-negative bacterial endotoxins with mammalian cells.Immunol Res, 2007, 39(1/3): 249-260.
24 Park S J, Lee M Y, Son B S,et al. TBK1-targeted suppression of TRIF-dependent signaling pathway of Toll-like receptors by 6-shogaol, an active component of ginger.Biosci Biotechnol Biochem, 2009, 73(7): 1474-1478.
25 王万卷,陈丽,王晓鹏,等.寻常型银屑病皮肤肿瘤坏死因子-α、基质金属蛋白酶9及其抑制剂-1的表达.西安交通大学学报(医学版), 2007, 28(3): 322-324.
26 张超贤,秦咏梅.溃疡性结肠炎患者血清肿瘤坏死因子-α、白细胞介素-8水平变化及其临床意义. 西安交通大学学报(医学版), 2009, 30(5): 646-647.
27 马晓芃.桑小宁.吴焕淦.等.针灸对溃疡性结肠炎大鼠肠黏膜形态学及GH、IGF-1表达的影响.中华中医药学刊, 2007, 25(7): 1362-1364.
28 施征,马晓芃,吴焕淦,等.针灸调节大鼠溃疡性结肠炎结肠组织COX-2及IL-1β的研究.江西中医学院学报, 2004, 16(3): 38-40.
29 侯天舒,韩晓霞,杨阳,等.电针对溃疡性结肠炎大鼠肠道微生态的保护作用. 针刺研究, 2014, 39(1): 27-34.
Effect of Herb-partition Moxibustion on Protein and mRNA Expressions of TLR4 and TNF-α in Rats with Ulcerative Colitis
Wang Xiaomei1, Huang Yan1, Wang Yuanyuan2, Liu Yanan2, Qi Qin2, Jin Feng3, Hua Xuegui1, Wu Huangan1
(1. Shanghai Research Institute of Acupuncture-Moxibustion and Meridian, Shanghai 200030, China; 2. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 3. Fudan University Shanghai Cancer Center, Shanghai 200032, China)
This study was aimed to observe the effect of herb-partition moxibustion on the protein and mRNA expressions of Toll-like receptor 4 (TLR-4) and tumor necrosis factor-α (TNF-α) in rats with ulcerative colitis (UC), and to further explore the mechanism of herb-partition moxibustion on UC. A total of 40 male SD rats wererandomly divided into four groups: the normal group, the model group, the herb-partition moxibustion group and the sulfasalazine (SASP) group. Herb-partition moxibustion was used onTianshuandQihaiacupoint in the herbpartition moxibustion group, and SASP gavage was used in the SASP group. The colonic pathological change was detected by HE staining. Protein and mRNA expression of TLR-4 and TNF-α were detected by western blot and FQ-PCR methods, respectively. The results showed that pathological damages appeared in colon tissues of the model rats. Compared with the model group, the colon pathological damage was improved in the herb-partitioned moxibustion group and the SASP group. Protein and mRNA expression of TLR-4 and TNF-α were significantly increased in the model group rats compared with the normal group (P<0.05). After herb-partitioned moxibustion and SASP treatments, the protein and mRNA expression of TLR-4 and TNF-α were significantly decreased (P<0.05). It was concluded that TLR-4 and TNF-α may play an important role in inflammatory injury of UC. Herb-partitioned moxibustion can reduce the expression of TLR-4 and TNF-α. It suggested that the underlying mechanism may be the down-regulation of the cascade reaction mediated by TLR4 and TNF-α expression to achieve the purpose of moxibustion to treat UC.
Moxibustion therapy, ulcerative colitis, Toll-like receptor 4, tumor necrosis factor-α
10.11842/wst.2016.03.008
R245
A
(责任编辑:马雅静 张志华,责任译审:王 晶)
2016-02-14
修回日期:2016-03-04
* 国家自然科学基金委面上项目(81473758):艾灸调节溃疡性结肠炎肠道菌群多样性及艾灸血清对其LPS信号通路的作用机制研究,负责人:王晓梅;上海市教委科研创新项目(2014YZ052):艾灸对溃疡性结肠炎患者肠道菌群的调节作用及其效应机制,负责人:王晓梅;科学技术部国家重点基础研究发展计划“973计划”项目(2015CB554501):艾灸效应的启动机制及其内源性调节作用的机理研究,负责人:吴焕淦;上海市人才发展资金(2014068):艾灸对溃疡性结肠炎肠道菌群多样性的调节作用及其效应机制研究,负责人:王晓梅。
** 通讯作者:吴焕淦,本刊编委,教授,博士生导师,主要研究方向:针灸作用的基本原理与应用规律研究。

