银负载氧化锌复合材料的制备及其抗菌性能*
张江涛,汤皎宁,朱光明,曹广忠,吴海林,陈焕文,龚晓钟(深圳大学.材料学院深圳市特种功能材料实验室;.机电与控制工程学院,深圳电磁控制重点实验室;.化学与环境工程学院,广东深圳518060)
银负载氧化锌复合材料的制备及其抗菌性能*
张江涛a,汤皎宁a,朱光明a,曹广忠b,吴海林a,陈焕文c,龚晓钟c
(深圳大学a.材料学院深圳市特种功能材料实验室;b.机电与控制工程学院,深圳电磁控制重点实验室;c.化学与环境工程学院,广东深圳518060)
摘要:以ZnO纳米颗粒为核心,AgNO3为银源,甲醛为还原剂,采用简单的三步法制备出了银负载氧化锌复合材料。采用扫描电子显微镜(SEM)、X射线能谱仪(EDS)、X-射线衍射仪(XRD)、光致发光光谱(PL)、激光扫描共聚焦显微镜(CLSM)、抑菌圈法、抗生素对比试验、细菌比浊法等分析技术研究了所制备银负载氧化锌复合材料的微观结构及抗菌性能。结果表明,制备出的银负载氧化锌复合材料,ZnO的晶相并未改变,且银均匀的负载在氧化锌表面,负载程度可以通过改变银-三乙醇胺溶液的浓度进行微调;该复合材料对革兰氏菌有很好的抗菌性能,且负载程度越高,产物抗菌性能越大。
关键词:银负载;氧化锌;三步法;革兰氏菌;抗菌性
作为广谱抗菌物质,纳米Ag已经成为当前最为广泛的商业纳米材料,在生物医学和许多消费品领域具有广泛的应用。它具有高效、安全、生物相容性较好等特性[1]。ZnO是一种N型半导体,在光学和电学等方面的应用受到广泛关注[2-4]。近年来,ZnO颗粒的光催化活性和抗菌性能的相关研究也得到了大量的关注[5,6]。纳米级ZnO颗粒具有较强的抗菌活性,但是当其尺寸增加到数百纳米时,其抗菌活性将大大减小[7]。纳米Ag具有优异的抗菌性能和广谱性,但其成本相对较高,而且稳定性较差,使得其在某些领域(例如抗菌涂层、外包装食品罐的衬料等)的应用受到限制[8]。在综合考虑二者的优缺点后,本文提出制备纳米Ag与大尺寸ZnO颗粒的复合粉体(即Ag负载ZnO复合材料),在增强大尺寸ZnO颗粒抗菌性的前提下,降低了纯Ag纳米颗粒的制备成本。ZnO具有光催化效应[9,10],在光照条件下,可以加速其表面的Ag纳米颗粒的氧化和Ag+的溶出,能大幅度的增强复合纳米颗粒的抗菌性能[10]。而且单独的ZnO纳米颗粒或Ag纳米颗粒的抗菌范围相对较窄[11],将二者制备成复合纳米材料具有更高的抗菌活性。本文将对Ag负载ZnO复合纳米材料的抗菌机制进行探究。
1 实验部分
1.1主要材料
AgNO3(AR99%),三乙醇胺(AR98%),纳米ZnO (50±10nm,金属基99.8%),阿拉丁试剂;甲醛(AR 37%~40%(广州东红化工厂);氨苄青霉素钠(生工生物工程(上海)股份有限公司);大肠埃希氏杆菌(ATCC25922),金黄色葡萄球菌(ATCC6538),广东省微生物中心。
1.2样品的制备
(1)称取一定量的AgNO3,溶解到50mL水中,加入三乙醇胺(TEA)溶液5mL,再加水至100mL。在60℃下搅拌2h,得到银-三乙醇胺([Ag(TEA)2]+)溶液。
(2)称取200mg的ZnO,超声分散于50mL3mM 的SnCl2溶液中,常温下激烈搅拌1h,使Sn2+充分吸附在ZnO表面,离心,去除上清液。再超声分散于50mL的[Ag(TEA)2]+溶液中,常温下搅拌1h。离心,去除上清液。
(3)将离心所得沉淀再一次分散于50mL的[Ag (TEA)2]+溶液中,在搅拌状态下向溶液中滴加2mL 0.48M的甲醛溶液,常温下搅拌1h。离心,去除上清液,重复3次,得到灰白色粉末。将此灰白色的粉末在300℃下煅烧4h,随炉冷却至室温。得到Ag负载ZnO复合材料。
(4)将20mL的菌种溶解到40℃的培养基中,再无菌注入到洁净的培养皿,冷却至室温。用无菌移液器枪将0.5mL的菌悬液注入到培养皿内,均匀涂布。将ZnO粉末和Ag负载ZnO复合材料压制成片状,添加到培养皿中,在37℃的恒温下放置,18h后取出,观察抑菌圈的大小情况。
1.3样品的分析表征
采用日立SU-70热场发射扫描电镜(SEM)观测ZnO纳米颗粒及Ag负载ZnO复合材料的形貌特征;采用D8ADVANCE型X-射线衍射仪(XRD)分析ZnO纳米颗粒及Ag负载ZnO复合材料的物相;采用S-3400N(II)型X射线能谱仪(EDS)分析Ag负载ZnO复合材料的元素种类与含量;采用DW-PLE光致发光光谱仪(PL)检测Ag对ZnO的包覆情况;采用Leica TCS SP8型激光共聚焦显微镜(CLSM)观察细菌内ROS(需氧细胞在代谢过程中产生一系列活性氧簇,包括:O2-·、H2O2及HO2·、·OH等)生成情况。
2 结果与讨论
2.1扫描电子显微镜(SEM)结果与分析

图1 ZnO纳米颗粒Fig.1 ZnO nanoparticles

图2 不同[Ag(TEA)2]+浓度下制备的Ag负载ZnO 的SEM图谱Fig.2 SEM pictures of Silver load ZnO perpared with different[Ag(TEA)2]+concentration
图1为ZnO纳米颗粒的SEM图谱,其形状不规则,有块状、棒状和球状,粒径分布在50nm至500nm之间,粒径分布范围较大。
图2为不同[Ag(TEA)2]+浓度下制备的Ag负载ZnO的SEM图谱。
从图2中可以看出,ZnO的表面均出现了大小不一的小颗粒。随着[Ag(TEA)2]+的浓度的增加,ZnO表面的颗粒粒径逐渐增加,粒径的分布范围越来越大。在较低浓度下(图2中A,B),ZnO表面的颗粒呈现球形而且分布均匀;随浓度的增加,ZnO表面颗粒由球形变为扁的椭球形(图2中C,D),这是因为颗粒长大使得相邻几个颗粒合并为一个颗粒。此时颗粒粒径分布仍比较均匀;随着颗粒的进一步长大(图2中E,F),少量的颗粒开始从ZnO表面脱落,这是生长过大所致,同时也说明纳米颗粒在ZnO表面的附着力不大。
ZnO溶于水时,半导体会向O2分子发生电荷转移,半导体的空间电荷区会带正电荷,最外层吸附的O2则会带上负电荷,Sn2+会充分的吸附在ZnO的表面。再向该体系加入适量的[Ag(TEA)2]+溶液,ZnO表面的Sn2+就会将[Ag(TEA)2]+中的Ag+还原成Ag(反应式(1)),且吸附在ZnO表面,生成Ag籽晶。再往里面继续加入适量[Ag(TEA)2]+溶液,并且加入少量强还原剂甲醛,甲醛继续将[Ag(TEA)2]+中的Ag+还原(反应式(2))并吸附在ZnO表面,使Ag籽晶长成大颗粒。

由上式可以看出[Ag(TEA)2]+的浓度直接影响到Ag的负载量,所以实验中通过改变[Ag(TEA)2]+的浓度来改变Ag负载ZnO复合材料中Ag的负载量。
2.2X-射线能谱(EDS)结果与分析
图3为Ag负载ZnO复合材料的EDS图谱。
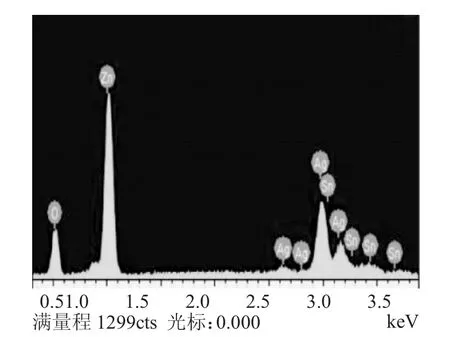
图3 Ag负载ZnO的EDS图谱Fig.3 EDS spectrum of Silver load ZnO
由图3中元素可以看出,ZnO中确实含有Ag元素,说明三步法成功制备出了Ag负载ZnO复合材料。
2.3X-射线衍射仪(XRD)结果与分析
图4为不同[Ag(TEA)2]+浓度条件下制备的Ag负载ZnO复合材料的XRD图谱。
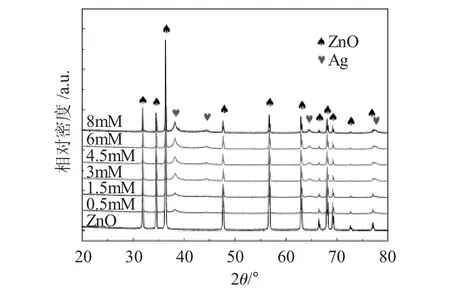
图4 不同[Ag(TEA)2]+的浓度下制备的Ag负载ZnO的XRD图谱Fig.4 XRD spectrum of Silver load ZnO prepared with different[Ag(TEA)2]+concentration
由图4可见,[Ag(TEA)2]+的浓度不同,ZnO表面覆盖的Ag颗粒的生长程度也不同,使ZnO被包覆程度有差异。根据衍射峰的位置,可以判断出ZnO和Ag负载ZnO的晶体结构类型均为红锌矿,面心立方结构,没有出现晶相的转变,说明Ag的负载并没有明显地改变ZnO的晶相体结构。结合SEM形貌分析,可以推测出Ag的负载主要集中在ZnO的表面区域,而对其内部晶格结构影响较小。而且从图谱中可以看出,Ag的衍射峰随着[Ag(TEA)2]+的浓度的增大而变得越来越尖锐,半高宽越来越小,说明Ag负载ZnO中Ag的粒径越来越大,结晶度越来越好。
2.4光致发光光谱(PL)结果与分析
为了检测Ag对ZnO的包覆情况,采用光致发光光谱对其进行检测,图5是不同[Ag(TEA)2]+浓度条件下制备的Ag负载ZnO复合材料的PL谱图。

图5 不同[Ag(TEA)2]+的浓度下制备的Ag负载ZnO的PL谱Fig.5 PL spectrum of Silver load ZnO prepared with different[Ag(TEA)2]+concentration
由图5可见,Ag对ZnO的包覆程度越高,Ag负载ZnO复合材料在紫外区域的发光强度越弱。从图5中可知,随着Ag(TEA)2]+的浓度的增加,样品在380 nm处的发射峰的强度逐渐减弱,这说明Ag对ZnO表面的包覆率越来越高,这个结果与图2中的结果基本一致。
3 抗菌实验结果
3.1抑菌圈法抑菌实验
为了检测Ag负载ZnO复合材料的抑菌效果,我们以革兰氏菌中的两种菌为研究对象,革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌。采用抑菌圈法考察了Ag负载ZnO复合材料的抑菌效果。图6是ZnO粉末压片以及不同[Ag(TEA)2]+浓度条件下制备的Ag负载ZnO复合材料(图2中BCDE样品)压片对大肠杆菌的抑菌效果图。
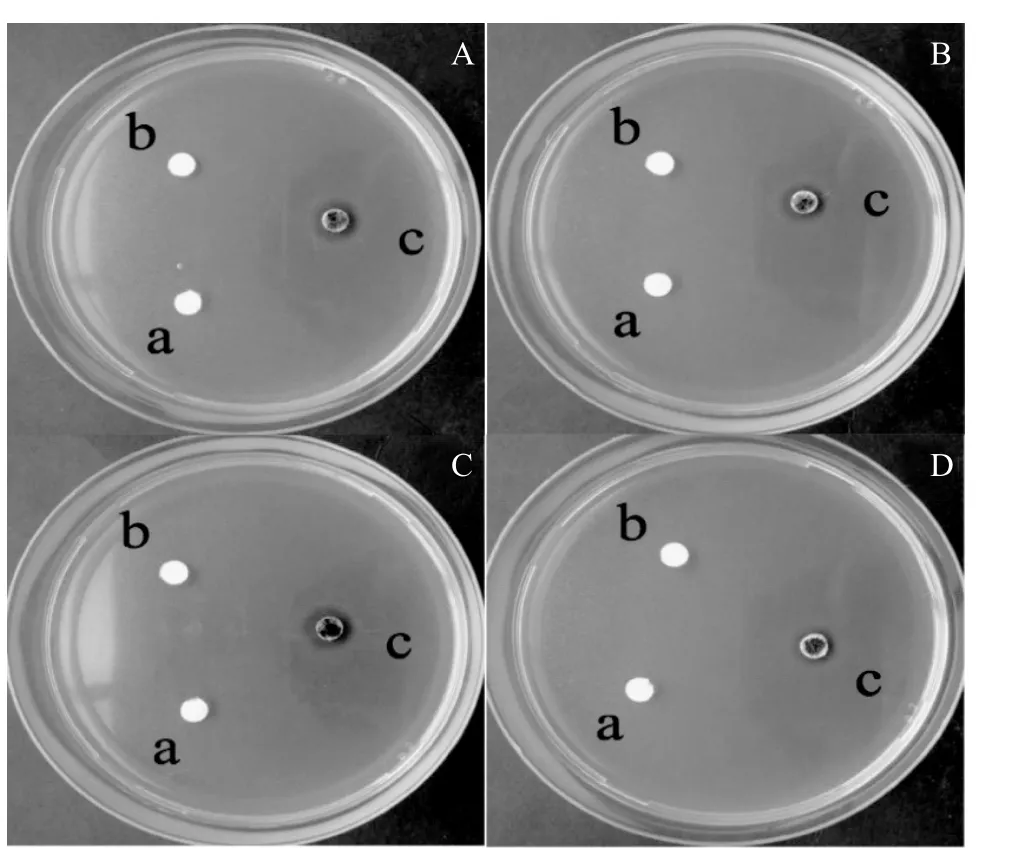
图6 不同抗菌材料对大肠杆菌的抑菌圈Fig.6 Antibacterial effect of different antimicrobial material on E.coli
从图6中可知,ZnO压片未产生抑菌圈,而Ag负载ZnO复合材料均产生了抑菌圈,这说明Ag负载ZnO复合材料对大肠杆菌的抗菌性主要来源于其表面负载的Ag,其抑菌圈平均值见表1,D>C>B>E。上述结果表明Ag负载ZnO复合材料具有抑菌作用,但抑菌效果不突出。革兰氏阴性菌由于其细胞壁结构含有革兰氏阳性菌不具有的外膜、孔蛋白、脂蛋白及脂多糖,其中脂多糖具有部分选择性屏障功能,能控制离子进出细胞,使细胞壁的通透性减弱[12]。在一定程度上阻碍了Ag+进入细胞,所以大肠杆菌对Ag负载ZnO复合材料的敏感性下降。这个结果与Ag对ZnO表面的包覆率一致,即包覆率越高,抑菌圈越大。E样品的抑菌能力很低,主要是因为ZnO表面的Ag颗粒生长过大,脱离下来。
图7是ZnO粉末压片以及不同[Ag(TEA)2]+浓度下制备的Ag负载ZnO复合材料(图2中BCDE样品)压片对金黄色葡萄球菌的抑菌效果图。
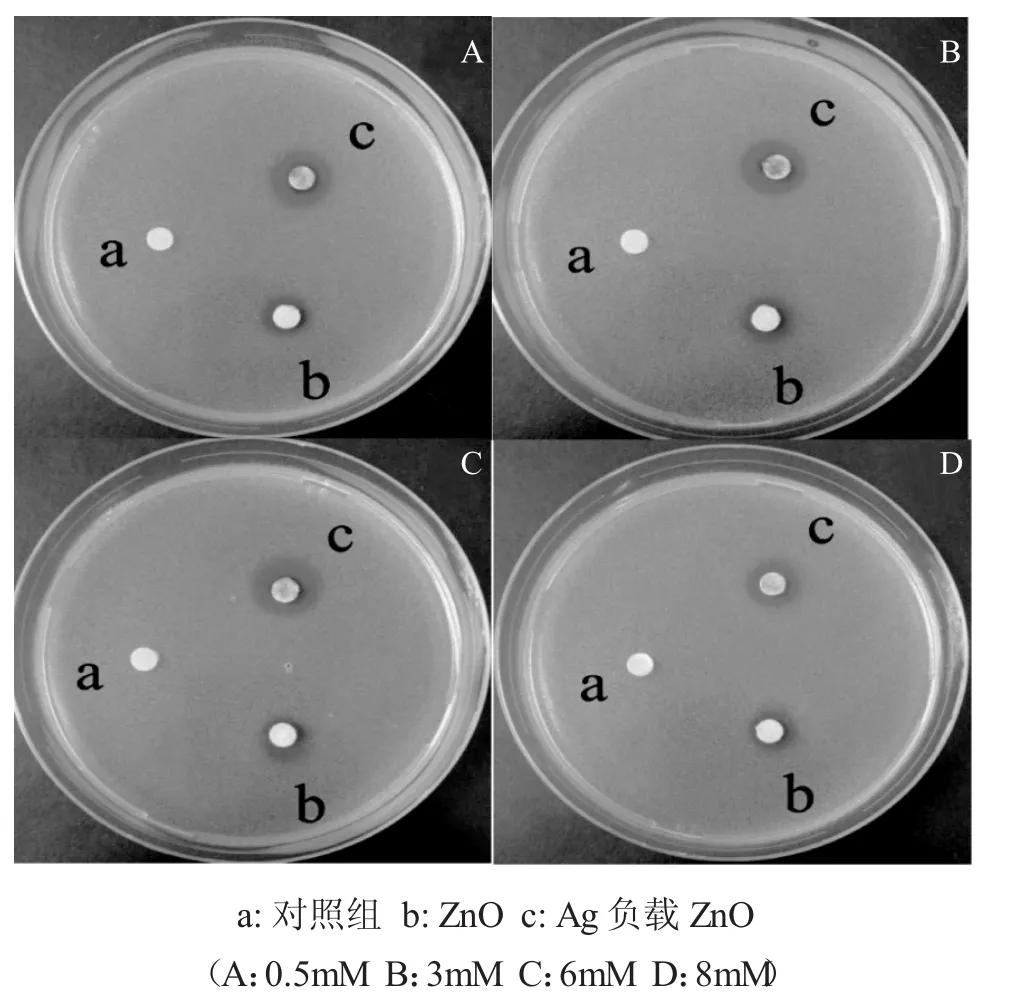
图7 不同抗菌材料对金黄色葡萄球菌的抑菌圈Fig.7 Antibacterial effect of different antimicrobial material on Staphylococcus aureus
由图7可见,革兰氏阳性菌细胞壁由肽聚糖和磷壁酸,其细胞壁的通透性较强[13]。因此,革兰氏阳性菌比革兰氏阴性菌对Ag负载ZnO复合材料更敏感。据此,我们采用抑菌圈法,考察了它对金黄色葡萄杆菌的抑制作用。
由图7可见,与大肠杆菌不同,ZnO压片对金黄色葡萄球菌产生了明显的抑菌圈,抑菌圈的平均值为6.15 mm;而且相比于ZnO,Ag负载ZnO复合材料产生了更明显的抑菌圈,这说明Ag负载ZnO复合材料对金黄色葡萄杆菌的抗菌性来源于ZnO与其表面Ag的协同作用,抑菌圈平均值见表1,D>C>B>E。这个结果也与Ag对ZnO表面的包覆率一致,即包覆率越高,抑菌圈越大。而且Ag负载ZnO复合材料对金黄色葡萄球菌的抑菌圈比大肠杆菌大,这说明Ag负载ZnO复合材料对金黄色葡萄球菌的抗菌性能要强于大肠杆菌。

表1 抑菌圈的平均直径Tab.1 Average diameter of bacteriostatic ring
3.2激光扫描共聚焦显微镜(CLSM)结果与分析
为了进一步了解Ag负载ZnO复合材料对金黄色葡萄杆菌的抗菌机理,采用激光扫描共聚焦显微镜(CLSM)观察了在D样品作用下金黄色葡萄杆菌细胞内部ROS的生成情况,其结果见图8。
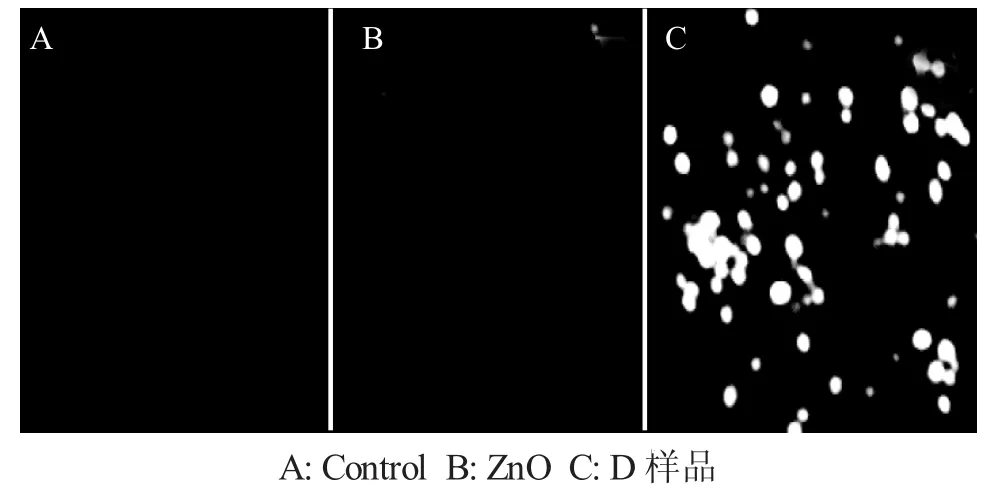
图8 不同抗菌材料作用下金黄色葡萄杆菌的CLSM照片Fig.8 CLSM pictures of Staphylococcus aureus under different antimicrobial material
由图8可见,A中金黄色葡萄杆菌细胞产生的荧光非常微弱,几乎难以识别,B中细胞产生的荧光相对于A有所增强,但是仍然比较微弱,C中细胞产生的荧光相比于A和B大大增强,说明与对照组相比,在单纯的ZnO作用下,金黄色葡萄杆菌细胞细胞内部产生的ROS量并没有明显增加,而在D样品作用下,细胞内部的ROS产生量则大大增加。根据文献[14],细胞中ROS的大量累积将会使细胞内产生氧化应激,并通过细胞壁进入细胞内发生如下反应(式3,4)产生有机自由基。由于自由基是一类化学活性非常活跃的物质,能够直接作用于蛋白质,使多肽链断裂或通过与之交联导致其损坏;自由基还能与脂类反应产生非常具有破坏力的过氧化脂质,可进一步与巯基酶类、核糖核酸酶等反应,导致它们失去正常的活性,甚至能导致DNA和RNA之间的交联,使DNA发生基因突变,最终导致细胞不能正常生长,甚至发生死亡。由于Ag负载ZnO复合材料粒径较大,而且金黄色葡萄球菌表面有一层细胞壁保护,它不能对细胞表面造成损伤或进入到细胞内部造成细胞损伤。因此,主要是通过释放Ag+达到对细菌的抑制作用。
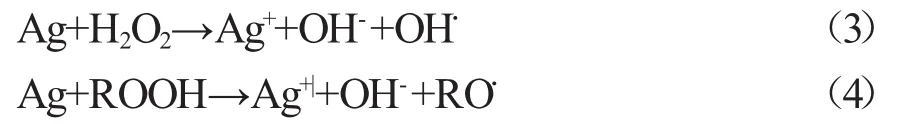
式中为有机自由基。
3.3抗生素对比实验
为了进一步了解Ag负载ZnO复合材料的抗菌能力,图9为不同浓度的氨苄青霉素对两种革兰氏的抑菌圈,将图6、7与图9中的实验结果进行对比。对比后发现:Ag负载ZnO复合材料对金黄色葡萄球菌的抑菌能力介于500μg·mL-1的氨苄青霉素和1000μg·mL-1的氨苄青霉素钠之间;Ag负载ZnO复合材料对大肠杆菌的抑菌能力介于125μg· mL-1的氨苄青霉素和250μg·mL-1的氨苄青霉素钠之间。
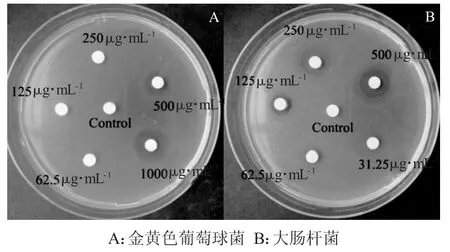
图9 不同浓度的氨苄青霉素抗生素对两种革兰氏的抑菌圈Fig.9 Antibacterial effect of different concentrations of antibiotics on Gram
3.4比浊法抑菌实验
为了进一步研究Ag负载ZnO复合材料中Ag元素的含量(由X-射线能谱仪测定)与细菌抑制率的关系,我们用比浊法确定了Ag负载ZnO复合材料中Ag元素含量和两种微生物抑菌率的关系。图11是不同Ag元素含量的抗菌材料对大肠杆菌的抑菌率。
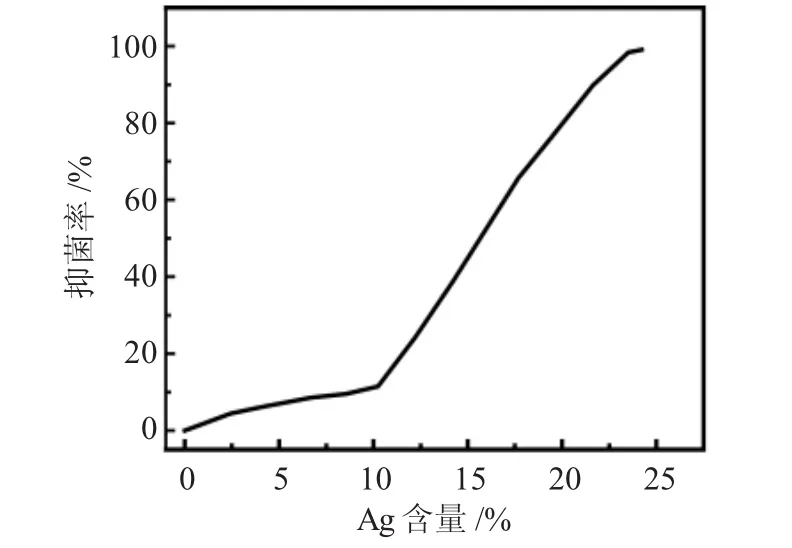
图10 不同Ag元素含量的抗菌材料对大肠杆菌的抑菌率Fig.10 Antibacterial rate of antibacterial materials with different contents of Ag on E. Coli
当Ag元素在10.24(wt)%以下时,对大肠杆菌的抑菌率很低,表明低含量Ag元素的抗菌材料对革兰氏阴性菌的抑制作用很低,这与抑菌圈实验的结果一致;当Ag元素含量大于10.24(wt)%时,抑菌率迅速上升;当Ag元素达到23.51wt%时,其抑菌率接近100%。
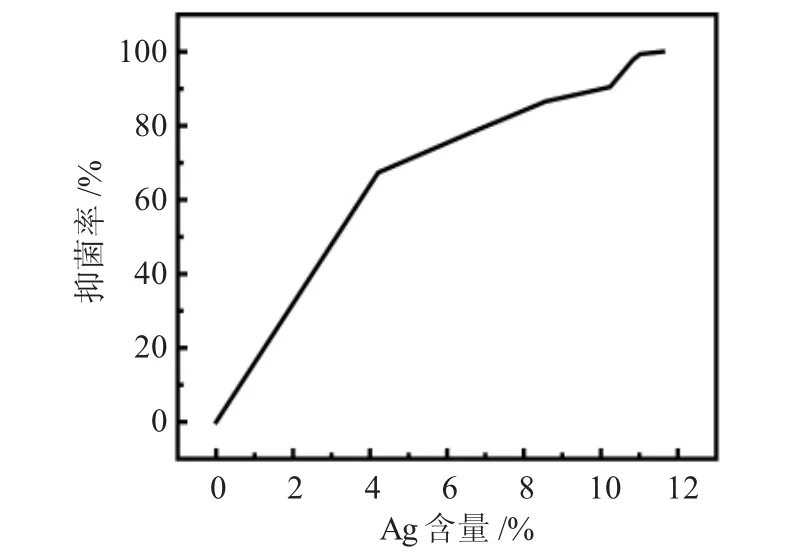
图11 不同Ag元素含量的抗菌材料对金色葡萄杆菌的抑菌率Fig.11 Antibacterial rate of antibacterial materials with different contents of Ag on Staphylococcus aureus
图11是不同Ag元素含量的抗菌材料对金色葡萄杆菌的抑制率,当Ag元素含量为4.21(wt)%时,抑菌率已经达到67%,表明金黄色葡萄杆菌对Ag负载ZnO复合材料非常敏感,这与抑菌圈法实验的结果一致,随着Ag元素含量的增加,抗菌材料对金色葡萄杆菌的抑制率呈线性增长。当Ag元素为11.62(wt)%时,其对金色葡萄杆菌的抑菌率可达100%。这表明Ag负载ZnO复合材料对革兰氏阳性菌有明显的抑制作用。
为了进一步研究Ag负载ZnO复合材料的抑菌原因,我们用比浊法测定了0.4174mol·L-1AgNO3溶液(与4.21(wt)%的Ag负载ZnO复合材料中Ag元素的量相同)对金色葡萄杆菌的抑制率,达到61.21%,说明Ag+具有细胞毒性,Ag负载ZnO复合材料具有抗菌性,主要是因为它能释放Ag+并通过细胞壁进入细胞内。使细胞不能正常生长,甚至发生死亡。
4 结论
以ZnO纳米颗粒为核心,AgNO3为银源,甲醛为还原剂,采用简单的三步法制备出了Ag负载ZnO复合材料。用扫描电子显微镜(SEM)、X射线衍射(XRD)、X射线能谱仪(EDS)和光致发光光谱仪(PL)对样品的结构、形貌和元素含量进行了表征。并且研究了Ag负载ZnO复合材料对革兰氏阴性菌(大肠杆菌)和革兰氏阳性菌(金黄色葡萄杆菌)的抑制作用。结果表明它对革兰氏菌具有抑制作用,而且它对革兰氏阳性菌的抑菌效果比革兰氏阴性菌好。当Ag负载ZnO复合材料中Ag元素达到23.51(wt)%时,其对大肠杆菌抑菌率接近100%;当Ag负载ZnO复合材料中Ag含量为11.62(wt)%时,其对金黄色葡萄杆菌的抑菌率可达100%。研究还表明Ag负载ZnO复合材料的抑菌原因是能释放Ag+。
参考文献
[1]Marambio-Jones C, Hoek E.M.V. A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment[J]. Journal of Nanoparticle Research, 2010, 12(5): 1531-1551.
[2]Jiming B, Zimmler M.A, Capasso F, et al. Broadband ZnO single-nanowire light-emitting diode[J]. Nano Letters, 2006, 6(8): 1719-1722.
[3]Bai X.D, Gao P.X, Wang Z.L, et al. Dual-mode mechanical resonanceofindividual ZnOnanobelts[J].Applied Physics Letters,2003, 82(26): 4806-4808.
[4]Lin H.F, Liao S.C, Hung S.W. The dc thermal plasma synthesis of ZnO nanoparticles for visible-light photocatalyst[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2005, 174(1): 82-87.
[5]Sun J, Dong S, Wang Y, et al. Preparation and photocatalytic propertyofa novel dumbbell-shaped ZnOmicrocrystal photocatalyst[J]. Journal of Hazardous Materials, 2009, 172(2-3): 1520-1526.
[6]Xie Y, He Y, Irwin P.L, et al. Antibacterial activity and mechanism of action of zinc oxide nanoparticles against campylobacter jejuni [J]. Applied and Environmental Microbiology, 2011, 77(7): 2325-2331.
[7]Jones N, Ray B, Ranjit K.T, et al. Antibacterial activity of ZnO nanoparticle suspensions on a broad spectrum of microorganisms [J]. FEMSMicrobiology Letters, 2008, 279(1): 71-76.
[8]Motshekga S.C, Ray S.S, Onyango M.S, et al. Microwave-assisted synthesis, characterization and antibacterial activity of Ag/ZnO nanoparticles supported bentonite clay[J]. Journal of Hazardous Materials, 2013, 262(10): 439-446.
[9]Amornpitoksuk P, Suwanboon S, Sangkanu S, et al. Synthesis, characterization, photocatalytic and antibacterial activities of Ag-doped ZnO powders modified with a diblock copolymer[J]. Powder Technology, 2012, 219(4): 158-164.
[10]Fei L, Yuliang Y, Junyang L, et al. Synthesis and characterization of ZnO-Ag core-shell nanocomposites with uniform thin silver layers[J]. Applied Surface Science, 2010, 256(20): 6076-6082.
[11]Guo X.H, Ma J.Q, Ge H.G. Preparation, characterization, and photocatalytic performance ofpear-shaped ZnO/Agcore-shell submicrospheres[J].Journalofthe Physicsand ChemistryofSolids, 2013, 74(5): 784-788.
[12]Jiang T, Song Y, Wei T, et al. Sensitive detection of Escherichia coli O157:H7 using Pt-Au bimetal nanoparticles with peroxidase-like amplification[J]. Biosensors and Bioelectronics, 2016, 77: 687-694.
[13]Yu J.P, Zhang Y, Zhang Y, et al. Sensitive and rapid detection of staphylococcus aureus in milk via cell binding domain of lysin[J]. Biosensors and Bioelectronics, 2016, 77: 366-371.
[14]Raffaello A, Rizzuto R. Mitochondrial longevity pathways[J]. Biochimica et Biophysica Acta(BBA)-Molecular Cell Research, 2011, 1813(1): 260-268.
分析测试
Preparation of silver loaded zinc oxide composites and its antibacterial properties
ZHANG Jiang-taoa,TANG Jiao-ninga,ZHU Guang-minga,CAO Guang-zhongb,WU Hai-lina,CHEN Huan-wenc,GONG Xiao-zhongc
(a.College of Materials Science and Engineering, Shenzhen Key Laboratory of Special Functional Material; b.College of Mechatronics and Control Engineering, Shenzhen Key Laboratory of Electromagnetic Control; c.School of Chemistry and Environmental Engineering, Shenzhen University, Shenzhen 518060, China)
Abstract:Using zinc oxide nanoparticles as the core, silver nitrate as the source of silver and formaldehyde as reducing agent, silver loaded zinc oxide composites were prepared by a simple method of three-step process. The microstructure and antibacterial properties of the composite were studied by means of Scanning electron microscopy(SEM), X-ray line energy dispersive spectroscopy(EDS), X-ray diffraction(XRD), Photoluminescence (PL), Confocal laser scanning microscope(CLSM), Antibacterial ring method, Antibiotic contrast experiment and Bacteria turbidimetry method. The results showed that the phase of zinc oxide crystal in the composite material has not changed, and silver uniformly loaded on the surface of zinc oxide. Moreover, it was found that the load degree of silver can be adjusted by changing the concentration of silver-TEA solution. The prepared composites have excellent antibacterial properties against Gram bacteria and the antibacterial activity increased with the load degree of silver.
Key words:silver loaded;zinc oxide;three-step method;gram bacteria;antibacterial activity
中图分类号:TB34
文献标识码:A
DOI:10.16247/j.cnki.23-1171/tq. 20160501
收稿日期:2016-01-11
基金项目:国家高技术研究发展计划863项目(2012AA030312);深圳电磁控制重点实验室开放基金(EMCKF201405);深圳市龙岗区产学研合作项目(CXY2012006)
作者简介:张江涛(1991-),男,在读硕士研究生,主要研究领域:纳米抗菌材料和自修复微胶囊。
通讯作者:龚晓钟,广东省深圳市南山区粤海街道深圳大学材料学院。

