过表达VHA-c3基因拟南芥对黑暗、ABA与糖的响应
苏杰郭荣起李国婧王瑞刚
(1. 内蒙古农业大学职业技术学院,土右旗 014109;2. 内蒙古农业大学生命科学学院,呼和浩特 010018;3. 内蒙古呼伦贝尔市农业科学研究所,牙克石 162650)
过表达VHA-c3基因拟南芥对黑暗、ABA与糖的响应
苏杰1,2郭荣起2,3李国婧2王瑞刚2
(1. 内蒙古农业大学职业技术学院,土右旗 014109;2. 内蒙古农业大学生命科学学院,呼和浩特 010018;3. 内蒙古呼伦贝尔市农业科学研究所,牙克石 162650)
为研究液泡H+-ATPase c亚基基因(VHA-c3)在植物生长发育及非生物胁迫应答过程中的作用,构建了VHA-c3过表达载体转化拟南芥,获得过表达VHA-c3的转基因纯合体植株,采用半定量RT-PCR技术分析了转基因拟南芥中VHA-c3的表达量,然后对转基因拟南芥进行暗培养、ABA和糖处理。结果获得6个T2代株系转基因纯合体株系,其mRNA表达量均高于对照;黑暗条件下,5个VHA-c3转基因株系的根长变短;在正常光照下,3个转基因株系主根伸长和子叶的展开以及5个转基因株系的种子萌发对ABA的抑制不敏感;分别有5个和6个转基因株系的种子萌发对葡萄糖和蔗糖的抑制不敏感。推测VHA-c3可能影响根细胞的扩展,并可能参与ABA和糖介导的信号转导途径。
拟南芥;VHA-c3;黑暗;ABA;糖
液泡H+-ATPase(V-ATPase)分布于液泡膜、高尔基体、内涵体、质膜等真核细胞分泌系统膜上,是一种转运质子的酶[1,2]。它们在植物细胞的生长、离子平衡及逆境胁迫(如干旱、盐和重金属等)应答方面起重要作用[3]。V-ATPase是一种寡聚酶,由13个亚基组成,有V1和V0两个结构域。V1域位于胞质中,由8个亚基(A、B、C、D、E、F、G和H)构成,为催化区域,参与ATP的水解;V0域与膜结合,由亚基a、c、c'、c''、d和e组成,为质子传导区域[4]。其中,V-ATPase c(VHA-c)亚基以六聚体形式形成环形结构,是膜V0域的主要组件,且对V1域与膜的组装起重要作用,是质子转运的通道[5]。研究表明,c亚基与植物生长[6]和抗非生物胁迫[7-9]有关。
模式植物拟南芥(Arabidopsis thaliana)VHA-c亚基由5个同源基因,即VHA-c1、VHA-c2、VHA-c3、VHA-c4和VHA-c5编码[10]。有关拟南芥VHA-c基因的研究已有很多报道。其中对于VHA-c3基因的研究显示,VHA-c3的表达具有组织特异性且与植物响应非生物胁迫有关。Padmanaban 等[11]研究发现拟南芥VHA-c3基因在根尖中呈优势表达。徐萍等[12]揭示VHA-c3 基因在拟南芥的果荚、花、叶、茎和根中都有表达,但在叶中的表达量远远高于其它的组织,同时发现在VHA-c3基因起始密码子上游2 812-2 234 bp之间的区域内存在着控制该基因高表达的转录调控元件。郭荣启等[13]同样利用GUS报告基因,研究了VHA-c3基因的植物组织及器官定位发现3个不同长度VHA-c3基因上游存在着控制基因在气孔表达的转录调控元件。在逆境及非生物胁迫响应方面,Padmanaban等[11]利用dsRNAi发现VHA-c3对盐胁迫敏感。徐萍等[14]的研究揭示拟南芥VHA-c3参与了抗盐和ABA胁迫反应。邸娜等[15]发现拟南芥VHA-c3基因对外源激素(如IAA、ABA和ACC)以及盐胁迫和渗透胁迫有响应。于秀敏等[16]揭示4℃低温和光照促进VHA-c3表达。另外,在矿质营养调节方面,Ca2+和MS营养成分促进拟南芥VHA-c3的表达[17]。
基于以上对VHA-c3基因的研究,本实验构建该基因的过表达载体,转化野生型拟南芥,采用半定量RT-PCR技术分析转基因拟南芥中VHA-c3的表达量;同时,对转基因纯合体进行暗培养、ABA处理和糖处理并观察其表型,旨为研究VHA-c基因在植物生长发育及非生物胁迫应答的功能提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 野生型Columbia生态型拟南芥,由内蒙古农业大学植物分子生物学实验室提供。
1.1.2 菌株和质粒 根癌农杆菌GV3101、大肠杆菌DH5α和pCHF3载体由内蒙古农业大学植物分子生物学实验室保藏。
1.1.3 主要试剂 Taq酶、DNA marker和反转录试剂盒等购自大连宝生物公司,各种限制性内切酶、T4 DNA连接酶购自NEB公司,抗生素购自BBI公司,RNaseA、pGM-T、DNA回收试剂盒和质粒小提试剂盒购自北京天根公司,引物合成和测序工作由上海生工公司完成。
1.2 方法
1.2.1 基因克隆及过表达载体构建 拟南芥基因组DNA提取采用CTAB法[18]。VHA-c3基因克隆采用PCR法,PCR引物P1为:5'-GGTACCAGAATCGCCTGAGAGATG-3'(Kpn I)和P2为:5'-GGATCCTGACAAACAATATAAGAAGATC-3'(BamH I)。PCR扩增条件为:95℃预变性1 min;95℃变性10 s,58℃退火30 s,72℃延伸2 min,共30个循环;72℃延伸6 min。
农杆菌转化采用电击法[19],过表达质粒载体pCHF3-c3转化到的农杆菌GV3101细胞中,取50 μL转化产物涂于LB固体培养基(含25 μg/mL Gent和100 μg/mL Spect)上,28℃培养36 h,筛选阳性转化子并进行菌落PCR和双酶切鉴定,验证正确后得到重组菌GV3101/pCHF3-c3。
1.2.2 拟南芥转化及转基因纯合体的获得 将经验证正确后得到的重组菌GV3101/pCHF3-c3于LB固体培养基(同上)平板上划线,28℃培养48 h。挑取5-6个单克隆于5 mL的LB液体培养基(含25 μg/mL Gent和100 μg/mL Spect)中培养,28℃震荡培养过夜。次日,取1 mL过夜培养的菌液重新接种于100 mL LB液体培养基(同上)中,28℃震荡培养至OD600为1.2-1.6。将菌液于4 000 r/min,离心15 min,收集菌体,将菌体用LB液体培养基重悬浮,所得悬浮液OD600为0.8,用于拟南芥的转化。
采用浸花法[20]转化野生型拟南芥,利用30 μg/mL的Kan对转基因植株T2代进行筛选,鉴定出纯系用于本研究的各项分析。
1.2.3 半定量RT-PCR检测基因表达量 提取野生型和VHA-c3过表达转基因纯系拟南芥的总RNA,反转录得到cDNA。再分别以野生型和过表达转基因纯合体的cDNA为模板,对actin(At3g12110)和VHA-c3基因进行PCR扩增。actin引物为P3:5'-ATGGCAGATGGTGAAGACATTCAG-3'和P4:5'-GAAGCACTTCCTGTGGACTATTGA-3',VHA-c3引物为P5:5'-CATATTTTAAGATCCAGAATCGCCTGAGAG-3' 和P6:5'-TTCGGCTCTGGACTGACCAGCTCGGGAGGA-3'。PCR反应条件为:94℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸90 s,25个循环;72℃延伸5 min[11]。将PCR产物于1.5%琼脂糖凝胶电泳,凝胶成像分析(Syngene公司凝胶成像仪)。
1.2.4 转基因植株暗培养 VHA-c3转基因纯合体和野生型拟南芥种子同时种在1/2MS培养基上,暗培养5 d后统计根长。
1.2.5 转基因植株ABA处理 (1)VHA-c3转基因纯合体和野生型拟南芥种子同时种在1/2MS培养基中,4℃春化3 d,再于22℃、16 h光照/8 h黑暗条件下培养,48 h后转移至含不同浓度ABA(0、4、8和12 μmol/L)的1/8MS培养基上,16 h光照/8 h黑暗培养4 d,统计主根长度。(2)VHA-c3转基因纯合体和野生型拟南芥种子同时种在含有不同浓度ABA(0、0.5、1和2 μmol/L)的1/2MS培养基中,4℃春化3 d后于22℃、16 h光照/8 h黑暗条件下培养2 d,统计萌发率。
1.2.6 转基因植株糖处理 VHA-c3转基因纯合体和野生型种子同时分别种在含葡萄糖或蔗糖(浓度均为0%、4%、5%和6%)的1/2MS培养基中,4℃春化3 d后于22℃、16 h光照/8 h黑暗条件下培养3 d,统计其萌发率。
2 结果
2.1 VHA-c3基因的克隆及过表达载体pCHF3-c3的构建
以拟南芥基因组DNA为模板,以P1、P2为模板进行PCR扩增,获得大小为1 636 bp基因片段VHA-c3,PCR产物与pGM-T载体连接后测序。验证目的片段正确后,将阳性质粒pGM-T-c3和表达载体pCHF3用KpnⅠ和BamHⅠ双酶切,胶回收VHA-c3基因和pCHF3载体,连接后转化E.coli DH5α,提取阳性转化子的质粒,进行KpnⅠ和BamHⅠ的双酶切验证,证明重组表达载体pCHF3-c3构建成功。用电击法将重组质粒pCHF3-c3转化农杆菌GV3101,挑选培养在含Spect和Gent的LB固体培养基上的单克隆,进行菌落PCR检测呈阳性,证明重组质粒pCHF3-c3已经转入农杆菌GV3101中。
2.2 VHA-c3转基因植株的筛选
重组质粒pCHF3-c3经农杆菌介导转入野生型拟南芥。筛选后获得30个T1代转基因株系,进一步筛选获得6个T2代转基因纯合体株系,分别是:c3-8-3、c3-11-1、c3-12-5、c3-16-8、c3-21-1和 c3-22-6。
2.3 VHA-c3转基因纯合体半定量RT-PCR鉴定
以野生型为对照,采用半定量RT-PCR对VHA-c3转基因纯合体进行检测(图1)。将WT的VHA-c3的转录水平定为100%,c3-16-8的mRNA表达水平较强(表达量为181%);c3-8-3、c3-11-1和c3-12-5的mRNA表达水平居中(表达量分别为159%、141% 和 163%);c3-21-1和 c3-22-6的 mRNA表达水平较弱(表达量分别为103%和106%)。
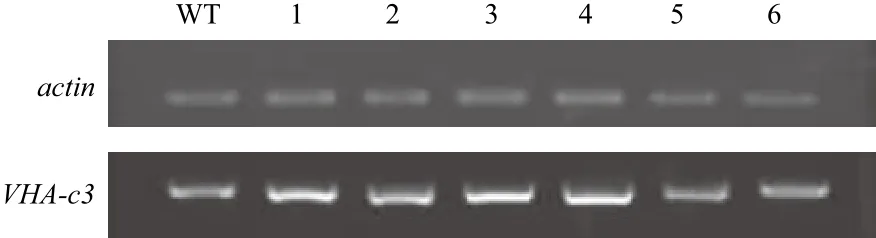
图1 过表达转基因纯合体VHA-c3基因的mRNA表达水平
2.4 VHA-c3转基因纯合体暗培养后根的变化
在正常光照培养下,VHA-c3过表达纯合体与野生型拟南芥差异不明显。将转基因纯合体暗培养5 d后测量根长,结果(图2,图3)显示,有5个株系的平均根长比对照分别短11%、31%、9%、21%和15%。表明在黑暗条件下,VHA-c3基因过量表达抑制了根的生长。
2.5 ABA处理下VHA-c3转基因纯合体的变化
2.5.1 VHA-c3转基因纯合体主根伸长和子叶的变化 经ABA处理后,有3个VHA-c3转基因纯合体株系的主根相对伸长量比对照增加。ABA浓度越高,转基因纯合体和野生型主根生长被抑制的程度及子叶的黄化程度越大,且VHA-c3转基因株系子叶的展开程度要高于对照(图4,以c3-12-5为例)。在4 μmol/L ABA浓度下,3个株系主根的相对伸长量平均比对照分别增加3%、1%和16%;在8 μmol/L ABA浓度下,分别增加1%、6%和16%;在12 μmol/L ABA浓度下,分别增加6%、1%和10%(图5)。
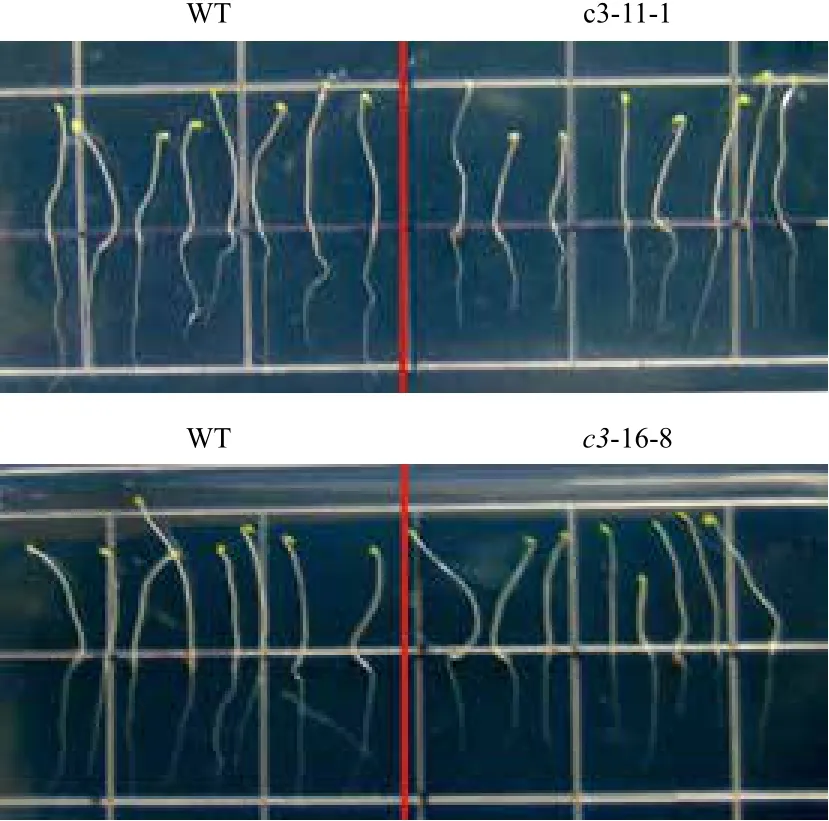
图2 VHA-c3转基因纯合体在暗培养下根长变短
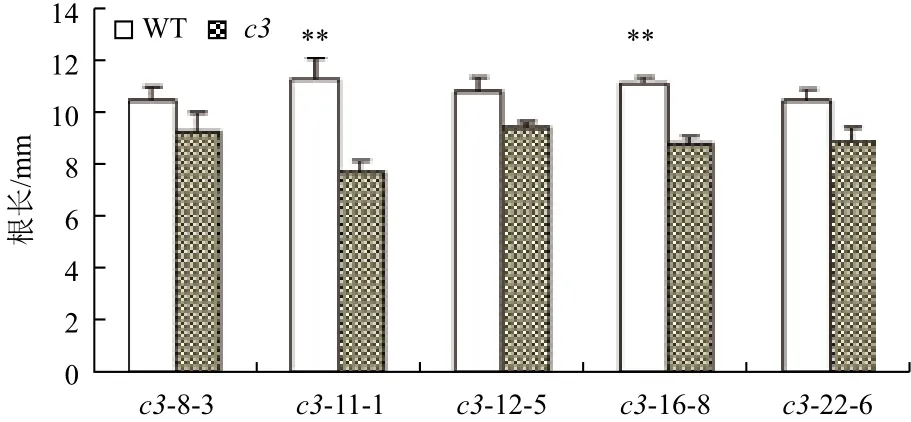
图3 暗培养条件下VHA-c3转基因纯合体根伸长变短
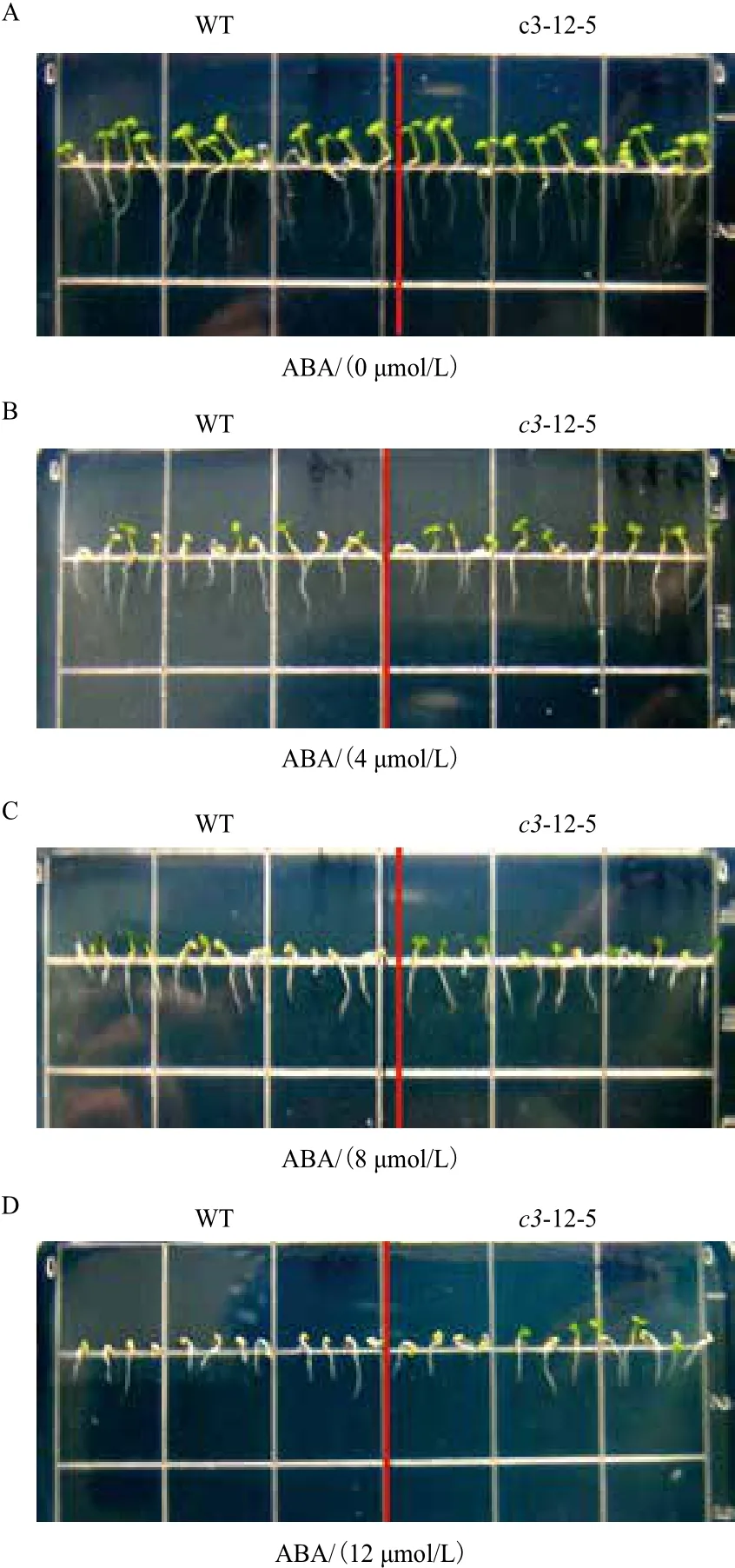
图4 不同浓度ABA处理下的转基因系c3-12-5
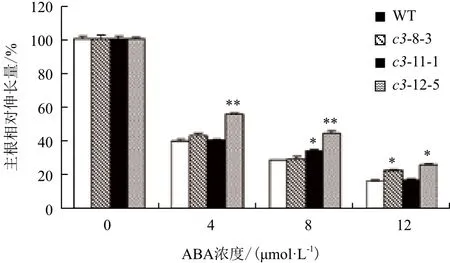
图5 ABA处理下VHA-c3转基因纯合体主根相对伸长量
2.5.2 VHA-c3转基因纯合体种子萌发率的变化 当用浓度大于2 μmol/L的ABA处理VHA-c3转基因纯合体时,几乎所有种子的萌发全部被抑制;当ABA浓度介于0-2 μmol/L时,有5个过表达纯系和野生型种子的萌发受到抑制,且当ABA浓度增大时,种子萌发率均下降。在不同浓度ABA抑制下,这5个转基因纯系的萌发率均大于对照:在0.5 μmol/L ABA下,5个株系的萌发率比对照增加32%、15%、25%、2% 和9%;在1 μmol/L ABA下,萌发率增加量分别为98%、80%、60%、30%和68%;在2 μmol/L ABA浓度下,增加量分别为106%、79%、73%、30%和58%(图6)。
以上结果表明,VHA-c3基因的过表达使根、子叶和种子对ABA变得不敏感。
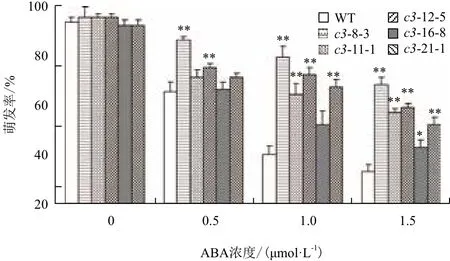
图6 ABA处理下VHA-c3过表达纯合体种子的萌发率
2.6 不同浓度糖处理下VHA-c3转基因纯合体种子萌发率的变化
浓度小于4%的Glc或Suc对VHA-c3过表达转基因纯合体和野生型种子的萌发影响较小;当浓度大于6%时,种子几乎不萌发。在浓度介于4%-6% Glc和Suc处理下,分别有5个和6个株系的种子萌发率高于WT(图7-A,7-B),具体表现为:
在Glc处理下,浓度为4%时,这5个株系的种子萌发率平均分别比WT增加6%、10%、6%、11%和13%;浓度为5%时,平均增加15%、27%、22%、25%和29%;浓度为6%时,平均增加2%、6%、37%、45%和55%。
在Suc处理下,浓度为4%时,6个株系的种子萌发率平均分别比WT增加10%、15%、2%、9%、7%和10%;浓度为5%时,平均增加12%、19%、11%、5%、9%和13%;浓度为6%时,平均增加13%、3%、11%、17%、14%和14%。
这说明VHA-c3基因的过表达使种子对糖的敏感度降低。
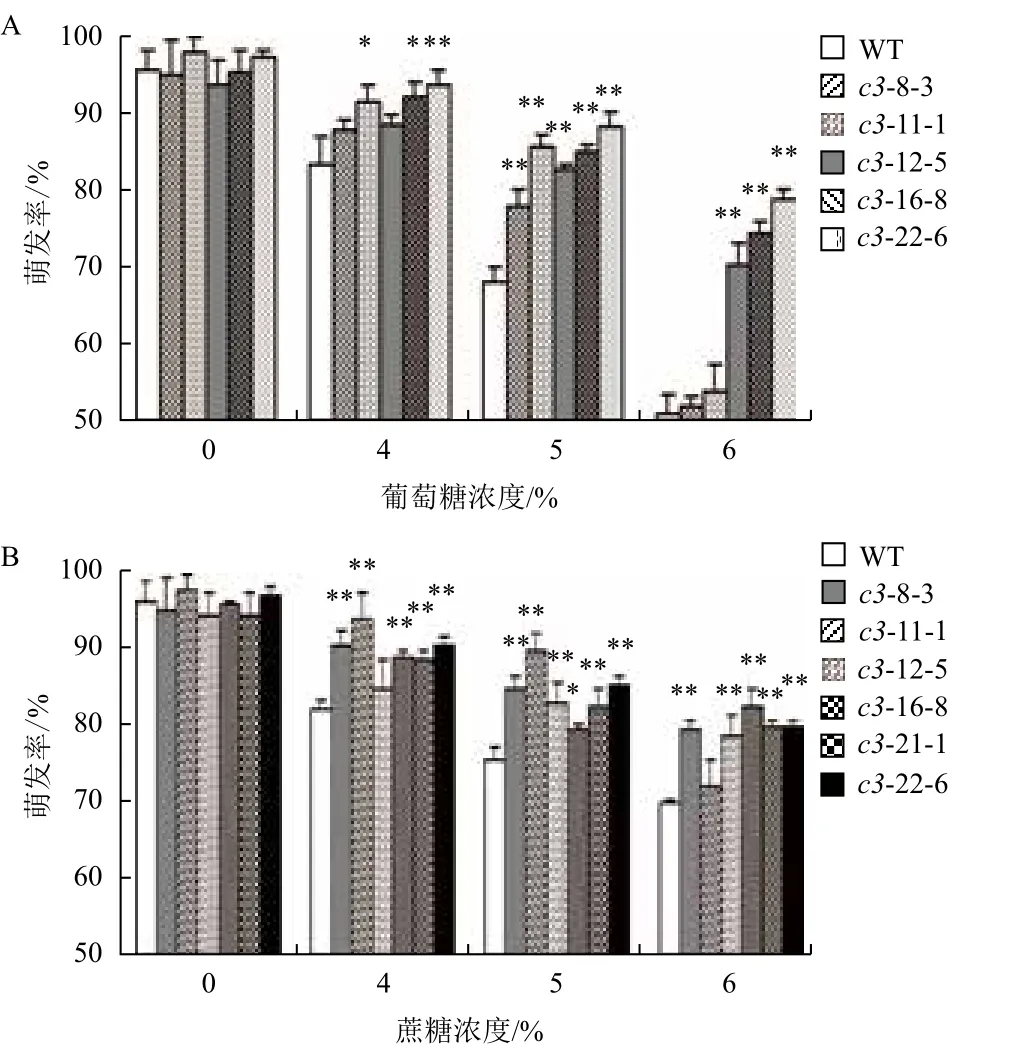
图7 不同浓度葡萄糖(A)和蔗糖(B)处理下VHA-c3转基因纯合体株系种子萌发率
3 讨论
3.1 VHA-c3可能对根细胞扩展起作用
人们对V-ATPase亚基在细胞扩展方面的研究发现,A亚基和E亚基的转录水平分别在棉花纤维细胞[21]的伸长过程或在扩展的大麦叶子[22]中增加;C亚基表达量的减少导致拟南芥突变株det3发育不良,可能机制是V-ATPase活性受不同植物激素的调控,原因在于C亚基对油菜素内酯诱导的细胞扩展是必不可少的[23];对转基因胡萝卜的分析表明,通过抑制A亚基的表达,其叶子细胞变小[24]。Padmanaban等[11]研究发现VHA-c1对细胞扩展起重要作用,原因在于VHA-c1启动子在根的伸长区及其它不断增大的组织中的活性很高,同时通过dsRNA干扰介导的突变株VHA-c1在暗培养下根和下胚轴长度变短。Zhou等[6]研究过表达星星草VHA-c转基因拟南芥时发现在正常条件和盐胁迫下转基因植株的根长、鲜重、高度和荚子数量均大于野生型,经检测V-ATPase的活性增大,解释VHA-c在植物生长方面发挥重要作用的机制是c亚基影响了V-ATPase依赖的内涵体的运输。
本研究中多数VHA-c3过表达纯合体在暗培养下根变短,且在ABA处理下根的相对伸长增加,这些结果也揭示VHA-c3对根细胞扩展的可能作用。推测可能是因为VHA-c3基因的上游调控区存在光敏感元件(如ACE、AE-box、GAG、GATA、TCCC-motif、TCT-motif等)和激素响应元件(如ABRE、AuxRR-core、TGA-box、TCA-element、TGACG-motif、TATC-box、P-box、GA-motif等),黑暗信号和外源ABA的刺激可能直接或间接调控了转基因植株VHA-c3的表达,从而影响c亚基的表达量,使根细胞的V-ATPase活性改变,影响了V-ATPase依赖的内涵体的运输,最终影响根细胞的扩展。当然这一机制还需要进一步的细胞学实验验证。
3.2 VHA-c3可能参与ABA和糖介导的信号转导途径
ABA是一种参与种子休眠、芽休眠、叶及根的伸展及叶片脱落等生理活动的植物激素。研究表明,许多植物在响应ABA过程中V-ATPase活性及H+转运活性增加[25],而且已有报道称ABA可以诱导V-ATPase c亚基[7,12]。本研究50%的转基因纯系主根伸长和子叶的展开以及80%的转基因纯系的种子萌发对ABA的抑制不敏感,推测VHA-c3的过表达影响了V-ATPase活性和H+转运活性,进而影响了拟南芥的种子萌发及子叶和根的生长。
另外,很多植物响应ABA的生理过程与糖有关。有人研究了拟南芥的RGS(The regulator of G-protein signaling)蛋白,对AtRGS1过表达纯合体种子在萌发阶段分别进行ABA和葡萄糖处理,发现过表达纯合体种子的萌发率都较野生型高,说明它对二者均不敏感[26]。类似地,Chen等[27]发现在种子萌发和幼苗生长方面,对ABA不敏感的突变体hy5对糖的抑制同样是不敏感的。原因是外源ABA对种子萌发的抑制致使种子营养缺乏,而糖通过提供能量和营养克服了ABA对种子萌发的抑制,从而缓解代谢的抑制作用[26,27]。本研究发现VHA-c3过表达纯系对ABA不敏感后,对其种子进行了葡萄糖和蔗糖处理,得到了类似的结果,即80%以上的过表达纯系的种子萌发对糖不敏感。综合本实验ABA、葡萄糖和蔗糖处理的结果,VHA-c3转基因植株对以上3种处理均不敏感,这说明VHA-c3可能参与了ABA和糖介导的信号转导途径,至于其具体机制还有待于进一步的实验验证。
综上所述,本研究利用过表达对拟南芥VHA-c3基因进行了研究,对过表达纯合体进行了黑暗、ABA、葡萄糖和蔗糖处理,它们的表型与野生型存在差异。这将为探讨VHA-c3基因乃至V-ATPase在植物发育、细胞信号转导及抗非生物胁迫的功能方面提供线索。
4 结论
通过构建VHA-c3过表达载体并转化野生型拟南芥,获得了过表达VHA-c3的转基因纯合体。采用半定量RT-PCR技术分析了转基因拟南芥中VHA-c3的表达量,验证了其mRNA的高表达水平。对转基因拟南芥进行暗培养、ABA和糖处理,结果显示,黑暗条件下,83%的VHA-c3转基因株系的根长变短;在正常光照下,半数以上的转基因株系在主根伸长、子叶的展开以及种子萌发方面对ABA的抑制不敏感;83%以上的转基因株系在种子萌发方面对糖(葡萄糖和蔗糖)的抑制不敏感。推测VHA-c3可能影响根细胞的扩展,并可能参与ABA和糖介导的信号转导途径。
[1]Sze H, Li X, Palmgren M. Energization of the plant cell membranes by H+-pumping ATPases:biosynthesis and regulation[J]. The Plant Cell, 1999, 11:677-689.
[2]Dietz KJ, Tavakoli N, Kluge C, et al. Significance of the V-type ATPase for the adaptation to stressful growth conditions and its regulation on the molecular and biochemical level[J]. Journal of Experimental Botany, 2001, 52:1969-1980.
[3]Schumacher K, Krebs M. The V-ATPase:small cargo, large effects[J]. Current Opinion in Plant Biology, 2010, 13(6):724-730.
[4]Arata Y, Baleja JD, Forgac M. Cysteine-directed cross-linking to subunit B suggests that subunit E forms part of the peripheral stalk of the vacuolar H+-ATPase[J]. The Journal of Biological Chemistry, 2002, 77:3357-3363.
[5]Hirata T, Iwamoto-kihara A, Sun-wada GH, et al. Subunit rotation of vacuolar-type proton pumping ATPase:relative rotation of the G as to c subunit[J]. The Journal of Biological Chemistry, 2003, 278:23714-23719.
[6]Zhou A, Bu Y, Takano T, et al. Conserved V-ATPase c subunit plays a role in plant growth by influencing V-ATPase-dependentendosomal trafficking[J]. Plant Biotechnology Journal, 2016, 14(1):271-283.
[7] Tsiantis MS, Bartholomew DM, Smith JAC. Salt regulation of transcript levels for the c subunit of a leaf vacuolar H+-ATPase in the halophyte Mesembryanthemum crystallinum[J]. The Plant Journal for Cell and Molecular Biology, 1996, 9:729-736.
[8]Baisakh N, Ramanarao MV, Rajasekaran K, et al. Enhanced salt stress tolerance of rice plants expressing a vacuolar H+-ATPase subunit c1(SaVHAc1)gene from the halophyte grass Spartina alterniflora Löisel[J]. Plant Biotechnology Journal, 2012, 10(4):453-464.
[9]Feng L, Ding H, Wang J, et al. Molecular cloning and expression analysis of RrNHX1 and RrVHA-c genes related to salt tolerance in wild Rosa rugosa[J]. Saudi Journal of Biological Sciences, 2015, 22(4):417-423.
[10]Sze H, Schumacher K, Muller ML, et al. A simple nomenclature for a complex proton pump:VHA genes encode the vacuolar H+-ATPase[J]. Trends in Plant Science, 2002, 7:157-161.
[11]Padmanaban S, Lin X, Perera I, et al. Differential expression of vacuolar H+-ATPase subunit c genes in tissues active in membrane trafficking and their roles in plant growth as revealed by RNAi[J]. Plant Physiology, 2004, 134(4):1514-1526.
[12]徐萍, 李小方, 曾卫军, 等. 拟南芥VHA-c3基因的特异性表达和调节[J]. 华东师范大学学报:自然科学版, 2006, 2:98-104.
[13]郭荣起, 苏杰, 王福慧, 等. 拟南芥VHA-c3启动子的GUS基因融合表达[J]. 中国生物工程杂志, 2008, 28(7):58-62.
[14]徐萍, 刘瑞香, 曾卫军, 等. 拟南VHA-c基因在非生物胁迫响应中的作用[J]. 华北农学报, 2006, 21(1):19-22.
[15]邸娜.拟南芥液泡H+-ATPase c亚基基因功能的研究[D].呼和浩特:内蒙古农业大学, 2006.
[16]于秀敏, 武燕, 王瑞刚. 温度和光照对拟南芥VHA-c基因启动子活性的调节[J]. 河南师范大学学报:自然科学版, 2013, 41(4):120-123.
[17]张春霖, 尚世辉, 王瑞刚.拟南芥VHA-c基因的矿质营养调节[J]. 河南科技大学学报:自然科学版, 2014, 35(5):79-81.
[18]Murray MG, Thompson WF. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research, 1980, 8(19):4321-4325.
[19]Mersereau M, Pazour GJ, Das A. Efficient transformation of Agrobacterium tumefaciens by electroporation[J]. Gene, 1990, 90(1):149-151.
[20]Clough SJ, Bent AF. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. The Plant Journal:for Cell and Molecular Biology, 1998, 16(6):735-743.
[21]Smart LB, Vojdani F, Maeshima M, et al. Genes involved in osmoregulation during turgor-driven cell expansion of developing cotton fibers are differentially regulated[J]. Plant Physiology, 1998, 116:1539-1549.
[22]Dietz KJ, Rudloff S, Ageorges A, et al. Subunit E of the vacuolar H+-ATPase of Hordeum vulgare L.:cDNA cloning, expression and immunological analysis[J]. The Plant Journal:for Cell and Molecular Biology, 1995, 8:521-529.
[23]Schumacher K, Vafeados D, Mccarthy M, et al. The Arabidopsis det3 mutant reveals a central role for the vacuolar H+-ATPase in plant growth and development[J]. Genes&Development, 1999, 13:3259-3270.
[24]Gogarten JP, Fichmann J, Braun Y, et al. The use of antisense mRNA to inhibit the tonoplast H+-ATPase in carrot[J]. Plant Cell, 1992, 4:851-864.
[25]Barkla BJ, Vera-estrella R, Maldonado-gama M, et al. Abscisic acid induction of vacuolar H+-ATPase activity in Mesembryanthemum crystallinum is developmentally regulated[J]. Plant Physiology, 1999, 120(3):811-820.
[26]Chen Y, Ji F, Xie H, et al. The regulator of G-protein signaling proteins involved in sugar and abscisic acid signaling in Arabidopsis seed germination[J]. Plant Physiology, 2006, 140(1):302-310.
[27]Chen H, Zhang J, Neff MM. Integration of light and abscisic acid signaling during seed germination and early seedling development[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(11):4495-4500.
(责任编辑 狄艳红)
Responses of Overexpressed Arabidopsis VHA-c3 to Dark,ABA and Sugar
SU Jie1,2GUO Rong-qi2,3LI Guo-jing2WANG Rui-gang2
(1. School of Vocational and Technical,Inner Mongolia Agricultural University,Tuyouqi 014109;2. School of Life Sciences,Inner Mongolia Agricultural University,Hohhot 010018;3. Agricultural Sciences of Hulunbeier in Inner Mongolia,Yakeshi 162650)
For studying the role of vacuole H+-ATPase subunit c gene(VHA-c3)in plant growth and abiotic stress response,an over-expression vector of VHA-c3 was constructed and introduced into wild-type Arabidopsis thaliana. The expression levels of VHA-c3 in the transgenic homozygote’s plants were detected by semi-quantitative RT-PCR,then the transgenic homozygote were treated by dark,ABA and sugar. The results indicated that 6 lines of homozygous T2 transgenic plants were obtained,and their corresponding transcript levels were increased. The root lengths of 5 lines were reduced among the dark-grown seedlings. Among the ABA-treated seedlings,3 lines were insensitive in primary root growth and the extent of cotyledon unfolding,and 5 lines were insensitive in seed germination. When treated by glucose and sucrose,5 lines and 6 lines reduced the sensitivity in seed germination,respectively. These results indicate that VHA-c3 may affect the cell expansion of root,and be involved in the signal transduction pathways mediated by ABA and sugar.
Arabidopsis thaliana;VHA-c3;dark;ABA;sugar
10.13560/j.cnki.biotech.bull.1985.2016.06.013
2015-09-14
国家自然科学基金项目(30460018),内蒙古自治区科技创新团队(201503004)
苏杰,女,硕士,讲师,研究方向:植物生物化学与分子生物学;E-mail:sujie_1546@163.com
王瑞刚,男,博士,教授,研究方向:植物生物化学与分子生物学;E-mail:ruigangwang@126.com

