多功能融合酶基因Linker的优化及表达
王锐丽+刘敏杰+薛业敏

摘要:在融合酶阿拉伯/木糖苷酶-木聚糖酶(Xar-xynA)之间插入不同组成和长度的多肽Linker,避免催化结构域相互之间的干扰,改善融合酶的催化效率。5个含不同长度及Ala/Gly比例连接肽Linker的融合突变体在大肠杆菌重组表达、纯化,并对融合酶的酶学性质、动力学参数和酶解作用进行研究。结果表明,融合酶Xar-L1/L2/L3-xynA和融合酶Xar-xynA有着相似的最适温度和最适pH值。其中融合酶Xar-L1-xynA在65~80 ℃和pH值6.6~8.2有更强的阿拉伯/木糖苷酶热稳定性和pH值稳定性,将融合酶Xar-L1-xynA在65 ℃保温60 min其阿拉伯/木糖苷酶活性有着明显的激活现象。并获得连接Xar和XynA的最优Linker:L1和L4,麦麸和玉米芯木聚糖产物酶解试验的结果表明,融合酶Xar-L1-xynA和Xar-L4-xynA比其他的融合酶有着更高的催化效率。
关键词:多功能性酶;基因融合;木糖苷酶/阿拉伯糖苷酶;木聚糖酶;连接肽
中图分类号: Q786
文献标志码: A
文章编号:1002-1302(2016)04-0031-05
木聚糖是存在于农业废弃物中最丰富的半纤维素,由于木聚糖结构及降解方式的复杂性,彻底降解需要多种水解酶的协同作用。同时使用多种水解酶来降解木聚糖,虽然清洁高效,但工序复杂,成本高。近来Fan Z等[1-3]将有关水解酶融合形成多功能融合酶来作用于水溶性阿拉伯木聚糖,玉米芯等农业废弃物,这方面研究不但提高了利用酶的综合效率,而且简化了工序和降低了成本。
构建的融合酶常因前后结构域的相互干扰而影响各自活性的发挥,于是在2结构域中插入多肽Linker(连接序列)来减弱或消除这种干扰。已发现有不少多肽可作为连接融合酶的2个结构域的Linker,赋予多功能融合酶的空间柔性,增强酶位点识别,保持相临结构域的功能独立(不受干扰)[4]。 Carlsson等在融合酶的2个催化单元间插入多肽Linker(Linker1:GDPLERSDP;Linker2:GDPLEANGIRSDP)使融合酶中的乳糖苷酶和半乳糖脱氢酶的活性提高[5];Lu等在融合酶中插入Linker (GGGGSGGGGS),使融合酶中的葡聚糖酶活性增加326%,木聚糖酶活性增加43%[6]等。
由于热稳定的酶在工业中有着广泛的应用前景,本研究选用疏棉状嗜热丝孢菌Thermomyces lanuginosus DSM 5826木聚糖酶A(XynA)作为重组融合酶的一个酶源。该木聚糖酶优先降解高聚合度的木聚糖链,产物是不同聚合度的低聚木糖,不产生木单糖,这对于生产低聚木糖具有很好的应用价值[7]。另外选择1个具有双重活性的酶即嗜热厌氧乙醇菌Thermoanaerobacter ethanolicus产生的阿拉伯呋喃糖苷酶(Xar)作为融合酶的酶源[8],可以减少融合酶源的个数。
本研究针对半纤维素的结构及其降解复杂的特点,采用不同组分和长度的多肽Linker连接双活性阿拉伯/木糖苷酶(Xar)和木聚糖酶A(XynA)构建多功能半纤维素酶,并对融合酶的酶学性质、动力学参数和酶解作用进行研究,以获得三功能融合酶的催化效率增强的最优linker。使得通过蛋白质工程构建多功能半纤维素酶来促进生物转化成为可能,为酶法降解半纤维素的工业化生产提供有效的技术路线和解决方案。
1 材料与方法
1.1 材料
质粒和菌株:含有嗜热乙醇菌JW200(Thermoanaerobacter ethanolicus JW200)α-阿拉伯糖苷酶/木糖苷酶(Xar)基因和疏棉状嗜热丝孢菌DSM 5826(Thermomyces lanuginosus DSM 5826)木聚糖酶A(XynA)基因的质粒pET-20b-xar和pET-20b-xar-xynA由前期研究构建保存。大肠杆菌(Escherichia coli)DH10B(Promega)用于质粒扩增和分子克隆等过程,E. coli JM109(DE3)(Promega)作为目的基因的表达宿主。
主要试剂:限制性内切酶EcoRⅤ、XbaⅠ、XhoⅠ,Pyrobest聚合酶,T4 DNA连接酶购自TaKaRa公司;燕麦木聚糖(OSX),对硝基苯酚-α-阿拉伯呋喃糖苷(pNPAF)和对硝基苯酚-β-木糖苷(pNPX)购自Sigma公司。
1.2 方法
1.2.1 基因操作 DNA片断的分离、DNA的内切酶水解和连接、基因的电转化等方法均参照文献[9]。琼脂糖电泳胶回收DNA片断和质粒的制备参考QIAGEN公司QIAquick Gel Extraction Kit和QIAprep Spin Plasmid Miniprep Kit试剂盒使用指南进行。
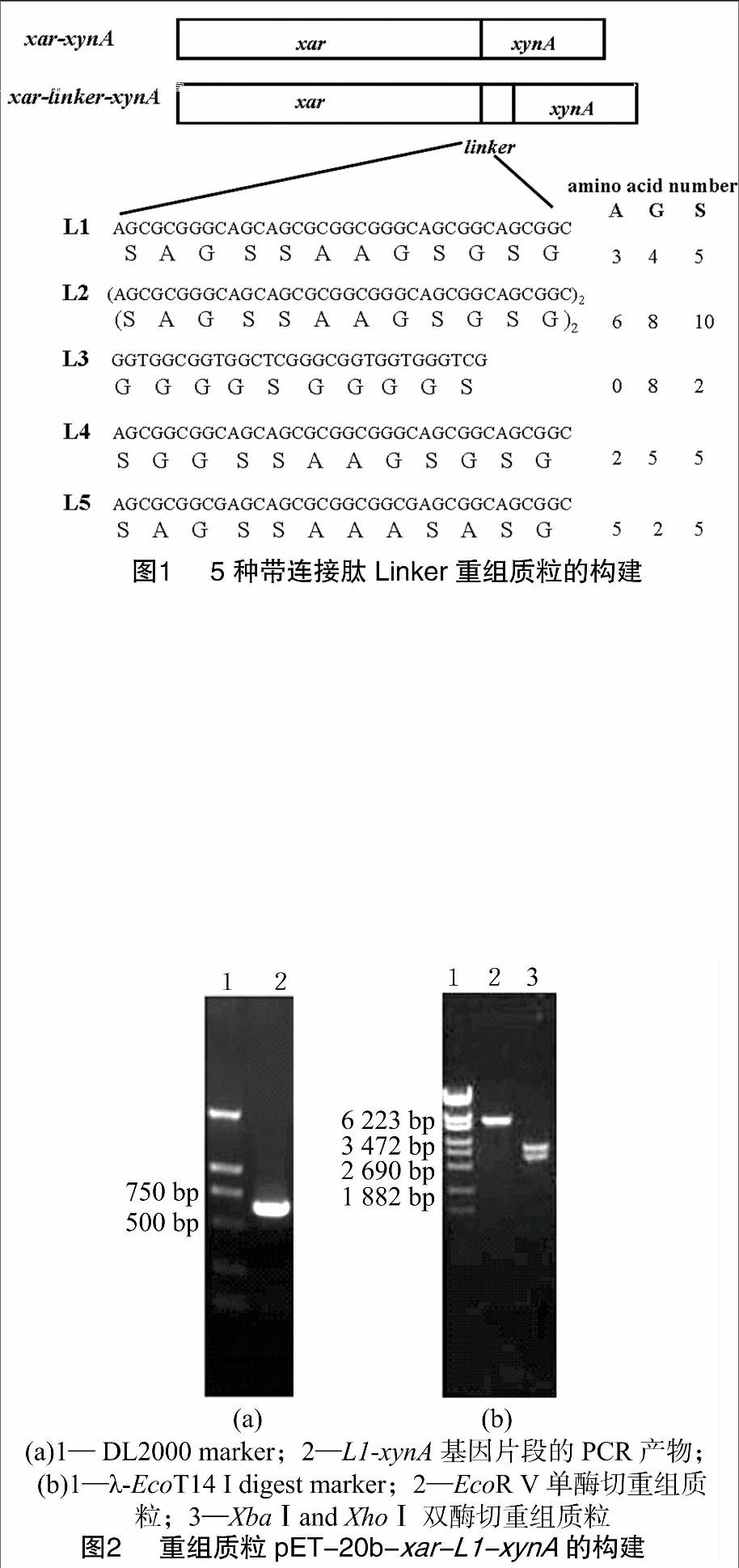
1.2.2 重组质粒pET-20b-xar-linker-xynA的构建 设计长引物将连接肽融入基因间,融合基因中插入的连接肽氨基酸序列及其名称及本研究融合基因涉及的引物序列见表1。将12个氨基酸长度的连接肽L1(SAGSSAAGSGSG)相应的碱基序列设计在长引物S1上,通过PCR将连接肽融入2个基因之间。以质粒pET-20b-xar-xynA为模板,利用相应的上下游引物S1和P4(表1)扩增含连接肽L1的基因xynA。反应体系(50 μL):10 × buffer 5 μL;dNTP(各2.5 mmol/L)4 μL;S1(50 μmol/L)1 μL;P4(50 μmol/L)1 μL;模板(10 μg/mL)1 μL;Probest DNA polymerase(1.25 U/μL) 1 μL;H2O 37 μL。PCR 扩增参数均设为:先在95 ℃ 变性 5 min,加Pyrobest DNA聚合酶1 μL;然后94 ℃ 变性30 s,50 ℃ 退火40 s,72 ℃延伸1 min,循环30次后,72 ℃保温 10 min。将所得PCR片段和载体用T4 DNA连接酶于16 ℃连接过夜,将连接液电转化感受态细胞E. coli DH10B。挑取阳性克隆,提取质粒,用单、双酶切验证。送至上海美吉生物技术公司测序,正确的转化子命名为pET-20b-xar-L1-xynA。
连接肽L2含有24个氨基酸,即(SAGSSAAGSGSG)2。其相应的上下游引物为P1和S2(表1)。构建成功的重组质粒命名为 pET-20b-xar-L2-xynA。
连接肽L3的氨基酸序列为GGGGSGGGGS,同连接肽L1的插入方法一样,参考大肠杆菌氨基酸偏好密码子,将连接肽L3的碱基序列设计在长引物S3上。重组质粒命名为pET-20b-xar-L3-xynA。
在连接肽L1的基础上设计了连接肽L4:SGGSSAAGSGSG和L5:SAGSSAAASASG,在已构建的重组质粒的基础上,设计了引物S4和S5。构建的重组质粒命名为pET-20b-xar-L4/L5-xynA。
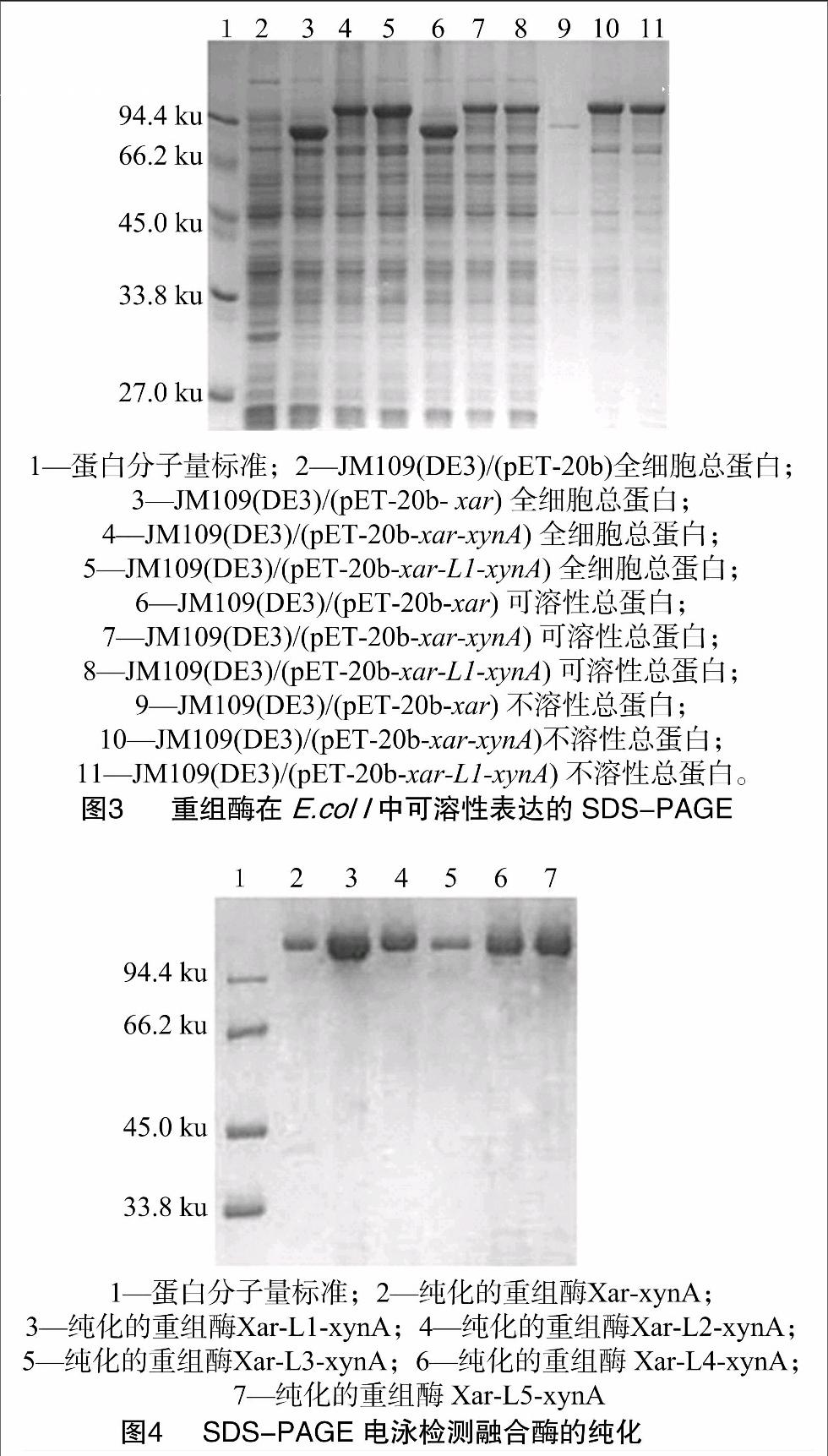
1.2.3 重组酶的可溶性表达和活性检测 将重组质粒pET-20b-xar,pET-20b-xar-xynA和pET-20b-xar-L1-xynA分别电转化于E. coli JM109(DE3),挑取单菌落接入含Amp抗性的LB培养液,进行IPTG诱导培养。待培养结束,检测各样品细胞密度,取菌液1 mL,离心收集菌体。用 100 mmol/L pH值6.2的邻苯二甲酸氢钾-咪唑缓冲液 (PIB) 重悬,调整细胞密度一致。经超声破碎,离心30 min,上清即为粗酶液。分别进行木聚糖酶、阿拉伯糖苷酶和木糖苷酶活性的测定[8,10]。同时进行SDS-PAGE,以检测各种重组质粒在宿主E. coli JM109(DE3)的可溶性表达情况。
1.2.4 重组酶的纯化 将质粒pET-20b-xar-xynA和pET-20b-xar-L1/L2/L3/L4/L5-xynA分别电转化于JM109(DE3),挑取单菌落接种于LB培养基中。将培养好的菌液离心收集细胞,用高压破碎法破碎细胞,离心,接着65 ℃下热处理20 min,最后用Ni2+亲和层析法纯化带连接肽的重组融合酶。
1.2.5 重组酶Xar-L1/L2/L3-xynA的酶学性质
1.2.5.1 最适反应温度的测定 木聚糖酶、木糖苷酶、阿拉伯糖苷酶活性的最适反应温度的测定:酶促反应在50 mmol/L pH值 6.2的PIB缓冲液中进行。在45~95 ℃范围,每隔5 ℃ 分别测定3种酶的活力。以最高酶活力为100%,计算相对活性。
1.2.5.2 最适反应pH值 的测定 木聚糖酶、木糖苷酶和阿拉伯糖苷酶活性分别在65 ℃、90 ℃和80 ℃下测定不同的pH值(4.2~8.2)对酶活力的影响,以最高酶活为100%,计算相对活性。
1.2.5.3 热稳定性的测定 木聚糖酶活性热稳定性测定,是将融合酶分别置于50~80 ℃范围内,每隔5 ℃下保温1 h,然后在65 ℃、pH值 6.2测定残留活力,以保存于冰浴中的酶活力为100%,计算相对活性,找到酶活力半衰期为1 h的温度。木糖苷酶活性热稳定性的测定,是将酶置于65~90 ℃下保温1 h,然后在90 ℃、pH值6.2测定残留活力。阿拉伯糖苷酶活性热稳定性的测定,是将酶置于65~90 ℃下保温1 h,然后在80 ℃、pH值 6.6 测定残留活力。
1.2.5.4 pH值稳定性的测定 将纯酶置于不同pH值(4.2~8.2)的100 mmol/L PIB缓冲液中,在37 ℃下保温 1 h,冷却,然后补加相应的底物和缓冲液达到200 μL。再于最适温度和最适pH值下分别测定残留活力性,以保存于冰浴中的酶活力为100%,作pH值稳定性曲线。
1.2.5.5 动力学参数的测定 用pH值6.2 PIB缓冲液分别配制0.25~2.5 mg/mL的燕麦木聚糖(OSX)和0.02~0.2 mmol/L 的pNPX作为底物,用pH值5.8的缓冲液配制0.1~1.0 mmol/L的pNPAF作为底物,然后分别在最适温度65 ℃、90 ℃、70 ℃测重组融合酶的木聚糖酶、木糖苷酶和阿拉伯糖苷酶的活性。采用Lineweaver-Burk作图法,计算重组融合酶3种活性的Km、Vmax及Kcat/Km值,其中Kcat=最大反应速度/蛋白摩尔数。
1.2.6 融合酶的酶解试验 分别称取玉米芯木聚糖(CX)[11]和去淀粉麦麸(DSWB)[12]200 mg溶于pH值 7.0、250 mmol/L的磷酸缓冲液中,总体系为5 mL。以不加入任何融合酶的酶解体系为试验对照,其他的试验项(1~6)分别加入纯化融合酶Xar-xynA和Xar-L1/L2/L3/L4/L5-xynA。以加入的融合酶Xar-L1-xynA的木聚糖酶酶单位(20 U)为标准,其他试验项加入等摩尔数相对应的融合酶。于65 ℃条件下反应1、4、10、24 h后取样利用DNS法测还原糖浓度。
2 结果与分析
2.1 重组质粒pET-20b-xar-linker-xynA的构建
重组质粒pET-20b-xar-xynA和pET-20b-xar-L1/L2/L3/L4/L5-xynA构建的示意图见图1。
将连接肽L1的碱基序列设计在长引物S1上,通过PCR将连接肽融入2个基因之间。扩增的DNA片段与实际大小一致为600 bp,没有明显的非特异性条带,说明所选PCR扩增条件能有效扩增L1-xynA基因片段(图2-a)。
对于已构建的重组质粒pET-20b-xar-L1-xynA采用XbaⅠ和XhoⅠ双酶切,得到线性的pET-20b质粒和插入的xar-L1-xynA基因片段,大小分别为3.7 kb和2.9 kb,与预计结果的相同(图2-b),测序结果表明该质粒构建成功。
用同样的方法构建和验证其他4种带连接肽的重组质粒pET-20b-xar-L2/L3/L4/L5-xynA。
2.2 融合酶Xar-L1-xynA的可溶性表达

