毛百合试管鳞茎形成和膨大的培养优化
张彦妮+李兆婷+张艳波+汪海洋
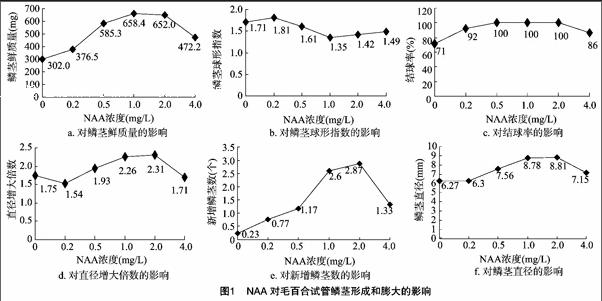
摘要:以毛百合(Lilium dauricum)试管苗为材料,研究不同浓度活性炭、激素种类、水杨酸、蔗糖等对试管鳞茎形成和膨大的影响,同时比较鳞茎大小对移栽成活率的影响。结果表明,NAA、IBA、多效唑对试管鳞茎形成和膨大都有影响,蔗糖对鳞茎膨大有影响;1.0 g/L活性炭对鳞茎的形成及膨大效果最好,所结鳞茎直径增大 2.50 倍,鳞茎球形指数1.40,鳞茎鲜质量828.2 mg,结球率达100%,平均新增鳞茎4.40个;水杨酸对鳞茎膨大效果不明显;鳞茎越大(≥8 mm),移栽成活率越高(96%),长势越好。
关键词:毛百合;试管鳞茎;植物激素;膨大
中图分类号: Q943.1;S682.2+65.04+3
文献标志码: A
文章编号:1002-1302(2016)04-0074-05
毛百合(Lilium dauricum)为百合科(Liliaceae)百合属(Lilium)多年生球根类花卉,产于黑龙江、吉林、辽宁、内蒙古和河北等地,朝鲜、日本、蒙古和俄罗斯也有分布,其花色艳丽、姿态优雅,是一种代表和谐美好、吉祥高贵的观赏花卉[1];同时又是一种名贵的中草药,鳞茎治脓肿、骨折、烧伤及冻伤等,地上部分新鲜时局部应用,可促进外伤愈合,有收敛作用,花可治肺病[2]。毛百合是一种珍贵的野生资源,具有极高的观赏、食用和药用价值,花期6—7月,抗寒性极强[3],是很好的逆境基因资源库。目前,学者对毛百合的种子萌发[4]、繁殖生物学[5]、染色体[6]、核型分析[7]、再生体系的建立[8]、切花保鲜[9]、栽培[10]进行了研究。东北林业大学花卉研究所于1994年利用“940703”科学卫星搭载毛百合的种子后,发现卫星搭载可以提高毛百合种子的萌发率,可使毛百合鳞茎大小及质量产生一定变异[11]。纪莹等利用栽培品种布鲁拉诺与毛百合进行种间杂交后,通过测定杂交后代相关生理生化指标,发现杂交后代抗寒性有所提高[12]。鳞茎作为毛百合繁殖和药用的一个重要部位,如何短时间内使其鳞茎增大、鳞茎增大受到哪些因素的影响仍值得探讨。目前,还未发现添加不同附加物促进毛百合鳞茎膨大的相关研究。一般在组织培养过程中,试管结球时间较长,形成的鳞茎直径较小,制约了其繁殖及生产。因此,有必要寻找能缩短结球时间和促进试管鳞茎增大的方法。本试验以毛百合组培苗为试验材料,探讨活性炭(activated carbon,AC)、α-萘乙酸(NAA)、3-吲哚丁酸(indole butyric acid,IBA)、蔗糖、水杨酸(salicylic acid,SA)、多效唑(PP333)对毛百合试管鳞茎形成和膨大的影响,探索添加不同附加物对试管鳞茎移栽成活率及生长状况的影响,以期找到最适附加物及其浓度,加速鳞茎的生长和发育,为毛百合的育种、离体快繁及园林应用等奠定基础。
1 材料与方法
1.1 材料
以毛百合(Lilium dauricum)的无菌苗为试验材料。
1.2 方法
1.2.1 小鳞茎的获得 将通过增殖培养获得的毛百合不定芽分割成单芽(高约4 mm),转接到MS+0.5 mg/L NAA+0.5 mg/L 6-BA(根据预试验获得的培养基配方)继代培养基上壮苗,直到每个单芽基部小鳞茎直径长至0.3~0.4 cm时,剪去上部叶片接种于培养基上。
1.2.2 鳞茎膨大培养基设计与培养条件 以MS为基础培养基,培养基设计方案分为2种,一种方案为附加0.5 mg/L 6-BA,设置NAA浓度为0、0.2、0.5、1.0、2.0、4.0 mg/L、IBA浓度为0、0.1、0.5、1.0、2.0、4.0 mg/L。另一种方案为附加0.5 mg/L 6-BA、0.5 mg/L NAA,设置添加物活性炭(0、0.2、0.5、1.0、2.0 g/L)、蔗糖(0、15、30、60、90、120 g/L)、水杨酸(0、0.05、0.1、0.5、1.0、2.0mg/L)、多效唑(0、5、10、20、40 mg/L)浓度。每个处理接种30个外植体。除特殊说明外,所有培养基均附加7.8 g/L琼脂、30 g/L蔗糖,pH值5.8~6.0。培养基在121 ℃高压灭菌锅中灭菌20 min。组培室温度为(25±2) ℃,光照度为2 000~3 000 lx,光照时间 16 h/d。培养45 d后,统计鳞茎直径、鳞茎球形指数、鳞茎鲜质量、结球率等相关指标。
1.2.3 试管鳞茎的移栽 将膨大后的毛百合试管鳞茎按照直径大小分成3~<5 mm、5~<8 mm、≥8 mm 3个级别。每级取20个小鳞茎移栽到装有高温灭菌蛭石的花盆中。40 d 后统计小鳞茎的移栽成活率和生长状况。
1.2.4 相关指标的计算方法 鳞茎直径:用经过高压灭菌的游标卡尺测量试管鳞茎的直径;鳞茎的球形指数=鳞茎高度/鳞茎直径;鳞茎的鲜质量:从培养基中取出诱导的小鳞茎,剪去叶片和根,称其鲜质量(用紫外消毒的电子天平称量)。
直径增大倍数=鳞茎直径/接种时鳞茎直径(0.3~0.4 cm)=结球率:已结球单芽数/接种时总单芽数×100%。
2 结果与分析
2.1 NAA对毛百合试管鳞茎膨大的影响
在培养基中适当添加NAA,不仅有利于幼苗生根,而且有利于鳞茎的形成及膨大。图1结果表明,随着NAA浓度升高,鳞茎鲜质量、结球率、鳞茎直径和新增鳞茎数均呈先增加后减少的趋势。当NAA浓度在0.5~2.0 mg/L时,结球率为100%;当NAA浓度为1.0 mg/L时,鳞茎鲜质量最大(658.4 mg),根系生长良好,叶多浓绿。当NAA的浓度为 2.0 mg/L 时,鳞茎直径、增大倍数、新增鳞茎数均为最好,但是根系细弱,叶色淡绿,叶片数目明显减少,且移栽后不易成活。综合考虑,促进鳞茎形成和膨大的最适宜NAA浓度为1.0 mg/L。
2.2 IBA对毛百合试管鳞茎膨大的影响
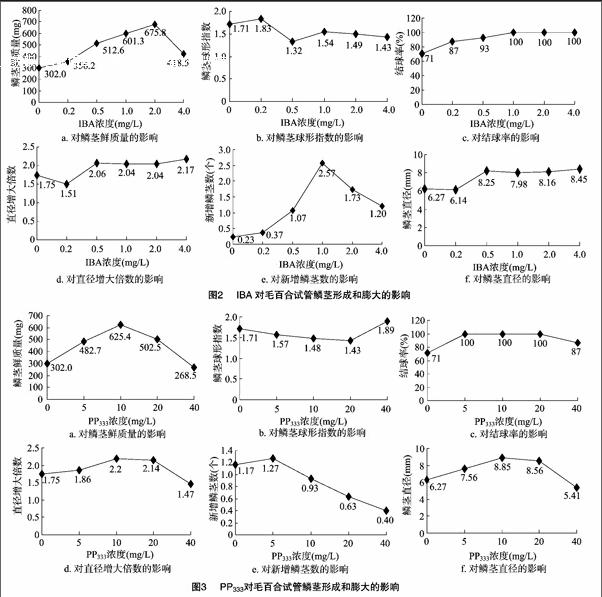
随着IBA浓度升高,鳞茎鲜质量和平均新增鳞茎数均呈先增大后减小的趋势,而结球率呈逐渐升高的趋势(图2)。当IBA浓度为1.0、2.0、4.0 mg/L时,结球率均100%,鳞茎直径均增大2倍以上,根系均生长良好,叶多浓绿。但当IBA浓度为1.0 mg/L时,新增鳞茎数最多(2.57个),鳞茎鲜质量(601.3 mg)低于IBA的浓度为2.0 mg/L时的鲜质量(675.8 mg)。但当IBA浓度等于4.0 mg/L时,鳞茎鲜质量和叶片数明显减少,根系细弱。整体来说,IBA的浓度为2.0 mg/L适宜用于毛百合鳞茎的膨大。
2.3 多效唑对毛百合试管鳞茎膨大的影响
随着PP333浓度升高,植株明显矮化,且明显抑制鳞茎形成,但对鳞茎膨大有明显的促进作用(图3)。当PP333的浓度为10 mg/L时,鳞茎增大2.2倍,鳞茎最大质量为 625.4 mg,结球率为100%。当PP333的浓度高于10 mg/L时,鳞茎直径、鲜质量明显下降,几乎不长叶片,叶片呈淡黄绿色,苗长势弱。当PP333的浓度高于5 mg/L时,新增鳞茎数明显下降。说明较低浓度的PP333(10 mg/L)对鳞茎膨大效果好,有利于诱导生根及试管苗生长,而高浓度的PP333抑制鳞茎膨大和试管苗生长。
2.4 活性炭对毛百合试管鳞茎膨大的影响
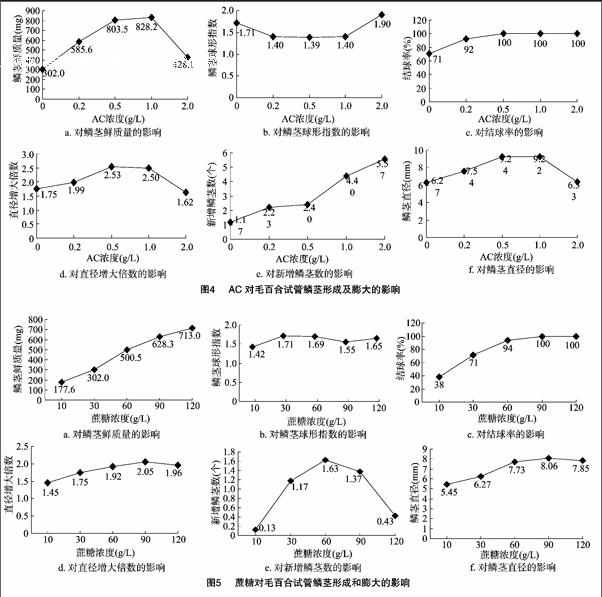
小鳞茎在添加AC的培养基上培养12 d后,鳞茎变绿稍有膨大,有淡绿色小叶片生长。25 d后鳞茎膨大明显,鳞片明显增厚,叶片数较少,根系生长较好(长0.5~1.0 cm)。45 d后统计数据发现,随着AC浓度升高,鳞茎直径及鲜质量的增加速度均呈现先逐渐增加后降低的趋势(图4)。当AC的浓度为1.0 g/L时,鳞茎直径9.22 mm,直径增大倍数2.50,鳞茎的球形指数1.40,鳞茎鲜质量828.2 mg,结球率100%,新增鳞茎4.40个,根系多且健壮,幼苗长势良好;当AC的浓度大于1.0 g/L,新增鳞茎数量较多,但鳞茎鲜质量均明显下降。因此,综合考虑可知,1.0 g/L的AC最有利于鳞茎的形成及膨大。
2.5 蔗糖对毛百合试管鳞茎膨大的影响
当蔗糖的浓度低于30 g/L(对照组浓度)时,与对照组相比鳞茎的形成和膨大效果较差(图5)。当蔗糖的浓度高于30 g/L时,与对照组相比鳞茎的形成和膨大效果较好,鳞茎鲜质量均呈增大趋势。当蔗糖的浓度为60 g/L时,平均新增鳞茎数最多(1.63个),幼苗长势良好。当蔗糖的浓度为 90 g/L 时,鳞茎的膨大效果较好,鳞茎直径最大(8.06 mm),直径增大倍数多(2.05),结球率100%,鲜质量628.3 mg,但新增鳞茎数有所下降。当蔗糖浓度为120 g/L时,鳞茎鲜质量达到最大值(713.0 mg),但新增鳞茎数量明显下降,基本无叶。说明60 g/L的蔗糖更有利于鳞茎的形成,120 g/L的蔗糖更有利于鳞茎膨大。从鳞茎膨大效果以及经济成本上考虑,生产上以90 g/L浓度的蔗糖为佳。
2.6 水杨酸对毛百合试管鳞茎膨大的影响
图6结果表明,水杨酸对鳞茎膨大无明显效果,但对小鳞茎的形成有一定的促进作用。当水杨酸在0.05~0.50 mg/L 浓度范围时,随着浓度升高,结球率明显提高,鳞茎数量明显增加。其中水杨酸在0.50 mg/L浓度时,诱导鳞茎效果最好,结球率87%,试管内新生小鳞茎的数量最多(4.63个)。当水杨酸浓度高于1.0 mg/L时,鳞茎数量减少。说明在培养基中添加适宜浓度的水杨酸有利于提高毛百合鳞茎的诱导率,但不利于毛百合鳞茎的膨大。
2.7 试管鳞茎的移栽
试管鳞茎的直径越小,移栽后的成活率越低;试管鳞茎的直径越大,移栽后的成活率越高(表1)。试管鳞茎直径在 3~<5 mm的植株长势稍弱,直径在5~<8 mm 范围内的植株长势一般;直径大于等于8 mm 的植株长势较好,整齐且健壮;这可能是由于试管鳞茎直径大,积累的营养物质多,移栽后对外界环境适应能力强,较易成活的原因。
3 讨论
适宜的激素浓度会促进毛百合鳞茎的形成和膨大。在培养基中附加NAA和IBA有助于试管鳞茎的生长。张延龙等研究发现,较低浓度(0.5 mg/L)的NAA不但能促进百合鳞茎形成,同时也能增加百合鳞茎的质量[13-14]。王晓丽等研究发现,适宜浓度的PP333有利于垂花百合试管鳞茎膨大,当PP333浓度为10 mg/L时,鳞茎增大2.47倍,鳞茎鲜质量达到最大值333.3 g,但随着PP333浓度的升高,鳞茎鲜质量和增大倍数呈下降趋势[15]。可见,植物激素会影响鳞茎的膨大,这些研究虽与本试验所用的浓度不同,但都表明:NAA、IBA、PP333不仅有利于试管苗生根,更有利于鳞茎形成及膨大,植物种类不同,其适宜的浓度也有差异,这就需要进行试验筛选。
不同浓度的添加物也会对鳞茎的生长有影响。王家福等发现,蔗糖浓度对百合鳞茎的直径有影响,蔗糖浓度为100 g/L时,鳞茎直径最大为4.5 mm,但随着蔗糖浓度的增加鳞茎增加不明显[16]。本试验研究表明,蔗糖浓度为90 g/L时,鳞茎直径最大(8.06 mm),超过90 g/L,直径下降。这表明适宜浓度的蔗糖有利于鳞茎直径的增大。一些研究表明,AC对小鳞茎的增长有一定的促进作用[17-18]。本试验发现,AC是所有因素中效果最明显的,1.0 g/L AC对试管鳞茎的形成及膨大效果最好,鳞茎直径增大2.5倍,鳞茎鲜质量828 mg,结球率100%,新增鳞茎4.40个。这对以后在组培条件下促进鳞茎的增长有重要的参考价值。
水杨酸广泛分布于高等植物中,是一种天然抑制剂,对植物有多种生理作用,被认为是一种新型植物激素[19]。张洁等研究发现,水杨酸浓度在0.05~0.2 mg/L范围内,有利于东方百合Sorbonne鳞茎的形成,但是水杨酸对百合鳞茎的膨大作用不明显[20]。这与本试验得到的结果一致。而刘芳等采用叶片喷施水杨酸的方法,发现百合品种“精粹”的鳞茎周径和鲜质量随浓度的增加而增加[21],这与本试验得到的结果不一致。这可能与植物种类和基因型有关,具体原因有待进一步研究。
参考文献:
[1]杨艳清. 野生花卉毛百合有性繁殖技术[J]. 北方园艺,2006(5):156-157.
[2]吉林省中医中药研究所.长白山自然保护区管理局,东北师范大学生物学.长白山植物药志[M]. 长春:吉林人民出版社,1982.
[3]张敩方,张显国,于海滨,等. 毛百合繁殖生物学研究 Ⅰ. 毛百合的自然生长与繁殖[J]. 植物研究,1992,12(3):301-307.
[4]杨利平,宋满珍,张 晶. 光照和温度对百合属6种植物种子萌发的影响[J]. 植物资源与环境学报,2000,9(4):14-18.
[5]张敩方,刘晓东,刘宏伟,等. 毛百合繁殖生物学研究 Ⅱ. 光照梯度上的形态性状差异与繁殖对策[J]. 植物研究,1993,13(3):285-293.
[6]胡凤荣,刘光欣,席梦利,等. 毛百合根尖染色体Giemsa C-带分析[J]. 基因组学与应用生物学,2010,29(1):87-90.
[7]唐 翠. 毛百合的核型分析[J]. 哈尔滨师范大学自然科学学报,2008,24(3):85-88.
[8]苏彩霞,霍秀文,李惠芝,等. 野生毛百合植株再生体系的建立[J]. 内蒙古农业大学学报:自然科学版,2013,34(6):23-26.
[9]岳 桦,朱 虹,张显峰,等. 毛百合的切花保鲜技术[J]. 东北林业大学学报,1999,27(2):68-71.
[10]朱官有,倪立伟,刘秀华,等. 毛百合的栽培[J]. 北方园艺,1993(3):19.
[11]张赪方,杨利平,丁 冰. 卫星搭载对毛百合的影响[J]. 空间科学学报,1996,16(S1):165.
[12]纪 莹,雷家军,李明艳. 毛百合与布鲁拉诺杂交后代的抗寒性研究[J]. 东北农业大学学报,2011,42(1):109-113.
[13]张延龙,梁建丽,牛立新. 东方百合试管鳞茎膨大的研究[J]. 西北农林科技大学学报:自然科学版,2006,34(6):75-78.
[14]Lim S,Seon J H,Paek K Y,et al. Development of pilot scale process for mass production of Lilium bulblets in vitro [J]. Acta Horticulturae,1998,461:237-241.
[15]王晓丽,韩立群,刘 杰,等. 活性炭和多效唑对垂花百合试管鳞茎膨大的影响[J]. 安徽农业科学,2011,39(19):11429-11430.
[16]王家福,陈振光. 百合快速繁殖条件的优化[J]. 福建农业大学学报,1999,28(2):152-156.
[17]席梦利,胡凤荣,刘光欣,等. 宜兴百合组培快繁体系的建立[J]. 林业科技开发,2006,20(6):69-70.
[18]谢 杰,余沛涛,王全喜. 宜兴百合的组织培养和快速繁殖[J]. 上海师范大学学报:自然科学版,2006,35(5):76-82.
[19]Raskin I. Role of salicylic acid in plant[J]. Annual Review of Plant Physiology Plant Molecular Biology,1992,43:439-463.
[20]张 洁,蔡宣梅,林 真,等. 百合试管鳞茎诱导及膨大技术的研究[J]. 福建农业学报,2010,25(3):328-331.
[21]刘 芳,周蕴薇. 水杨酸对两个品种百合鳞茎膨大的作用及其与内源激素含量的关系[J]. 植物生理学通讯,2009,45(11):1085-1088.齐小琼,胡晨熙,李大卫. 篦子三尖杉牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆与序列分析[J]. 江苏农业科学,2016,44(4):79-82.

