黄粉甲翅芽生长因子基因的克隆及表达分析
赵满+李丽芳+王友竹+Elena+N.+Elpidina+朱家颖
摘要:翅芽生长因子(imaginal disc growth factor,IDGF)是一类调节昆虫发育和生长的因子。利用RACE克隆技术,克隆获得黄粉甲(Tenebrio molitor) IDGF基因,其cDNA序列长1 465 bp,开放阅读框为1 296 bp,可编码431个氨基酸,预测理论分子量为48.25 ku,等电点为7.63。氨基酸序列同源比对分析发现,黄粉甲IDGF与赤拟谷盗(Tribolium castaneum)和蔗根非耳象(Diaprepes abbreviatus)的IDGF相似性分别为89%、71%。系统发育树分析表明,黄粉甲IDGF与赤拟谷盗IDGF进化关系最近。荧光定量PCR分析表明,在不同发育阶段,IDGF基因在幼虫1龄和2龄中的表达量明显高于其他发育阶段。在蛹期不同组织中,IDGF基因在脂肪体中的表达量最高。被管氏肿腿蜂(Scleroderma guani)寄生后,IDGF基因的转录水平未受影响,表明寄生不能调控该基因的转录表达。
关键词:翅芽生长因子;基因克隆;黄粉甲;序列分析;管氏肿腿蜂
中图分类号: S433.5
文献标志码: A
文章编号:1002-1302(2016)04-0095-04
翅芽生长因子(imaginal disc growth factor,IDGF)是一种可溶性多肽生长因子,因在黑腹果蝇(Drosophila melanogaster)翅芽C1.8+细胞中鉴定具有促进翅芽细胞的增殖和生长而得名[1-2]。最初,科学家们在黑腹果蝇中通过同源性搜索和遗传分析发现存在一些类生长因子,如Spitz和Gurken的表皮生长因子(EGF)、纤维细胞生长因子(FGF)及转化生长因子-β(TGF-β)[2-6]。但是,这些基因不具有生长因子所具备的促进有丝分裂活性,而仅是这些基因编码的分泌蛋白异常表达能导致细胞增生并抑制生长[7-9]。然而,经细胞体外培养认为,IDGF可能是作为胰岛素或类胰岛素的一个辅助因子而发挥生理功能[10-11]。目前,遗传学研究发现,IDGF参与调节果蝇的生长发育,在果蝇的胚胎卵黄细胞、胚胎和幼虫的脂肪体中显著表达,其蛋白分泌到血淋巴并运输到靶标组织而发挥生理功能[2]。本研究从黄粉甲(Tenebrio molitor)蛹中克隆得到IDGF基因的cDNA序列,并采用荧光定量PCR方法研究该基因在黄粉甲不同发育阶段、不同组织以及被管氏肿腿蜂(Scleroderma guani)寄生后的表达情况,为今后深入研究该基因的功能奠定了基础。
1 材料与方法
1.1 供试昆虫
供试昆虫参照Zhu等的方法[12]进行饲养。黄粉甲幼虫用饲料和洁净白菜叶室温自然光条件饲养。利用黄粉甲蛹在人工气候箱[(25 ± 1) ℃,相对湿度75%]中繁育管氏肿腿蜂。管氏肿腿蜂成蜂用蘸透20%蜂蜜水的脱脂棉球提供营养。
1.2 IDGF的克隆及分析
利用Trizol试剂法(Invitrogen)提取黄粉甲蛹总RNA。采用分光光度法测定总RNA含量,并用1%琼脂糖凝胶电泳检测总RNA的质量。以提取的总RNA为模板,用SMARTM RACE cDNA amplification kit (Clontech)合成cDNA模板。依据实验室前期对黄粉甲cDNA文库测序获得IDGF片段序列,用Primer Premier 5.0设计5′ RACE(5′-CGAACGCCAGACGATGTTCGACAGAT-3′)和3′RACE(5′-CGCACCCAACAACAAG CTGAT-3′)特异性引物。参照RACE试剂盒说明书,PCR扩增获得IDGF基因的3′端和5′端序列。PCR反应条件为:94 ℃预变性2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min 30 s,35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分离,切取目的条带并纯化后送至上海杰李生物技术有限公司测序。
利用Genetyx软件将翅芽生长因子IDGF基因的核苷酸序列翻译成氨基酸序列,利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,结构域采用MotifScan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)进行预测,利用ClustalX 1.83和MEGA 5.0软件进行多序列比对和构建分子系统进化树[13-14]。
1.3 荧光定量PCR
参照Zhu等的方法[15]收集黄粉甲不同发育阶段(幼虫1~3龄、蛹、成虫)、蛹不同组织(表皮、脂肪体、血细胞)及被管氏肿腿蜂寄生和未寄生(6、12、24、48 h)蛹样品进行总RNA提取,提取的总RNA使用RevertAid First Strand cDNA Synthesis Kit(Thermo)反转录合成cDNA模板。根据本次克隆获得的黄粉甲IDGF cDNA序列,设计荧光定量正向引物(5′-CCCAACGTTAACAGCTCT-3′)和反向引物(5′-CCTGTCGATTAATTCGTA-3′),以18 S RNA基因(5′-TTTCAAATGTCTGCCTTATC-3′和5′-TGTGGTAGCCGTTTCTCA-3′)作为内参使用Rotor Gene-Q荧光定量PCR仪检测IDGF基因在黄粉甲不同发育阶段、不同组织以及寄生与未寄生后的表达情况,每个处理重复3次。PCR反应条件为:95 ℃预变性2 min;95 ℃变性20 s,55 ℃退火30 s,40个循环。荧光定量PCR结果采用2-ΔΔCT法[16],数据显著性差异分析采用SPSS软件进行分析[17]。
2 结果与分析
2.1 IDGF基因的克隆及序列分析
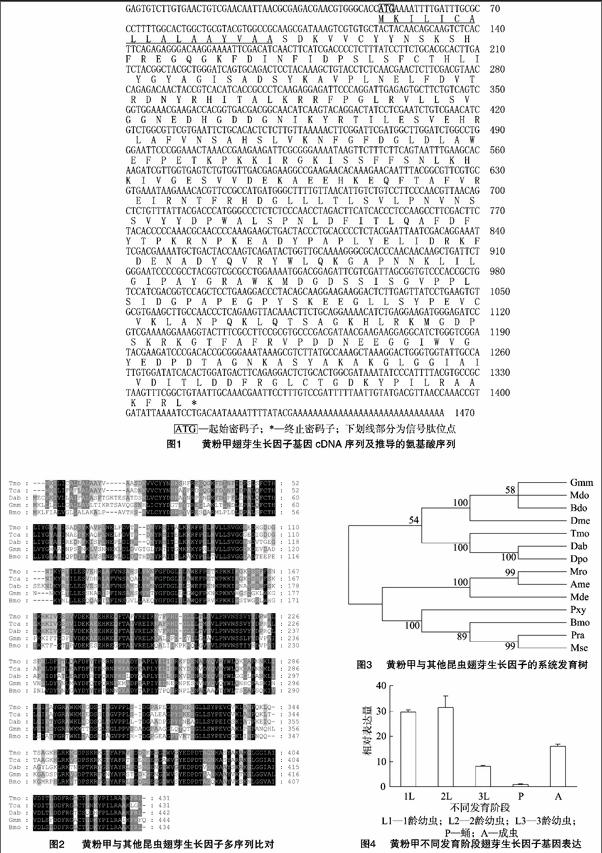
克隆获得的黄粉甲IDGF基因cDNA长为1 465 bp,开放阅读框框长为1 296 bp,该基因可编码431个氨基酸,5′端非编码区50 bp,3′端非编码区119 bp(图1)。其推导的氨基酸序列预测理论分子量为48.25 ku,等电点为7.63。SignalP分析发现,该IDGF基因推导的氨基酸序列中存在信号肽序列(MKILICALLALAAYVAA)。氨基酸序列同源性比对分析发现,黄粉甲IDGF与赤拟谷盗(Tribolium castaneum)IDGF的相似性为89%,与蔗根非耳象(Diaprepes abbreviatus)IDGF的相似性为71%(图2)。MotifScan分析发现,该IDGF基因cDNA序列中存在1个N-糖基化位点(NSSV216-219),1个依赖cGMP和cGMP的蛋白激酶磷酸化位点(RKGT360-363),5个酪蛋白激酶Ⅱ磷酸化位点(TILE116-119、SVVD176-179、SKEE322-325、SYPE329-332、TLDD408-411),6个N-豆蔻酰化位点(GLDLAW142-147、GLLLTL204-209、GAPNNK279-284、GIWVGY376-381、GNKASY388-393、GLCTGD414-419),5个蛋白激酶C磷酸化位点(SDK18-20、SYK64-66、TFR199-201、TPK242-244、SKR358-360),2个酪氨酸激酶磷酸化位点(RNPKEADY245-252、RKFDENADY262-270),第119位点至第137位点是一个未知蛋白功能结构域,第19位点至第410位点氨基酸区域是18糖基水解酶家族的保守结构域。利用MEGA 5.0构建NJ系统发育树,结果显示黄粉甲IDGF与赤拟谷盗IDGF聚在一起,进化关系最近(图3)。
2.2 IDGF基因的表达特征
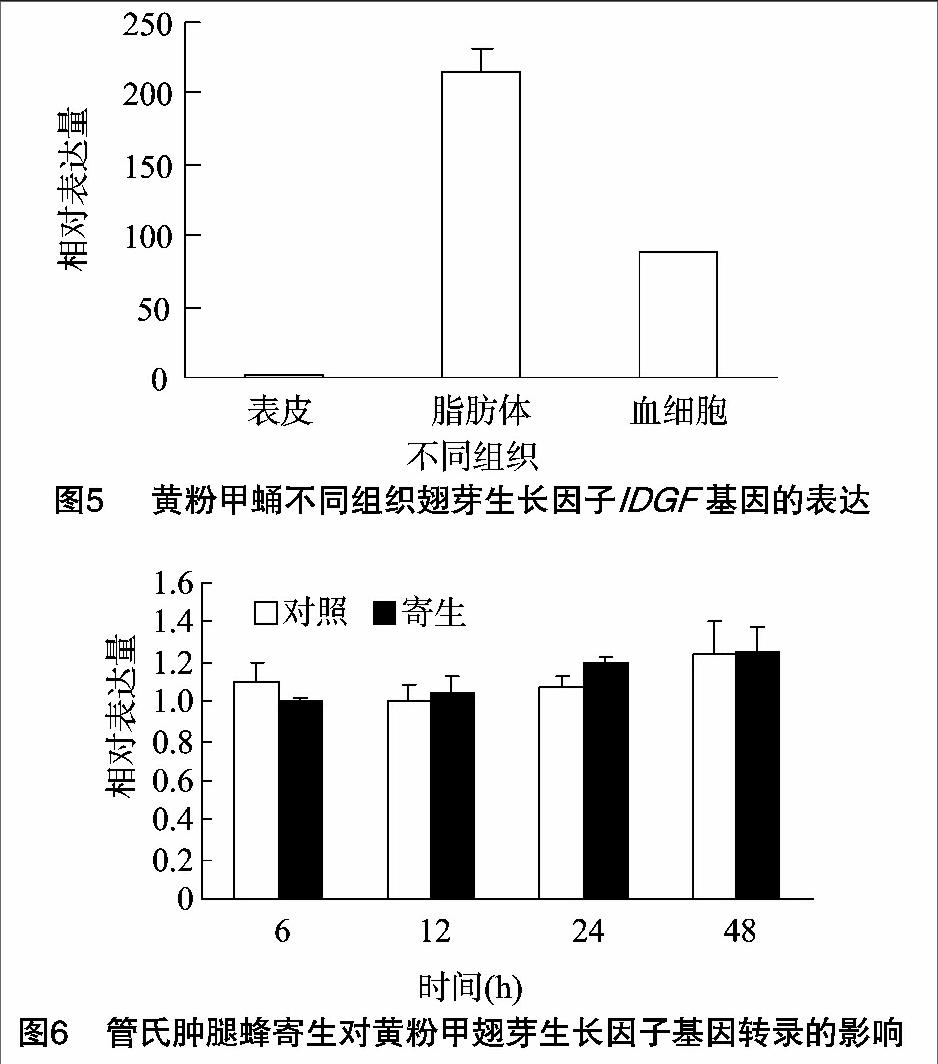
在不同发育阶段,IDGF基因在幼虫1龄和2龄中的表达量明显高于其他发育阶段,成虫次之,蛹期表达量最低(图4)。在蛹期不同组织中,IDGF基因在脂肪体中的表达量最高,血细胞次之,而表皮中几乎没有表达(图5)。被管氏肿腿蜂寄生后,IDGF基因的表达不会发生显著变化,表明寄生未对该基因的表达产生调控作用(图6)。
3 结论与讨论
通过RACE技术克隆获得的IDGF基因推导的氨基酸序列预测分子量为48.25 ku,与先前报道的黑腹果蝇IDGF家族基因约为50 ku和菜粉蝶(Pieris rapae)IDGF为52 ku大小相近[1,18]。Varela等在果蝇IDGF-2基因研究中发现其含有18糖基水解酶家族,黄粉甲IDGF基因氨基酸序列分析发现也存在18糖基水解酶家族保守结构域[11]。
在果蝇IDGF研究中发现,IDGF在果蝇胚胎卵黄细胞、胚胎和幼虫中均有表达,但在幼虫期表达显著[1-2]。通过对意大利蜜蜂(Apis mellifera)工蜂幼虫不同日龄IDGF基因的表达特征研究表明,该基因在幼虫期表达显著[19]。与这些研究结果相似,黄粉甲IDGF在幼虫1龄和2龄的表达量显著高于蛹和成虫阶段。在果蝇幼虫中,IDGF基因在脂肪体中的显著表达[2,20]。在菜粉蝶中,IDGF在脂肪体和血细胞中均有表达,但脂肪体中的表达量明显高于血细胞中的表达量[10,21]。同样,黄粉甲IDGF基因在脂肪体中显著表达,且明显高于血细胞中的表达量。管氏肿腿蜂寄生黄粉甲蛹后,IDGF基因不受寄生所调控,这与Asgari等报道的菜粉蝶被微红盘绒茧蜂寄生和注射多份DNA病毒后IDGF基因的表达没有受到影响[18]以及Zhu等所报道的菜粉蝶被蝶蛹金小蜂寄生后IDGF转录水平不受影响[21]的结果相似。本研究结果表明,黄粉甲IDGF基因应不受寄生蜂所携带的寄生因子所调控。
参考文献:
[1]Hipfner D R,Cohen S M. New growth factors for imaginal discs[J]. BioEssays,1999,21(9):718-720.
[2]Kawamura K,Shibata T,Saget O,et al. A new family of growth factors produced by the fat body and active on Drosophila imaginal disc cells[J]. Development,1999,126(2):211-219.
[3]Schweitzer R,Shaharabany M,Seger R,et al. Secreted spitz triggers the DER signaling pathway and is a limiting component in embryonic ventral ectoderm determination[J]. Genes & Development,1995,9(12):1518-1529.
[4]Neuman-Silberberg F S,Schüpbach T. The drosophila dorsoventral patterning gene gurken produces a dorsally localized RNA and encodes a TGF alpha-like protein[J]. Cell,1993,75(1):165-174.
[5]Sutherland D,Samakovlis C,Krasnow M A. Branchless encodes a drosophila FGF homolog that controls tracheal cell migration and the pattern of branching[J]. Cell,1996,87(6):1091-1101.
[6]Gelbart W M. The decapentaplegic gene:a TGF-β homologue controlling pattern formation in Drosophila[J]. Development,1989,107(Suppl):65-74.
[7]Capdevila J,Guerrero I. Targeted expression of the signaling molecule decapentaplegic induces pattern duplications and growth alterations in Drosophila wings[J]. The EMBO Journal,1994,13(19):4459-4468.
[8]Pignoni F,Zipursky S L. Induction of drosophila eye development by decapentaplegic[J]. Development,1997,124(2):271-278.
[9]Neumann C J,Cohen S M. Distinct mitogenic and cell fate specification functions of wingless in different regions of the wing[J]. Development,1996,122(6):1781-1789.
[10]Zhang J,Iwai S,Tsugehara T,et al. MbIDGF,a novel member of the imaginal disc growth factor family in Mamestra brassicae,stimulates cell proliferation in two lepidopteran cell lines without insulin[J]. Insect Biochemistry and Molecular Biology,2006,36(7):536-546.
[11]Varela P F,Llera A S,Mariuzza R A,et al. Crystal structure of imaginal disc growth factor-2. A member of a new family of growth-promoting glycoproteins from Drosophila melanogaster[J]. Journal of Biological Chemistry,2002,277(15):13229-13236.
[12]Zhu J Y,Yang P,Zhang Z,et al. Transcriptomic immune response of Tenebrio molitor pupae to parasitization by Scleroderma guani[J]. PLoS One,2013,8(1):e54411.
[13]Thompson J D,Gibson T J,Higgins D G. Multiple sequence alignment using ClustalW and ClustalX[M]//Current protocols in bioinformatics. New York:John Wiley and Sons,2002:1-22.
[14]Tamura K,Peterson D,Peterson N,et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739.
[15]Zhu J Y,Ze S Z,Stanley D W,et al. Parasitization by scleroderma guani influences expression of superoxide dismutase genes in tenebrio molitor[J]. Archives of Insect Biochemistry and Physiology,2014,87(1):40-52.
[16]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2ΔΔCT method[J]. Methods,2001,25(4):402-408.
[17]贾丽艳,杜 强.SPSS统计分析标准教程[M]. 北京:人民邮电出版社,2005.
[18]Asgari S,Schmidt O. Isolation of an imaginal disc growth factor homologue from Pieris rapae and its expression following parasitization by Cotesia rubecula[J]. Journal of Insect Physiology,2004,50(8):687-694.
[19]李华玮,何金环,郑 鸣.王浆高产蜜蜂工蜂幼虫发育期肽质量指纹图谱的建立[J]. 西北农林科技大学学报:自然科学版,2013,41(3):19-26.
[20]Kirkpatrick R B,Matico R E,Mcnulty D E,et al. An abundantly secreted glycoprotein from Drosophila melanogaster is related to mammalian secretory proteins produced in rheumatoid tissues and by activated macrophages[J]. Gene,1995,153(2):147-154.
[21]Zhu J Y,Fang Q,Ye G Y,et al. Proteome changes in the plasma of Pieris rapae parasitized by the endoparasitoid wasp Pteromalus puparum[J]. Journal of Zhejiang University:Science,2011,12(2):93-102. 焦念元,汪江涛,尹 飞,等. 化学调控与施磷肥对玉米花生间作光合物质积累和产量的影响[J]. 江苏农业科学,2016,44(4):99-104.

