香蕉枯萎病拮抗放线菌8N—10的分离鉴定及抑菌效果评价
王飞+周登博+廉法钦+陈宇丰+高祝芬+戚春林+张锡炎
摘要:为了分离对香蕉枯萎病病原菌有拮抗作用的放线菌,对菌株8N-10进行鉴定及测定抗菌活性。采用梯度稀释涂布平板法和平板对峙法分离拮抗菌,通过形态学特征、生理生化特征、16S rDNA序列测定及建树分析确定其分类学地位。用平板对峙的方法测定菌株对9种香蕉病原菌的拮抗作用,最后用盆栽试验的方法验证菌株8N-10对香蕉枯萎病的防效。结果表明,共分离出10株拮抗放线菌,初步鉴定拮抗性最好的菌株8N-10为诺尔斯氏链霉菌(Streptomyces noursei)对香蕉枯萎病病原菌4号小种的抑菌带达(15.5±0.65) mm。菌株8N-10对所有供试病原菌均具有不同程度的拮抗活性,表现出良好的广谱抗菌特性。其中,菌株8N-10对香蕉叶缘枯斑病病原菌(Alternaria musae)、粉蕉叶枯病病原菌(Pestalogiopsis sp.)、香蕉长形斑病病原菌(Curvularia fallax)的抑菌带均达到10 mm以上,显示了较强的抑制活性。菌株8N-10发酵液对香蕉枯萎病的相对防治率达92.708%,具有很好的防治效果。诺尔斯氏链霉菌8N-10对香蕉枯萎病的抑菌活性高,且其抑菌谱广,具有很好的应用前景。
关键词:香蕉枯萎病;拮抗菌;诺尔斯氏链霉菌
中图分类号: S476
文献标志码: A
文章编号:1002-1302(2016)04-0179-05
香蕉枯萎病,别称巴拿马病、黄叶病,是由尖孢镰刀菌古巴专化型引起的毁灭性土传维管束病害[1]。该菌分为4个生理小种[2],其中4号小种侵染范围最广,几乎危害所有的香蕉品种。目前该病已经传遍我国广东、广西、福建、云南、海南等主要香蕉种植产区[3],因此分离具有拮抗作用的放线菌,从而达到生物防治香蕉枯萎病的效果不失为一个很有意义的研究方向。生物防治是植物病虫害综合治理的重要手段,是保护生态环境、实现农业可持续发展的有力保障[4]。何欣等研究发现施用生物有机肥能显著促进香蕉植株生长,有效降低香蕉枯萎病的发病指数[5]。随着人们的不断探究,发现放线菌中的链霉菌对香蕉枯萎病菌的抑制作用非常明显[6]。秦涵淳等用分离出的2株放线菌发酵液进行盆栽试验,结果对香蕉枯萎病防效达86%以上,极显著高于恶霉灵药剂处理[7]。本研究对采集的香蕉根际土壤放线菌进行了分离筛选,选其中1株对香蕉枯萎病菌拮抗作用最强的的放线菌 8N-10 进行菌株鉴定,并测定该菌株对香蕉枯萎病的抑制效果以及菌株对其他香蕉病原菌的广谱拮抗性能。
1 材料与方法
1.1 试验材料
供试病原菌为香蕉枯萎病病原菌(Fusarium oxysporium f. sp. cubense 4,FOC4)、香蕉长形斑病菌(Curvularia fallax)、香蕉炭疽病菌(Colletotrichum musae)、香蕉大灰斑病菌(Curvularia lunata)、贡蕉眼斑病菌(Bioplaris oryzae)、香蕉果尖腐烂病菌(Deightoniella troulosa)、香蕉叶缘枯斑病菌(Alternaria musae)、贡蕉烟头病菌(Fusarium sp.)、粉蕉叶枯病菌(Pestalogiopsis sp.)均由笔者所在实验室保存[8]。供试土壤为海南省临高县南宝镇(109°51′18″E,19°47′3″N)香蕉园健康植株根际土壤。除去石子、根系等杂物,混匀后用无菌封口袋采集,于 4 ℃ 冰箱保存。培养基按照文献[9]的方法配制。放线菌分离和培养采用高氏一号琼脂培养基,倒平板前加入0005% 的重铬酸钾来抑制细菌和真菌的生长;用PDA培养基进行病原菌的培养以及拮抗试验;鉴定用培养基参照文献[10]的方法配制。
1.2 拮抗放线菌的分离与筛选
1.2.1 土壤放线菌的分离 称取土样5 g,加入45 mL无菌水,于28 ℃、200 r/min的摇床中振荡1 h,吸取上清液用无菌水逐级稀释成10-2、10-3和10-4浓度,每个浓度各吸取 100 μL 涂布到含重铬酸钾的高氏一号培养基平板上,封口膜封口后倒置培养在28 ℃的生化培养箱中,适时挑取不同形态的单个菌落分离划线,纯化并保存。
1.2.2 筛选拮抗放线菌 采用琼脂块平板对峙培养法[11]筛选拮抗放线菌,用打孔器截取直径5 mm的香蕉枯萎病病原菌菌饼于PDA平板中央,并在周围4个角距离病原菌边缘 2.5 cm 处接种待测菌株,对照只接病原菌菌饼,倒置培养在28 ℃的生化培养箱中,对照组菌丝铺满培养基时观察试验组抑菌情况,测量抑菌带的宽度。根据有无抑菌带筛出对FOC4有拮抗效果的菌株,连续接种5代进行复筛,选取抑菌带最宽的菌株进行下一步试验。
1.3 拮抗菌株的鉴定
1.3.1 形态学观察 将拮抗菌株划线接种于高氏一号培养基,28 ℃插片培养 7~14 d,显微镜下观察菌体的形态特征。
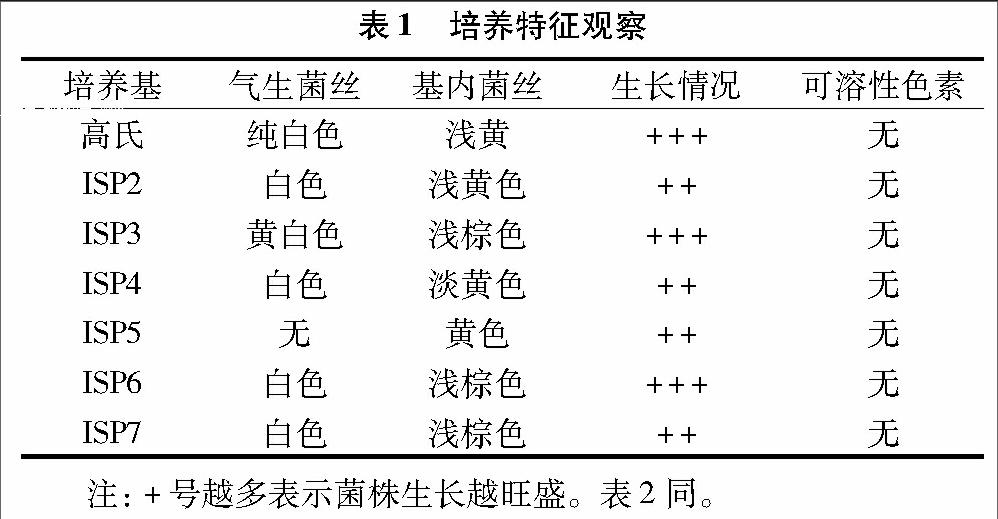
1.3.2 培养特征观察 采用文献[12]提供的方法,将拮抗菌株分别接种在高氏一号、ISP2、ISP3、ISP4、ISP5、ISP6、ISP7培养基上,28 ℃培养8~15 d,观察培养基内菌丝、气生菌丝的生长状况和可溶性色素的颜色。
1.3.3 生理生化特性测定 测定拮抗菌株明胶液化、酯酶、脲酶、淀粉水解、纤维素利用、硝酸盐还原、H2S的产生、pH值和氯化钠耐受范围、碳源利用、氮源利用等生理生化特性[10]。
1.3.4 细胞壁化学成分分析 采用快速薄板层析法[13]对菌株8N-10的全细胞水解液的氨基酸和糖型进行分析。
1.3.5 分子生物学鉴定 采用碱裂解法提取基因组DNA[14],用通用引物27F,5′-AGAGTTTGATCCTGGCTCAG-3′,1 492R,5′-GGTTACCTTGTTACGACTT-3′进行PCR扩增。反应体系50 μL,10 μL DNA模板、引物1 492R、27F各17 μL、25 μL DreamTaqTMGreen PCR master mix、22 μL ddH2O。PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30个循环;72 ℃终延伸 10 min,4 ℃保存。PCR产物送至北京六合华大基因科技股份有限公司进行测序。将测序获得的16S rDNA序列通过Blast程序、BioEdit、Mega 6.0软件进行分析并构建系统发育树。
1.4 抗菌谱的测定
将指示真菌菌盘接种在PDA平板中央,在真菌菌饼周围四角距离2.5 cm处接种8N-10菌株,对照只接病原菌菌饼,倒置培养在28 ℃的生化培养箱中,试验设3个平行。待对照长满培养皿时观察测量抑菌带的宽度并拍照记录。
1.5 拮抗放线菌发酵液对FOC4抑制作用的测定
1.5.1 拮抗菌发酵液的制备 将拮抗菌接种到大豆粉液体培养基中,28 ℃、200 r/min振荡培养7 d。
1.5.2 制备FOC4孢子悬浮液 选取FOC4菌丝铺满平板的PDA培养基,用无菌水配制成1×106 CFU/mL孢子悬浮液。
1.5.3 拮抗放线菌发酵液对FOC4孢子萌发影响情况的测定 将拮抗菌发酵液8 000 r/min离心5 min,上清液用微孔滤膜过滤除菌后与FOC4孢子悬浮液等体积混合均匀置于玻片上,光照培养在28 ℃、湿度为80%的人工气候箱中24 h,无菌水对照。在显微镜下观察,以孢子萌发的芽管长度达到或超过孢子直径长度的一半定为萌发[15],并计算各处理的孢子萌发率,以5次重复的平均值作为测定结果。
孢子萌发抑制率=[(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率]×100%。
1.5.4 拮抗放线菌8N-10对香蕉枯萎病抑制的盆栽效果测定 试验设4个处理,分别为染病后浇清水、染病后浇不加拮抗菌的发酵液、染病后浇拮抗菌发酵液、不染病浇清水。每处理设20个重复。
种苗染病采用蘸根接种法[14]接种后置于室温、自然光照条件下培养,每3 d浇1次水。待染病各组均有香蕉苗叶片变黄后,处理2施用无菌发酵液,处理3施用拮抗菌发酵液,每株灌注100 mL,每7 d浇1次发酵液。连续试验90 d后统计各处理病情指数(DSI)。
病情分级,0级为无症状;1级整株无变黄叶片;2 级为1株2片叶萎蔫;3级为全株 1/3~1/2 叶片萎蔫;4级为全株1/2株黄叶叶片萎蔫;5级为全株3/4 以上叶片萎蔫或死亡[16]。
DSI=∑(病害的级别×该级别的植株数)/供试植株数[16]。
相对防治效果=[(对照病情指数-处理病情指数)/对照病情指数]×100%[17]。
2 结果与分析
2.1 菌株筛选
初步筛选获得10株拮抗放线菌,其中8N-10对香蕉枯萎病菌的抑菌带最大,达到(15.5±0.65) mm,因此选取该菌株作进一步研究。
2.2 拮抗菌株的鉴定
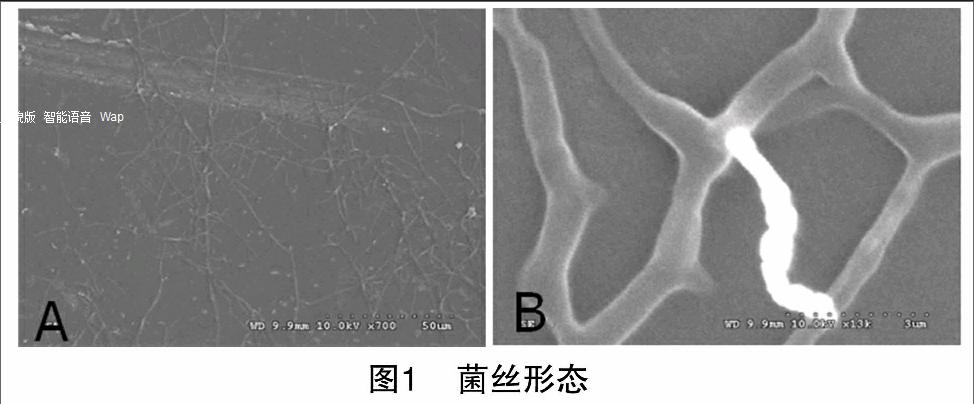
2.2.1 形态学结果 菌株8N-10的菌丝生长旺盛,分枝明显(图1-A),无横膈膜(图1-B)。
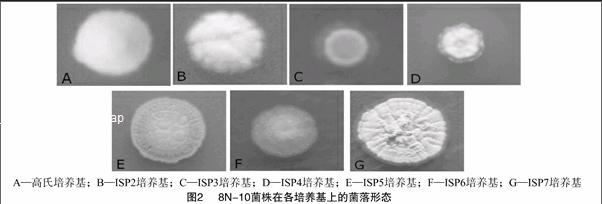
2.2.2 培养特征结果 菌株8N-10在不同培养基上的菌落形态如图2所示,菌落在7种培养基上均呈近圆形,在ISP2、ISP4、ISP5、ISP7培养基上褶皱明显,在ISP1、ISP2培养基上气生菌丝呈粉末状覆盖在表层。具体形态特征见表1。
2.2.3 生理生化特性测定 在碳源利用方面菌株8N-10能很好地利用鼠李糖、木糖、阿拉伯糖、水杨苷、可溶性淀粉、纤维二糖、山梨醇、D-果糖、α-乳糖、葡萄糖、蔗糖、D-甘露醇,能较好地利用松三糖、无水乳糖、肌醇、木聚糖、核糖、蜜二糖,对D-半乳糖利用效果不是很好,不能利用海藻糖、甘露醇;在氮源利用方面能很好地利用甘氨酸、羟基脯氨酸、缬氨酸,能较好地利用四水合钼氨酸,在蛋氨酸、苯基丙氨酸、硫酸铵、硝酸铵、丝氨酸上生长一般,在组氨酸、半胱氨酸上生长不佳,不能在精氨酸、草胺酸、乙酸铵为氮源的培养基上生长;菌株8N-10有淀粉水解能力;能使硝酸盐还原;能产生尿素酶;能分解吐温20,不能分解吐温40和吐温80;不产H2S;不能水解纤维素;能使明胶液化;pH值为4~10均可生长;在盐度为1%~2%时生长,在2%以上不能生长(表2)。
2.2.4 细胞壁化学成分 细胞壁化学成分分析显示,菌株8N-10细胞壁含有谷氨酸、丙氨酸等,化学组分属于Ⅰ型,其全细胞水解不含特征性糖,糖型为C。
2.2.5 16S rDNA碱基序列测定 放线菌8N-10用通用引物扩增后,PCR产物大小在1 500 bp左右,测序得出序列长度为1 422 bp。与GenBank数据库中相关种属的菌株进行序列比对,发现与菌株8N-10同源性达99%的均为链霉菌。选取20个序列进行系统发育学分析(图3),菌株8N-10与Streptomyces noursei(诺尔斯氏链霉菌)聚为一支,结合形态学特征、生理生化特征初步将菌株8N-10归类为诺尔斯氏链霉菌。
2.3 抗菌谱测定结果
平板对峙结果显示菌株8N-10抗菌谱广,对所有供试病原菌均具有不同程度的拮抗活性。其中,菌株8N-10对香蕉叶缘枯斑病(图4-A)、粉蕉叶枯病(图4-B)、香蕉长形斑病(图4-C)病菌的抑制活性较强,抑菌带均达到10 mm以上,对长形斑病抑制效果最好,抑菌带达到13.30 mm(表3)。
2.4 拮抗放线菌发酵液对FOC4抑制作用测定结果
2.4.1 对FOC4孢子萌发抑制作用的测定结果 对照组的FOC4孢子萌发率达到了90.25%(图5-A),经拮抗菌发酵液处理的FOC4 孢子萌发率为5.16%(图5-B),发酵液对孢子萌发的抑制率达94.28%(图5)。
2.4.2 盆栽防效结果 连续栽种90 d后,接染病原菌后浇清水(图6-A)的一组香蕉苗全部死亡干枯,病情指数达到5;接染病原菌后浇无菌发酵液(图6-B)的一组香蕉苗只剩4株依然存活,且剩余4株苗全株1/2叶片萎蔫,该组病情指数4.8;接染病原菌后浇加菌发酵液(图6-C)的一组香蕉苗存活19株,1株干枯死亡,病情指数0.35,植株长势优良;未接菌浇清水(图6-D)的一组香蕉苗均能成活,但生长状况差。初步结果表明拮抗菌发酵液对香蕉枯萎病的相对防治效果为92.708%,且种苗生长状况良好(图6)。
3 结论与讨论
大量研究结果表明,应用拮抗微生物能安全有效地防治果蔬病害[18-19],目前人们已成功分离和筛选到数百种对果蔬病害有明显抑制效果的拮抗微生物[20-22],有数十种微生物已研发成菌剂在生产上应用。但香蕉枯萎病的生物防治研究起步较晚,目前还没有成功的商业化产品[22]。南宝蕉园的香蕉连续留芽10年,而枯萎病的发病率依然在10%以下,除了规范化的管理以外,其土壤环境必然有特殊之处。
本研究从南宝蕉园香蕉根际土壤中分离出10株拮抗放线菌,其中8N-10在平板上对枯萎病菌的抑菌带达到 (15.5±0.65) mm,和同类研究中的15.3 mm的抑菌带宽度相当[17]。结合生理生化特征、分子生物学鉴定等结果初步将菌株8N-10归类为诺尔斯氏链霉菌。以诺尔斯氏链霉菌作为生防菌防治香蕉枯萎病目前尚未有报道,本研究发现拮抗菌8N-10的发酵滤液对香蕉枯萎病菌的孢子萌发有很好的抑制作用,抑制率达到94.28%。其发酵液对患病香蕉苗的治疗效果很好,相对防治效果为92.708%,盆栽防控效果比俞鲁等报道的防治效果为74%[23]要好,而且施用发酵液的香蕉苗营养供应充足,长势良好。拮抗菌8N-10对香蕉的其他8种病害病原菌均有一定的抑制作用,其抑菌谱广。其中,菌株8N-10对香蕉叶缘枯斑病、粉蕉叶枯病、香蕉长形斑病的抑菌带均达到10 mm以上,具有较强的抑制活性,但其广谱抑菌效果不如黄霄等报道的类植物乳杆菌[24]。但综合结果表明拮抗菌8N-10在香蕉病害的防治方面具有很好的开发价值。
农用抗生素大多来源于放线菌,因此从放线菌中筛选拮抗菌一直是生防菌研究热点[25]。诺尔斯氏链霉菌产生的化合物已有报道[26],本研究所筛选出的菌株其有效活性成分还有待进一步试验,其对病原菌的拮抗机理还有待进一步探究。
参考文献:
[1]麦明晓,黄惠琴,叶建军,等. 香蕉枯萎病拮抗放线菌Da08006的筛选与鉴定[J]. 生物技术通报,2009,25(增刊1):169-171.
[2]麦明晓,黄惠琴,鲍时翔. 香蕉镰刀菌枯萎病4号生理小种研究进展[J]. 中国生物防治,2009(增刊1):71-75.
[3]魏岳荣,黄秉智,杨 护,等. 香蕉镰刀菌枯萎病研究进展[J]. 果树学报,2005,22(2):154-159.
[4]Liu Y J,Zhu H J,Chen L J,et al. Identification and fungal inhibition spectrum of actinomycetes strain HND39[J]. Chinese Journal of Biological Control,2008,24(3):272-276.
[5]何 欣,郝文雅,杨兴明,等. 生物有机肥对香蕉植株生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报,2010,16(4):978-985.
[6]Getha K,Vikineswary S. Antagonistic effects of Streptomyces violaceusniger strain G10 on Fusarium oxysporum f.sp. cubense race 4:indirect evidence for the role of antibiosis in the antagonistic process[J]. Journal of Industrial Microbiology and Biotechnology,2002,28(6):303-306.
[7]秦涵淳,杨腊英,李松伟,等. 香蕉镰刀菌枯萎病拮抗放线菌的分离筛选及其抑制效果的初步评价[J]. 中国生物防治,2010,26(2):174-180.
[8]胡一凤,井 涛,周登博,等. 抗FOC4内生放线菌NJQG-3A1的定殖与防效研究[J]. 中国农学通报,2014,30(28):280-285.
[9]陈天寿. 微生物培养基的制造与应用[M]. 北京:中国农业出版社,1995.
[10]徐丽华,李文均,刘志恒,等. 放线菌系统学——原理、方法及实践[M]. 北京:科学出版社,2007.
[11]Birber B,Nuske J,Ritzau M. Alnumycin a new naphthoquinone antibiotic produced by an endophytic Streptomyces sp.[J]. Journal of Antibiotics,1998,51:381-382.
[12]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M]. 北京:科学出版社,1975.
[13]刘志恒,姜成林. 放线菌现代生物学与生物技术[M]. 北京:科学出版社,2004.
[14]徐冠军. 植物病虫害防治学[M]. 北京:中央广播电视大学出版社,1999.
[15]方中达. 植病研究方法[M]. 北京:中国农业出版社,1996.
[16]何 欣,黄启为,杨兴明,等. 香蕉枯萎病致病菌筛选及致病菌浓度对香蕉枯萎病的影响[J]. 中国农业科学,2010,43(18):3809-3816.
[17]刘小玉,周登博,谭 昕,等. 香蕉枯萎病拮抗放线菌1-g-59的筛选与鉴定[J]. 生物技术通报,2013(8):124-129.
[18]Mclaughlin R J,Whson C L,Droby S,et al.Biological control of postharvest diseases of grape,peach,and apple with yeasts Kloeckera apiculata and Candida guilliermondii[J]. Plant Disease,1992,76(5):470-473.
[19]Roberts R G. Postharvest biological control of gray mold of apple by Cryptococcus laurentii[J]. Phytopathology,1990,80(6):526-530.
[20]秦涵淳,杨腊英,李松伟,等. 香蕉镰刀菌枯萎病拮抗放线菌的分离筛选及其抑制效果的初步评价[J]. 中国生物防治,2010,26(2):174-180.
[21]Bouzerdal,Boubaker H,Boudyache H,et al.Selection of antagonistic yeasts to greenmold disease of Citrus in Morocco[J]. Food,Agriculture & Environment,2003,1(3/4):215-218.
[22]Palumbo J D,OKeeffe T L,Ali K,et al. Inhibition of Aspergillus flavus in soil by antagonistic Pseudomonas strains reduces the potential for airborne spore dispersal[J]. Phytopathology,2010,100(6):532-538.
[23]俞 鲁,凌 宁,张 楠,等. 香蕉枯萎病拮抗菌的筛选鉴定及其生防效果[J]. 南京农业大学学报,2012,35(4):81-86.
[24]黄 霄,周登博,张锡炎,等. 1株香蕉枯萎病菌拮抗菌鉴定及抑菌效果[J]. 江苏农业科学,2013,41(7):90-93.
[25]罗建军,李 辉,耿 鹏,等. 拮抗放线菌MY-4的分离、鉴定及其对果蔬病原菌的抑制作用[J]. 果树学报,2012,29(4):644-649.
[26]李文利,夏 娟. 二酮哌嗪类化合物生物合成研究进展[J]. 微生物学通报,2014,41(1):111-121.
黄胜先,李佳林,侯 彪,等. 有机蓝莓园昆虫群落结构及动态[J]. 江苏农业科学,2016,44(4):184-187.

