京尼平苷对青菜光合反应及生理指标的影响
严萍+郭斐斐+宋雪飞+关水玲+陈刚+钱善勤+朱梅+朱建文+朱潜荣
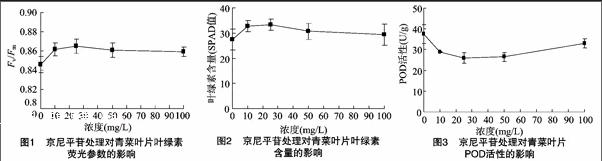
摘要:以青菜抗热605为材料,在青菜移栽后分别采用不同浓度京尼平苷水溶液对青菜幼苗进行喷施处理,测定青菜叶片叶绿素荧光值、叶绿素含量、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、可溶性糖及可溶性蛋白含量等指标。结果表明,不同浓度京尼平苷处理对青菜叶片光合叶绿素荧光值、叶绿素含量均有促进作用,同时对植物抗逆性有明显促进作用,对青菜叶片中可溶性蛋白、可溶性糖等含量具有明显促进作用,但对青菜叶片的硝酸盐含量没有明显影响;随着京尼平苷浓度增大,其促进作用呈先上升、后下降的趋势,在京尼平苷浓度为25 mg/L时作用最为明显。
关键词:京尼平苷;青菜;光合反应;生理指标
中图分类号: S634.9
文献标志码: A
文章编号:1002-1302(2016)04-0193-03
京尼平苷是一种环烯醚萜葡萄糖苷,无毒,易溶于水、乙醇,不溶于石油醚,主要存在于栀子、杜仲、管花肉苁蓉等植物中[1-2]。京尼平苷具有很强的生理活性,对扦插生根与作物增产有显著的促进作用[3],能够促进多种不易生根植物插穗生根,显著提高扦插成活率[4]。将京尼平苷制成一系列复方增产剂,应用在小麦、棉花、黄瓜等农作物生产试验中,增产效果明显[5-8],京尼平苷对玉米幼苗的理化指标也有很好的促进作用[9],但京尼平苷对其他作物生长的影响及作用机理尚未见报道。本研究以十字花科的蔬菜青菜(Brassica chinensis L.)为材料,研究不同浓度京尼平苷对青菜光合反应、抗逆性以及可溶性糖与可溶性蛋白含量等生理指标的影响,以期探明京尼平苷促进青菜生长的生理机制,为京尼平苷在蔬菜生产上的应用提供依据。
1 材料与方法
1.1 材料
供试京尼平苷为广西山云生化科技有限公司提供的高纯度(≥98%)京尼平苷产品。供试青菜品种为抗热605,购于扬州扬子种业有限公司。
1.2 方法
1.2.1 播种及田间管理 试验在扬州大学实验农场大棚内进行。2014年10月15日上午翻耕,施用适量复合肥,再翻耕,平整。10月20日下午播种,浇水。10月25日上午青菜出芽。11月15日在青菜三叶期时移栽,每小区幼苗行距、株距均为15 cm,所有材料均采用相同的肥水管理方式。
1.2.2 试验处理 分别在2015年1月9日、29日对青菜进行京尼平苷处理,每次处理时分别将0、10、25、50、100 mg/L京尼平苷水溶液进行叶面喷施,其中0 mg/L处理为对照,即用清水喷施。每个处理重复3次。2015年3月11日收获青菜,然后测定各项生理指标。
1.2.3 青菜各项生理指标测定 取青菜固定叶片的固定部位,用叶绿素测定仪分别测定各处理青菜的叶片叶绿素含量,每个处理重复6次[10]。
在田间选取青菜固定叶片的固定部位,采用FMS2型便携式调制荧光分析仪(Hansatech公司)测定叶片叶绿素荧光参数,每个处理重复6次[11]。
过氧化物酶(POD)活性用愈创木酚法测定[12];超氧化物歧化酶(SOD)活性用NBT光化学还原法测定[12]。
青菜叶片中维生素C含量采用二氯酚靛酚滴定法测定[12];可溶性蛋白含量采用考马斯亮蓝法测定[12];可溶性糖含量采用蒽酮法测定[12];硝酸盐含量采用水杨酸法测定[12]。
1.2.4 数据处理与分析 用Excel软件处理数据,用方差分析软件对其进行显著性分析。
2 结果与分析
2.1 京尼平苷对青菜叶片叶绿素荧光参数的影响
植物的叶绿素荧光参数是指最大光合作用暗反应阶段(PSⅡ)的光能转换效率,对应于植物的光合速率,Fv/Fm值越高,光合速率越高,植物在光合作用中吸收的CO2越多,制造的碳水化合物越多,其产量就越高[11]。由图1可知,随着京尼平苷浓度增大,青菜叶片Fv/Fm值呈先增加、后降低的趋势,且京尼平苷处理组青菜叶片Fv/Fm值均大于对照。其中青菜叶片Fv/Fm值在京尼平苷浓度为25 mg/L时达到最大值,为0.865;而后随着京尼平苷浓度增大,青菜叶片Fv/Fm值开始呈现下降趋势,青菜叶片Fv/Fm值在京尼平苷浓度为100 mg/L时下降到0.859。经方差分析,10、25 mg/L 京尼平苷处理下的青菜叶片Fv/Fm值与对照差异显著(P<0.05),其他处理下的青菜叶片Fv/Fm值与对照差异不显著。说明京尼平苷处理对青菜叶片光能转化效率有一定促进作用,最适宜的京尼平苷浓度为25 mg/L。
2.2 京尼平苷对青菜叶片叶绿素含量(SPAD值)的影响
叶绿体是高等植物进行光合反应的器官,而叶绿素则是叶绿体的主要成分,叶绿素含量与植物光合反应有密切关系。在实际操作过程中,通常采用SPAD-502叶绿素仪测定叶片SPAD值,叶绿素SPAD值也已成为叶绿素相关含量的表征参数[10]。由图2可知,随着京尼平苷浓度增大,青菜叶片叶绿素含量呈先增加、后降低的趋势,且京尼平苷处理下的青菜叶片叶绿素含量均高于对照。其中青菜叶片SPAD值在京尼平苷浓度为25 mg/L时达到最高,为33.3。随着京尼平苷浓度的进一步增大,青菜叶片叶绿素含量开始呈现下降趋势,青菜叶片SPAD值在京尼平苷浓度为100 mg/L时下降到29.3。除25 mg/L京尼平苷处理与对照差异显著(P<0.05)外,其他各京尼平苷处理与对照差异均未达显著水平。说明京尼平苷处理对青菜叶片的叶绿素含量有一定促进作用,最适宜的京尼平苷浓度为25 mg/L。
2.3 京尼平苷对青菜POD活性的影响
POD、SOD能清除植物体内产生的活性氧或自由基,是植物体内最重要的保护酶,其活性是衡量植物抗逆能力的一个重要指标[13-14]。由图3可知,随着京尼平苷处理浓度增大,青菜叶片POD活性呈先降低、后增加的趋势,且京尼平苷处理下的青菜POD活性均显著低于对照(P<0.05),其中青菜POD活性在京尼平苷浓度为25 mg/L时达到最低值(26 U/g);而后随着京尼平苷浓度进一步增大,POD活性开始呈上升趋势,POD活性在京尼平苷浓度为100 mg/L时上升到33 U /g,且京尼平苷对POD活性的促进效果仍较为明显。
2.4 京尼平苷对青菜SOD活性的影响
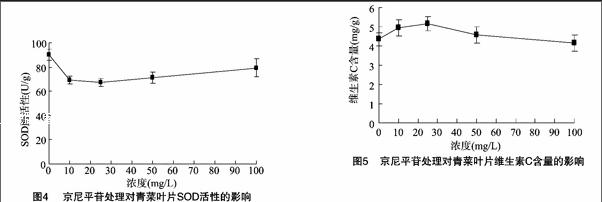
由图4可知,京尼平苷对青菜叶片SOD活性的影响类似于对POD活性的影响,随着京尼平苷处理浓度增大,青菜SOD活性呈先降低、后增加的趋势,且京尼平苷处理下的青菜SOD活性均显著低于对照(P<0.05)。其中青菜SOD活性在京尼平苷浓度为25 mg/L时达到最低值(67 U/g);而后随着京尼平苷处理浓度进一步增大,SOD活性开始呈上升趋势,在京尼平苷浓度为100 mg/L时上升到79 U/g。试验表明,京尼平苷处理使青菜叶片内自由基和活性氧减少,从而使相应的酶活性降低。
2.5 京尼平苷对青菜叶片维生素C含量的影响
维生素C是人类营养中重要的维生素之一,严重缺乏维生素C时会造成坏血病。维生素C含量也是衡量蔬菜、水果品质的重要指标之一[15]。由图5可知,随着京尼平苷处理浓度的增大,青菜维生素C含量呈先增加、后降低的趋势,且10、25、50 mg/L京尼平苷处理下青菜叶片维生素C含量均高于对照。青菜维生素C含量在京尼平苷浓度为25 mg/L时达到最大值,为5.2 mg/g。而后随着京尼平苷处理浓度进一步增大,维生素C含量开始呈下降趋势,维生素C含量在京尼平苷浓度为100 mg/L时下降到4.2 mg/g,略低于对照。除25 mg/L 京尼平苷处理下的青菜叶片维生素C含量与对照差异显著外,其他各处理与对照差异均不显著。说明京尼平苷处理对青菜维生素C含量有一定促进作用,最适宜的京尼平苷处理浓度为25 mg/L。
2.6 京尼平苷对青菜叶片可溶性蛋白含量的影响
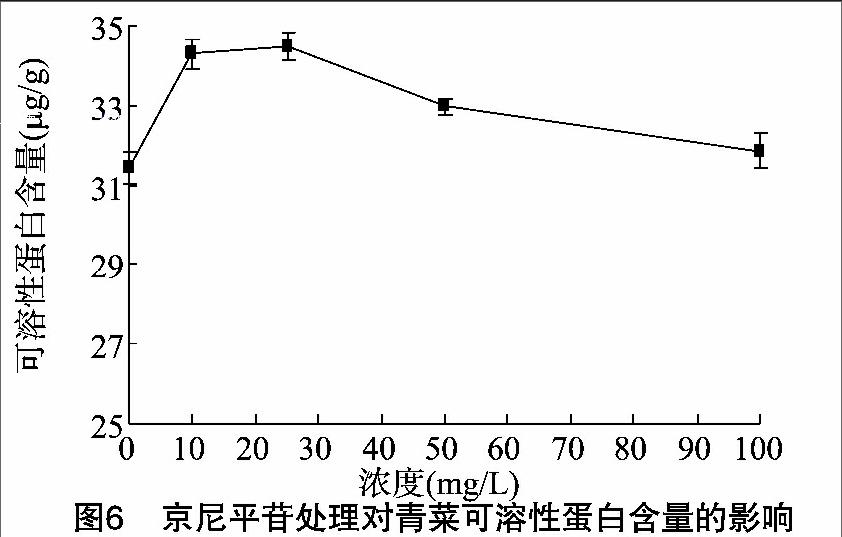
可溶性蛋白是植物体内氮素存在的主要形式,可溶性蛋白大多是参与各种代谢反应的酶类,也是植物的渗透调节物质之一,其含量是衡量植物代谢反应强弱和对外界逆境抵抗能力的一个重要指标。由图6可知,随着京尼平苷浓度增大,青菜叶片可溶性蛋白含量呈先升高、后降低的趋势,且京尼平苷处理下青菜叶片可溶性蛋白含量均高于对照。青菜叶片可溶性蛋白含量在京尼平苷浓度为25 mg/L时达到最大值,为34.5 μg/g。而后随着京尼平苷处理浓度进一步增大,叶片可溶性蛋白含量开始呈现下降趋势,叶片可溶性蛋白含量在京尼平苷浓度为100 mg/L时下降到31.9 μg/g。除100 mg/L京尼平苷处理外,各京尼平苷处理与对照差异显著。说明京尼平苷处理对青菜叶片可溶性蛋白含量的促进作用较为明显,最适宜的京尼平苷浓度为25 mg/L。
2.7 京尼平苷对青菜可溶性糖含量的影响
作物的碳素营养主要是指可溶性糖、淀粉,它们的营养作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物,如核苷酸、核酸等;其分解产物是合成其他许多有机物的原料;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了能量。由于碳水化合物具有这些重要作用,因此它们是最基本的营养物质,也是需要量最多的一类物质,具有重要的研究意义。由图7可知,京尼平苷对青菜可溶性糖含量的影响与可溶性蛋白类似,用京尼平苷处理后青菜的可溶性糖含量均比对照有所提高,随着京尼平苷处理浓度增大,青菜可溶性糖含量呈先增加、后降低的趋势,且京尼平苷处理下青菜可溶性糖含量均高于对照。青菜可溶性糖含量在京尼平苷浓度为25 mg/L时达到最大值(0.664 mg/g);而后随着京尼平苷处理浓度进一步增大,可溶性糖含量开始呈下降趋势,可溶性糖含量在京尼平苷浓度为100 mg/L时下降到 0.436 mg/g,各京尼平苷处理与对照差异达显著水平(P<005)。表明京尼平苷处理能显著提高青菜叶片可溶性糖含量,最适京尼平苷浓度为25 mg/L。
2.8 京尼平苷对青菜叶片硝酸盐含量的影响
硝酸盐含量是评价叶菜类作物品质的重要指标,硝酸盐含量过多会转化为亚硝酸,从而引发机体的相应病变,硝酸盐含量过少植物则无法进行相应的生理代谢。因此,测定植物中硝态氮含量,不仅能反映植物氮素营养状况,而且对鉴定蔬菜及其加工品质也有重要意义。由图8可知,与对照相比,京尼平苷处理下青菜叶片硝酸盐含量没有显著差异。说明京尼平苷处理对青菜叶片中硝酸盐的代谢和积累没有显著影响。
3 结论与讨论
张伯熙等研究发现,喷施京尼平苷后,小麦的功能叶剑叶的面积扩大0.3%~77.0%,剑叶鲜质量增加0.9%~176%,青叶率提高4.4%~11.2%,说明植物叶片叶绿素含量与其产量也呈正相关[8]。本研究发现,京尼平苷处理对青菜叶片叶绿素含量、叶绿素光能转化效率有一定程度的促进作用,而且京尼平苷处理对青菜叶片中可溶性糖、可溶性蛋白含量等均有不同程度的促进作用,以京尼平苷浓度为25 mg /L 时最明显。从而推测京尼平苷之所以对青菜生长有促进作用,原因之一是其促进了青菜叶片叶绿素和可溶性蛋白的合成、积累,从而促进叶片的光合作用对光能的吸收和传递,以及光合作用的酶促进反应,从而增加了光合产物的输出[15]。而且由于叶片生物量和叶绿素含量增加,单位时间内光合产物数量必然增加,而植物体内的光合产物一般是以可溶性糖形式运输[16],其向青菜叶片的输送量也会提高,最终使作物生物量增加。
本研究表明,京尼平苷处理可以降低青菜叶片中SOD、POD等抗氧化酶的活性,原因可能是京尼平苷有利于植物光合效率的提高,促进了可溶性糖、可溶性蛋白等的积累,而可溶性糖、可溶性蛋白也能参与植物体内的渗透调节,从而提高植物对逆境的适应能力,减少植物体内自由基、活性氧的产生,因而使酶活性下降。另外,维生素C、硝酸盐含量是衡量蔬菜品质的重要指标,其含量主要受氮肥施用量、种类、形态及配比等影响[17]。京尼平苷处理对青菜叶片中维生素C和硝酸盐含量的影响不明显,说明京尼平苷对青菜叶片品质指标影响不大。
由此,笔者初步判断京尼平苷主要通过促进青菜叶绿素含量、叶绿素光能转化效率,提高可溶性糖、可溶性蛋白质的积累,促进其对外界不良环境的抗性,从而有利于青菜生长和产量提高,并且不影响其品质。而且京尼平苷本身是从植物中提取的,其作为调节剂使用安全、无毒副作用。Ding等研究表明,正常剂量(24.3 mg/kg)以下京尼平苷处理完全不会引起小鼠肝毒性,即使重复给药也安全可靠[18]。但是京尼平苷对其他作物生长及产量的影响尚未见报道,所以笔者也不能确定它对其他作物的生长及产量都有促进作用。因此本研究只能说明京尼平苷对现有已知的某些作物具有增产效果,并将它应用于相应作物的种植中以提高其产量。京尼平苷对于其他作物的促进机制还有待进一步研究。
参考文献:
[1]雷 丽,宋志宏,屠鹏飞. 肉苁蓉属植物的化学成分研究进展[J]. 中草药,2003,34(5):473-476.
[2]付红蕾,梁华正,廖夫生. 栀子中京尼平苷的研究现状和应用前景[J]. 时珍国医国药,2005,16(1):54-56.
[3]张伯熙,单永年,文 林,等.一种新的生根促进剂和作物增产剂—京尼平苷[C]. 中国植物园论文集,1996:97-102.
[4]文 林,张伯熙,单永年. 九种生根剂对绒毛皂荚嫩枝扦插生根的影响[J]. 植物资源与环境,1992,1(3):63-64.
[5]熊美兰,吴鹤龄,张伯熙,等.京尼平甙及其复方对黄瓜、豆角的增产效果[J]. 江西农业学报,1997,9(1):14-17.
[6]张焕裕,张伯熙,单永年,等.京尼平甙及其复方对黄瓜、豇豆的增产效果[J]. 长江蔬菜,1998,12(12):24-26,43.
[7]张伯熙,刘金定,单永年,等.京尼平甙对棉花增产效果的研究[J]. 江西棉花,1998(4):11-14.
[8]张伯熙,单永年,叶显荣,等.京尼平甙对小麦产量影响的研究[J]. 江西农业学报,1999,11(2):2-6.
[9]钱善勤,龙 茜,陈 盼,等.京尼平苷对玉米幼苗生长的促进作用[J]. 江苏农业科学,2015,43(2):108-109,110.
[10]Uddling J,Gelang-Alfredsson J,Piikki K,et al. Evaluating the relationship between leaf chlorophyll concentration and SPAD-502 chlorophyll meter readings[J]. Photosynthesis Research,2007,91(1):37-46.
[11]Thiemann S,Kaufmann H. Determination of chlorophyll content and trophic state of lakes using field spectrometer and IRS-1C satellite data in the mecklenburg Lake District,Germany[J]. Remote Sensing of Environment,2000,73(2):227-235.
[12]苍 晶,赵会杰. 植物生理学实验教程[M].北京:高等教育出版社,2013.
[13]Dai Q L,Chen C,Feng B,et al. Effects of different NaCl concentration on the antioxidant enzymes in oilseed rape (Brassica napus L.) seedlings[J]. Plant Growth Regulation,2009,59(3):273-278.
[14]史红梅,张海燕,杨 彬,等.低温胁迫对高粱幼苗MDA含量、SOD和POD活性的影响[J].中国农学通报,2015,31(18):74-79.
[15]李冬梅,冯建英,郑 芳. 菜用甘薯茎尖不同储存期 VC和亚硝酸盐含量的变化研究[J].德州学院学报,2015,31(2):51-52,61.
[16]赵江涛,李晓峰,李 航,等.可溶性糖在高等植物代谢调节中的生理作用[J].安徽农业科学,2006,34(24):6423-6425,6427.
[17]沈明星,刘凤军,吴彤东,等.有机无机氮肥比例对小白菜产量和硝酸盐、VC含量的影响[J].江苏农业学报,2009,25(3):560-563.
[18]Ding Y,Zhang T,Tao J S,et al. Potential hepatotoxicity of geniposide,the major iridoid glycoside in dried ripe fruits of Gardenia jasminoides (Zhi-zi)[J]. Natural Product Research,2013,27(10):929-933.文 斌,张小雷,杨兆萍,等. 新疆喀纳斯国家森林公园游客的行为特征[J]. 江苏农业科学,2016,44(4):527-531.

