广西地区15种典型园林观赏植物的耐阴性及光合特性
高传友

摘要:选取广西地区15种典型园林观赏植物作为试验材料,全面系统地测定不同植物叶片的形态特征及生理指标,采用相关分析和聚类分析比较不同植物的耐阴程度。结果表明,草本植物具有最高的比叶面积,其次分别为灌木和乔木,并且三者比叶面积差异均显著。叶绿素a和b含量基本表现为草本>乔木>灌木,并且三者之间差异均显著;叶绿素a/b基本表现为灌木>乔木>草本,乔木和草本差异并不显著。光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)均表现为乔木>灌木>草本,并且三者之间差异均显著。暗呼吸速率(Rd)基本表现为草本>灌木>乔木,乔木和灌木之间差异不显著。光饱和点(LSP)和光补偿点(LCP)基本表现为灌木>乔木>草本。表观量子效率(AQY)和羧化效率(CE)基本表现为草本>乔木>灌木。气孔限制值(Ls)基本表现为草本>灌木>乔木,三者之间差异不显著(P>0.05)。不同植物的Pn与PAR(光照强度)、CO2浓度、温度变化呈一致的二次曲线关系。15种植物可分为4类,酢浆草、鸡冠花、一串红、三色堇、彩叶草等5种植物为第1类,耐阴性较强;桂花属第2类,耐阴性次之;扁桃、樟树、榕树、木棉花、栀子花等5种植物属第3类,耐阴性相对较弱;夹竹桃、九里香、丁香、紫薇等4种植物属第4类,耐阴性最弱。不同植物耐阴性总体表现为草本>乔木>灌木。
关键词:广西地区;观赏植物;光合特性;耐阴性;叶片形态;叶绿素
中图分类号:S680.1
文献标志码: A
文章编号:1002-1302(2016)04-0209-06
植物耐阴性是在弱光照条件下的一种生存适应能力,在弱光条件下,植物的光合与生理特性会发生一系列变化,这种变化关系到植物的生存、结构特征、景观效果[1-3]。培育开发耐阴植物,对于充分利用林下层或建筑物下的弱光空间资源具有重要意义。随着我国城市化进程的加快,大量城市绿地处于建筑物包围之中,观赏性植物也长期生活在低光照环境中,研究观赏植物的耐阴性对于城市绿化极为重要[4-5]。目前,关于植物耐阴性的报道很多,但多以森林植物,尤其是热带雨林植物作为主要研究对象[6-7]。20世纪80年代以来,我国陆续有一些关于观赏植物耐阴性的报道,但对于广西观赏植物耐阴性研究却甚少报道[8-9]。本研究在对广西南宁市地理环境及森林公园植物绿化现状进行全面调查的基础上,测定石门森林公园15种观赏植物的光合生理特性及叶片形态结构特征,并进行相关分析,对植物的耐阴性进行分类,旨在为耐阴性植物的推广应用提供参考。
1 材料与方法
1.1 研究区概况
南宁市属湿润的南亚热带季风气候,阳光充足,雨量充沛,霜少无雪,春秋两季气候温和,夏季炎热多雨,夏长冬短,多年平均日照时数为1 827 h,年平均气温21.6 ℃,极端最高温度40.4 ℃,极端最低温度-2.4 ℃,1月最冷,平均温度12.8 ℃,7、8月最热,平均温度28.2 ℃,近50年平均降水量1 304 mm左右,多集中在夏季(6—8月),占全年降水量的52.3%,土壤类型较多,分布有棕壤土、红黏土、褐土、潮褐土、潮土等,全年无霜期高达345~360 d。南宁市观赏植物类型各有特色。为减小因不同的小生境而产生不同变化所引起的误差,使试验数据更加精确,特将试验样地确定为所有试验材料都具有且相对比较集中的南宁市石门森林公园。2014年7月,选取广西正在推广的园林植物共15种(表1),其中乔木、灌木、草本植物各5种,每种5株并标记做长期监测。
1.2 方法
2014年7月和2015年7月(晴天无风)分别进行样品采集和试验测定工作。采用CIRAS-2便携式光合仪(英国 PP-Systems 公司),每天09:30—11:30每隔1 h测量1次,每种植物选择3株进行测定,每株重复测定3次,取其平均值作为净光合速率,每株选取3年生的成熟叶片(从幼苗顶部数第3~6张完全展开的成熟叶),轮流测定以消除测定时间上的误差。红光光源设定为1 000 μmol/(m2·s),温度25~30 ℃,CO2流量为300~500 μmol/mol,温度变化范围为19.1~32.4 ℃,辐射强度(PAR)为103~1 115 μmol/(m2·s),空气相对湿度为17.6%~39.7%,仪器同时记录净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)、环境CO2浓度(Ca)、光照强度(PAR),其中PAR、CO2浓度以外界条件为准。气孔限制值(Ls)计算公式为:Ls=1-Ci/Ca。与此同时进行光合-光强响应特性的测定,CO2摩尔分数控制为 350 μmol/mol,温度设定25 ℃左右,湿度为大气湿度的95%。设定光照度梯度为1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、0 μmol/(m2·s),每个光照度下5 min后测定Pn值。根据Pn-PAR回归方程求出不同处理的光补偿点(LCP)、光饱合点(LSP)。根据低于200 μmol/(m2·s)光照度下测定的叶片PFD-Pn曲线计算求得暗呼吸速率(Rd)、表观量子效率(AQY)。根据CO2 250 μmol/mol下测定的叶片CO2-Pn曲线计算求得CO2羧化效率(CE)。
每种植物选取3株,采样时戴上聚乙烯塑料手套,分别从东、西、南、北均匀采集成熟的叶片(足够多)。采用游标卡尺测定供试植物叶片厚度。取保存备用的10张新鲜叶片,用Sartorius电子天平测定叶片鲜质量,再置于烘箱70 ℃烘干至恒质量,采用数字扫描仪和图像处理技术测定叶面积(不包括叶柄),比叶面积(SLA)=单位叶面积/单位面积。另取植物叶片样品测定各项生理指标,每项指标重复测定3次,结果取平均值和标准差。将新鲜叶片除去叶脉研磨混合,以80%丙酮溶液浸提测定叶绿素a、b含量[10]。
1.3 数据分析
用SPSS统计软件对试验数据进行单因素方差分析(ANOVA),采用最小显著差法(LSD)对植物进行种间多重比较并进行相关分析、聚类分析。
2 结果与分析
2.1 植物叶片的形态特征
由表2可知,不同乔木叶片厚度由大到小依次表现为扁桃>樟树>木棉花>桂花>榕树。在灌木叶片厚度方面,依次表现为栀子花>九里香>夹竹桃>丁香>紫薇。在草本叶片厚度方面,依次表现为彩叶草>三色堇>一串红>鸡冠花>酢浆草。植物生活型的叶片厚度依次表现为乔木>灌木>草本,但三者之间差异并不显著。乔木叶面积从大到小依次表现为樟树>桂花>扁桃>榕树>木棉花。灌木叶面积从大到小依次表现为丁香>栀子花>九里香>夹竹桃>紫薇。草本叶面积从大到小依次表现为彩叶草>鸡冠花>一串红>酢浆草>三色堇。植物生活型的叶面积基本表现为灌木>草本>乔木,灌木与本草之间差异并不显著,二者显著高于乔木。比叶面积是研究叶片形态特征较具代表性的指标。乔木比叶面积由大到小依次为木棉花>桂花>扁桃>樟树>榕树。灌木比叶面积由大到小依次为栀子花>夹竹桃>丁香>紫薇>九里香。草本比叶面积由大到小依次为酢浆草>一串红>鸡冠花>三色堇>彩叶草。植物生活型的叶面积基本表现为草本>灌木>乔木,三者之间差异均显著。
2.2 植物叶片叶绿素含量
由表3可知,15种植物的叶绿素a含量为1.96~3.17 mg/g,叶绿素b含量为0.56~1.52 mg/g,叶绿素a/叶绿素b为 1.83~4.80,差异较大。乔木叶绿素a含量由高到低依次表现为桂花>樟树>扁桃>木棉花>榕树。灌木叶绿素a含量由高到低依次表现为栀子花>紫薇>九里香>丁香>夹竹桃。草本叶绿素a含量由高到低依次表现为鸡冠花>彩叶草>三色堇>一串红>酢浆草。植物生活型的叶绿素a含量基本表现为草本>乔木>灌木,并且三者之间差异均显著。乔木叶绿素b含量由高到低依次表现为木棉花>桂花>扁桃>榕树>樟树。灌木叶绿素b含量由高到低依次为丁香>夹竹桃>九里香>紫薇>栀子花。草本叶绿素b含量由高到低依次为鸡冠花>三色堇>一串红>酢浆草>彩叶草。植物生活型的叶绿素b含量由高到低依次为草本>乔木>灌木,并且三者之间差异均显著。乔木叶绿素a/b由高到低依次为樟树>桂花>扁桃>榕树>木棉花。灌木叶绿素a/b由高到低依次为栀子花>紫薇>九里香>夹竹桃>丁香。草本叶绿素a/b由高到低依次为彩叶草>酢浆草>三色堇>一串红>鸡冠花。植物生活型的叶绿素a/b基本表现为灌木>乔木>草本,乔木和草本差异不显著,二者显著低于灌木。
2.3 植物叶片的光合参数
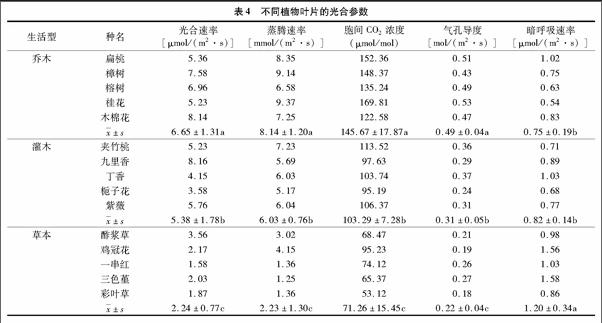
由表4可知,15种植物叶片的光合速率范围为1.58~8.16 μmol/(m2·s),蒸腾速率范围为1.25~9.37 mmol/(m2·s),胞间CO2浓度范围为53.12~169.81 μmol/mol,气孔导度范围为0.18~0.53 mol/(m2·s),暗呼吸速率范围为0.54~1.58 μmol/(m2·s)。乔木光合速率由高到低依次为木棉花>樟树>榕树>扁桃>桂花。灌木光合速率由高到低依次为九里香>紫薇>夹竹桃>丁香>栀子花。草本光合速率由高到低依次为酢浆草>鸡冠花>三色堇>彩叶草>一串红。光合速率基本表现为乔木>灌木>草本,并且三者之间差异均显著。乔木蒸腾速率由高到低依次为桂花>樟树>扁桃>木棉花>榕树。灌木蒸腾速率由高到低依次为夹竹桃>紫薇>丁香>九里香>栀子花。草本蒸腾速率由高到低依次为鸡冠花>酢浆草>彩叶草=一串红>三色堇。植物生活型的蒸腾速率基本表现为乔木>灌木>草本,并且三者之间差异均显著。乔木胞间CO2浓度由高到低依次为桂花>扁桃>樟树>榕树>木棉花。灌木胞间CO2浓度由高到低依次为夹竹桃>紫薇>丁香>九里香>栀子花。草本胞间CO2浓度由高到低依次为鸡冠花>一串红>酢浆草>三色堇>彩叶草。植物生活型的胞间CO2浓度基本表现为乔木>灌木>草本,并且三者之间差异均显著。乔木气孔导度由高到低依次为桂花>扁桃>榕树>木棉花>樟树。灌木气孔导度由高到低依次为丁香>夹竹桃>紫薇>九里香>栀子花。草本气孔导度由高到低依次为三色堇>一串红>酢浆草>鸡冠花>彩叶草。植物生活型的气孔导度基本表现为乔木>灌木>草本,并且三者之间差异均显著。乔木暗呼吸速率由高到低依次为扁桃>木棉花>樟树>榕树>桂花。灌木暗呼吸速率由高到低依次为丁香>九里香>紫薇>夹竹桃>栀子花。草本暗呼吸速率由高到低依次为三色堇>鸡冠花>一串红>酢浆草>彩叶草。植物生活型的暗呼吸速率基本表现为草本>灌木>乔木,乔木和灌木之间差异不显著,二者显著低于草本。
由表5可知,15种植物叶片的光饱和点范围为598.2~1 023.4 μmol/(m2·s),光补偿点范围为71.5~93.2 μmol/(m2·s),表观量子效率范围为168.1~236.9,羧化效率范围为41.9~54.1,气孔限制值范围为0.71~0.89。乔木光饱和点由大到小依次表现为桂花>扁桃>榕树>樟树>木棉花。灌木光饱和点由大到小依次表现为丁香>栀子花>夹竹桃>紫薇>九里香。草本光饱和点由大到小依次表现为彩叶草>酢浆草>三色堇>鸡冠花>一串红。植物生活型的光饱和点基本表现为灌木>乔木>草本,三者之间差异均显著。乔木光补偿点由大到小依次表现为桂花>樟树>榕树>扁桃>木棉花。灌木光补偿点由大到小依次表现为九里香>紫薇>栀子花>夹竹桃>丁香。草本光补偿点由大到小依次表现为鸡冠花>彩叶草>酢浆草>一串红>三色堇。植物生活型的光补偿点基本表现为灌木>乔木>草本,三者之间差异均显著。乔木表观量子效率由大到小依次为扁桃>樟树>榕树>桂花>木棉花。灌木表观量子效率由大到小依次为九里香>栀子花>夹竹桃>紫薇>丁香。草本表观量子效率由大到小依次为一串红>醡浆草>鸡冠花>彩叶草>三色堇。植物生活型的表观量子效率由大到小依次为草本>乔木>灌木,并且三者之间差异显著。乔木羧化效率由大到小依次为桂花>榕树>扁桃>樟树>木棉花;灌木羧化效率由大到小依次为栀子花>九里香>紫薇>夹竹桃>丁香;草本羧化效率由大到小依次为鸡冠花>酢浆草>彩叶草>一串红>三色堇;植物生活型的羧化效率基本表现为草本>乔木>灌木,乔木和草本之间差异不显著,二者显著高于灌木。乔木气孔限制值由大到小依次为桂花>樟树>榕树>扁桃>木棉花。灌木气孔限制值由大到小依次为栀子花>九里香>丁香>紫薇>夹竹桃。草本气孔限制值由大到小依次为一串红>彩叶草>酢浆草>鸡冠花>三色堇。植物生活型的气孔限制值由大到小为草本>灌木>乔木,三者之间差异不显著。
2.4 植物叶片光合特性与生理响应
通过SPSS最佳曲线拟合(分别拟合光合速率Pn与PAR、CO2浓度、温度之间的曲线关系),筛选出R2最大(最佳拟合度及校准以后的最大R2)和P值(显著性)最小的曲线组合,并在此基础上检验其F值和差异显著性(P<0.001)。由表6可知,植物的Pn-PAR变化呈一致的二次曲线关系,乔木Pn与PAR的二次曲线关系为:y=-1×10-4x2+0.956x-0.198(R2=0.735,P=0.000,F=35.26),与CO2浓度的二次曲线关系为:y=-2×10-3x2-0.489x+3.256(R2=0.816,P=0.000,F=43.18),与温度的二次曲线关系为:y=-0.568x2-2.157x+1.951(R2=0.937,P=0.000,F=37.59);灌木Pn与PAR的二次曲线关系为:y=-2×10-5x2+35.264x-5.238(R2=0.896,P=0.000,F=41.25),与CO2浓度的二次曲线关系为:y=1.236x2-0.238x+4.132(R2=0.913,P=0.000,F=39.74),与温度的二次曲线关系为:y=-0.086 1x2+3.587x-30.564(R2=0.899,P=0.000,F=42.05);草本Pn与PAR的二次曲线关系为:y=-4×10-3x2-0.237x+15.269(R2=0.956,P=0.000,F=46.29),与CO2浓度的二次曲线关系为:y=-1×10-4x2-2.891x+3.207(R2=0.923,P=0.000,F=43.15),与温度的二次曲线关系为:y=-3×10-5x2+15.238x-2.059(R2=0.874,P=0.000,F=38.76)。
2.5 植物叶片光合特征参数的相关分析及其耐阴性聚类分析
由表7可知,叶绿素a与LSP、LCP、AQY、CE呈极显著正相关,与叶绿素b、SLA呈显著正相关,与Pn呈显著负相关。叶绿素b与Rd、LSP、LCP、AQY、CE呈极显著正相关,与SLA呈显著正相关,与Pn呈显著负相关。SLA与LSP、AQY、CE呈显著正相关,与Ci、Gs、Tr呈显著负相关,与Pn呈极显著负相关。Pn与Ci、Gs、Tr呈极显著正相关,与LSP呈极显著负相关,与AQY呈显著负相关。Ci与Gs、Tr呈极显著正相关,与Rr呈极显著负相关。Gs与Tr呈极显著正相关,与Rd呈显著负相关。Tr与Rd呈显著负相关。Rd与AQY呈显著正相关。LSP与LCP、AQY、CE呈极显著正相关。LCP与AQY、CE呈极显著正相关。AQY与CE呈极显著正相关。
在相关分析的基础上,再对各种测定指标进行聚类分析,图1左是利用各种指标对15种植物耐阴性进行聚类分析,图1右是对各种光合参数进行的聚类分析,结果表明,当聚合距离小于5时(图1右),各测定指标可分为3类:第1类包括叶绿素a、叶绿素b、Rd、Ls、Tr、Pn、Ci,第2类包括LSA、AQY,第3类包括LSP,叶片形态结构特征的测定指标基本聚在同一类。影响植物耐阴性的因素很多,从不同因素出发得到的结果可能不同。为综合分析15种植物耐阴性的差异,根据上述相关和聚类分析的结果,把与植物耐阴性关系密切的各种指标作为变量,对15种植物进行聚类分析,结果表明(图1左),当聚合距离为15时,15种植物可分为4类:酢浆草、鸡冠花、一串红、三色堇、彩叶草等5种植物为第1类,耐阴性较强;桂花属第2类,耐阴性次之;扁桃、樟树、榕树、木棉花、栀子花等5种植物属第3类,耐阴性相对较弱;夹竹桃、九里香、丁香、紫薇等4种植物属第4类,耐阴性最弱。综合分析可知,耐阴性总体表现为草本>乔木>灌木。
3 结论与讨论
在植物叶片形态特征中,厚度、叶面积、比叶面积是判断植物耐阴性的重要指标[10]。Reich等对北美和南美多种生态类型植物的研究结果表明,非禾本草本植物的SLA最高,灌木、乔木较低,针叶树最低[11]。本研究结果表明,草本植物具有最高的SLA,其次分别为灌木、乔木,并且三者SLA差异均显著,不同植物生理代谢、形态建成发生变化,导致SLA呈现出不同的变化规律。植物SLA对遮阴敏感,生长在遮光环境下的植物SLA明显升高,但也有不同结果,例如,Malavasi等发现树种Schyzolobium parahybum的SLA随光照的增强而升高,而另一种树种Hymenaes tilbocarpa的SLA随光照的增强而降低,说明不同植物的SLA对光照的响应并不一致[12]。通常认为低光辐射环境下具较高的SLA使植物能更有效地吸收光能,是植物对遮阴响应的主要生长参数。因此,与阳生性植物相比,耐阴植物具有叶片薄、叶面积大、比叶面积高等特点。本研究结果表明,草本植物的耐阴性较强,乔木、灌木的耐阴性相对较弱。
叶绿素是植物光合作用中最重要的色素,由于叶绿素a、叶绿素b在理化性质、吸收光谱等方面存在差异,能反映植物的光合特性,是衡量植物耐阴性的重要指标之一。通常情况下,耐阴性强的植物叶绿素含量较高,叶绿素a/叶绿素b较低;阴生植物的叶绿素b含量较阳生性植物高,叶绿素a/叶绿素b较小,因此阴生植物能充分利用蓝紫光,能在遮阴的环境中生长[13-14]。Lichtenthaler等分别对欧洲水青冈(Fagussylvatica)、洋常春藤(Hedera helix)2种植物的阴生叶、阳生叶进行试验,结果表明,阳生叶的叶绿素a/叶绿素b在3以上,阴生叶则在3或更低[15]。根据这一观点,本研究供试的15种植物中,绝大多数植物属阴生种类,适合在较阴蔽的生境中生长,显示了一定的耐阴性,樟树(3.28)、栀子花(4.80)、紫薇(3.54)、彩叶草(3.14)被界定为阳生植物,不同植物对光环境的敏感度不同,因此,研究叶绿素含量的种间和种内变化特征是下一步的重点。
光补偿点(LCP)、光饱和点(LSP)、最大净光合速率(Pn)是反映植物耐阴性的主要指标,光补偿点、表观量子效率是体现植物在弱光条件下光合作用能力的重要指标。一般来说,植物的光补偿点越低,表观量子效率越大,耐阴性越强;阳生性植物比阴生植物具有较高的光饱和点和光补偿点;但也有一些植物的光补偿点较低而光饱和点相对较高,这类植物既具有较强的耐阴性又能适应阳光较充足的环境[16-18]。本研究结果表明,光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)均表现为乔木>灌木>草本,并且三者之间差异均显著;暗呼吸速率(Rd)表现为草本>灌木>乔木,乔木和灌木之间差异不显著;光饱和点(LSP)和光补偿点(LCP)表现为灌木>乔木>草本,三者之间差异均显著。表观量子效率(AQY)和羧化效率(CE)基本表现为草本>乔木>灌木;气孔限制值(Ls)基本表现为草本>灌木>乔木,三者之间差异不显著。综合比较可知,乔木植物叶片的光能利用效率最高,表明乔木叶片对低CO2浓度、低光强利用率最强,具有较强的再生速率,草本植物的耐阴性更强。通过SPSS最佳曲线拟合(分别拟合光合速率Pn与PAR、CO2浓度、温度之间的曲线关系),不同植物的Pn与PAR、CO2浓度、温度变化呈一致的二次曲线关系,由曲线计算可知,不同植物光合作用最适温度在20~25 ℃之间,这与前人关于园林树种的研究结论[16-17]一致。本研究还发现,虽然不同植物光合适温相差不大,但在最适温时的光合速率却相差较大,说明温度的变化对植物光合作用有较大影响,不同植物光合作用对温度的响应不同,这可能与物种的温度适应性(原产地的气候、环境)有关。Pearson相关性分析表明,植物光合特性由多种因素共同决定,这些因素之间也会相互影响,其中Gs的相关系数较其他因子的相关系数绝对值大,这也间接说明了影响不同植物光合特性的主要因子仍然是生理指标,这与光合特性和生理特性的变化趋势相吻合。本研究中不同植物光合生理指标属于短期的测定结果,受外界环境的影响较大,后续还需要进行长期的野外监测来验证。
聚类分析是统计学分类的主要方法,其中层次聚类分析是根据观察值或变量之间的亲疏程度,将最相似的对象结合,以逐次聚合的方式将所有样本都聚成一类[19]。本研究在原来聚类分析的基础上,增加叶片形态方面指标作为分析变量,对15种植物的耐阴性分类进行判别分析,所判定的结果与相关性分析及常规分类的结果基本一致,表明本研究对15种植物耐阴性分类结果具有较高的可信度,本研究所得的初步结论将通过后续试验加以论证。同时通过对供试植物的主要生理指标进行综合分析,结果表明:15种植物可分为4类,酢浆草、鸡冠花、一串红、三色堇、彩叶草等5种植物为第1类,耐阴性较强;桂花属第2类,耐阴性次之;扁桃、樟树、榕树、木棉花、栀子花等5种植物属第3类,耐阴性相对较弱;夹竹桃、九里香、丁香、紫薇等4种植物属第4类,耐阴性最弱;耐阴性总体表现为草本>乔木>灌木。
参考文献:
[1]Gommers C M,Visser E W,St Onge K R,et al. Shade tolerance:when growing tall is not an option[J]. Trends in Plant Science,2013,18(2):65-71.
[2]Poorter L,Lianes E,Moreno-de Las Heras M,et al. Architecture of Iberian canopy tree species in relation to wood density,shade tolerance and climate[J]. Plant Ecology,2012,213(5):707-722.
[3]Dent D H,Dewalt S J,Denslow J S. Secondary forests of central Panama increase in similarity to old-growth forest over time in shade tolerance but not species composition[J]. Journal of Vegetation Science,2013,24(3):530-542.
[4]任建武,白伟岚,姚洪军. 野生园林植物筛选技术方法研究[J]. 中国园林,2012,28(2):18-22.
[5]陈红锋,周劲松,邢福武. 广州园林植物资源调查及其评价[J]. 中国园林,2012,28(2):11-14.
[6]Walters M B,Reich P B. Are shade tolerance,survival,and growth linked?Low light and nitrogen effects on hardwood seedlings[J]. Ecology,1996,77(3):841-853.
[7]Martin P H,Canham C D,Marks P L. Why forests appear resistant to exotic plant invasions:intentional introductions,stand dynamics,and the role of shade tolerance[J]. Frontiers in Ecology and the Environment,2009,7(3):142-149.
[8]白伟岚,任建武,苏雪痕. 八种植物耐阴性比较研究[J]. 北京林业大学学报,1999,21(3):46-52.
[9]苏雪痕. 园林植物耐阴性及其配置[J]. 北京林学院学报,1981,3(2):63-70.
[10] 上海植物生理学会.植物生理学实验手册[M]. 上海:上海科学技术出版社,1985.
[11]Reich P B,Walters M B,Ellsworth D S,et al. Relationships of leaf dark respiration to leaf nitrogen,specific leaf area and leaf life-span:a test across biomes and functional groups[J]. Oecologia,1998,114(4):471-482.
[12]Malavasi U C,Malavasi M M. Leaf characteristics and chlorophy Ⅱ concentration of Schyzolobium parahybum and Hymenaea stilbocarpa seedlings grown in different light regimes[J]. Tree Physiology,2001,21(10):701-703.
[13]Krause G H,Weis E. ChlorophyⅡ fluorescence and photosynthesis:the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1991,42(1):313-349.
[14]Green B R,Durnford D G. The chlorophyⅡ-carotenoid proteins of oxygenic photosynthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1996,47(1):685-714.
[15]Lichtenthaler H K,Buschmann C,Dll M,et al. Photosynthetic activity,chloroplast ultrastructure,and leaf characteristics of high-light and low-light plants and of sun and shade leaves[J]. Photosynthesis Research,1981,2(2):115-141.
[16]林树燕,张庆峰,陈其旭. 10种园林植物的耐阴性[J]. 东北林业大学学报,2007,35(7):32-34.
[17]曾小平,赵 平,蔡锡安,等. 25种南亚热带植物耐阴性的初步研究[J]. 北京林业大学学报,2006,28(4):88-95.
[18]付 景,李潮海,赵久然,等. 玉米品种耐阴性指标的筛选与评价[J]. 应用生态学报,2009,20(11):2705-2709.
[19]鲍 艳,胡振琪,柏 玉,等. 主成分聚类分析在土地利用生态安全评价中的应用[J]. 农业工程学报,2006,22(8):87-90.何辰宇,李蓓蓓,杨 菲. 高温干旱对茶叶生产的影响及应对措施[J]. 江苏农业科学,2016,44(4):215-217.

