油茶籽壳总黄酮对黄曲霉毒素B1致肝细胞氧化应激的保护作用及机制
汪秀+李菲+黄利辉

摘要:研究油茶籽壳总黄酮(CSF)对黄曲霉毒素B1(AFB1)诱导的人肝细胞(HL-7702)氧化应激的保护作用及其机制。以20 μg/mL AFB1处理2 d建立HL-7702细胞AFB1损伤模型;与AFB1损伤组比较,25、50、100 μg/mL CSF预处理HL-7702细胞1 d,细胞存活率显著上升(P<0.05),细胞内活性氧(ROS)和脂质过氧化物丙二醛(MDA)水平显著下降(P<0.05),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性显著升高(P<005),核因子E2相关因子2(Nrf2)及其下游谷胱甘肽S转移酶A2(GSTA2)的mRNA和蛋白表达水平均显著升高(P<0.05),核转录因子κB(NF-κB)及下游炎症因子(TNF-α、IL-6、IL-1β)的mRNA表达显著下降(P<0.05)。因此,油茶籽壳总黄酮通过上调Nrf2,提高Nfr2下游抗氧化酶系的活性,阻断了由ROS引起的脂质过氧化链式反应,同时下调NF-κB,减少炎症因子相关基因的表达,从而拮抗AFB1对肝细胞的毒性损伤,提高了肝细胞存活率。
关键词:油茶籽壳;总黄酮;黄曲霉毒素B1;氧化应激;细胞保护
中图分类号: R284.1
文献标志码: A
文章编号:1002-1302(2016)04-0308-04
由黄曲霉、寄生曲霉产生的黄曲霉毒素B1(AFB1)经常被发现于发霉变质的饲料、食物中,被认为是中毒性最强、危害最大的一种霉菌毒素[1]。生物体摄入AFB1后,在不同器官诱发产生细胞内活性氧(ROS),破坏机体的氧化-抗氧化平衡,从而使脂质过氧化物丙二醛(MDA)积累,对脂类、蛋白质、DNA等生物大分子造成损伤[2],由此形成的氧化应激对肝脏的损伤是最大的[3]。研究表明,植物黄酮类物质能吸收包括AFB1在内的多种霉菌毒素,减轻其对动物体的损伤,保护肝脏,从而改善牲畜健康,提高畜产品产量。人参皂苷[4]、槲皮苷[5]、柚皮苷[6]、藤黄双黄酮[7]等都被发现具有黄曲霉毒素细胞保护作用。然而,至今仍然没有一种商业化的AFB1生物保护剂,主要是由于上述具有细胞保护作用的化合物来源十分有限,价格昂贵。因此,寻找易获得、廉价的此类化合物来源(如农副产品)十分必要。我国是世界上油茶籽产量最大的国家,油茶籽壳是油茶籽榨油前除去的种皮,大量的废弃茶籽壳一般被丢弃或用作燃料,既污染环境又浪费资源。研究表明,油茶籽壳中含有丰富的黄酮类物质[8],关于这类黄酮类物质提取工艺的研究已经很多,但对其功能研究目前仅局限在证明其具有较好的体外抗氧化性能[9-10]。因此,笔者推测油茶籽壳中的黄酮类物质所具有的抗氧化能力可以减轻AFB1对细胞的毒性作用。本研究采用AFB1最易损伤的正常肝细胞HL-7702细胞为材料,建立AFB1肝细胞损伤模型,探讨油茶籽壳中黄酮类物质对AFB1肝细胞损伤的保护作用及其可能机制,旨在为油茶籽壳的综合高效利用和天然AFB1生物保护剂开发提供理论依据。
1 材料与方法
1.1 油茶籽壳总黄酮(CSF)样品制备
油茶籽购自浙江省嘉兴市农贸市场,剥壳后自然晒干即得油茶籽壳,粉碎后备用。取5 g油茶籽壳粉碎样品,依照姜天甲等[9]和高扬等[11]的方法,按1 g ∶30 mL比例加入60%乙醇溶液,浸泡30 min,40 ℃超声波提取45 min,滤液减压浓缩后加蒸馏水定容至50 mL,加等体积石油醚充分振荡,静置分层后分离收集,经40 ℃真空减压旋转蒸发后,制备得油茶籽壳总黄酮并用DMSO配成20 mg/mL储备液,-20 ℃保存。
1.2 材料
人正常肝细胞系HL-7702购于中国科学院上海细胞库;AFB1、DMSO、MTT均为Sigma公司产品,AFB1溶解于DMSO 中,配成1 mg/mL母液;RPMI-1640培养基、胰酶、青链霉素均为HyClone公司产品;胎牛血清购于四季青公司;MDA试剂盒,SOD、CAT、GSH-Px测定试剂盒购于南京建成工程研究所;ROS检测试剂盒、BCA蛋白浓度测定试剂盒、PCR试剂盒、TRIzol、脱脂牛奶(BSA)均为碧云天公司产品;PrimeScript RT反转录试剂盒购于TaKaRa公司;小鼠抗人Nrf2、GSTA2、β-actin单克隆抗体均为Santa Cruz公司产品;HRP标记的山羊抗小鼠IgG购于武汉博士德生物公司;PCR引物均合成自上海博尚生物公司。
1.3 方法
1.3.1 细胞培养 人HL-7702正常肝细胞以RPMI-1640培养基(含10%胎牛血清、1%双抗)于37 ℃、5%CO2培养。
1.3.2 AFB1致HL-7702细胞损伤模型建立 采用MTT法检测HL-7702细胞增殖抑制率,试验分为对照组和AFB1组。HL-7702细胞按5 000个细胞/孔接入96孔板中,每组设5个复孔,过夜培养待细胞贴壁后加化合物。对照组每孔加入含1%DMSO的完全培养基100 μL,AFB1组每孔加入含5、10、15、20、25、30、35、40 μg/mL AFB1的完全培养基100 μL。各组分别培养0.5、1、2 d后弃去孔内培养基,并加入100 μL含 MTT溶液(终浓度0.5 mg/mL)的无血清培养基,避光37 ℃孵育4 h,弃上清液,每孔加100 μL DMSO,振荡使结晶物充分溶解,570 nm下测定各孔吸光度,细胞抑制率=(D对照-D试验)/ D对照×100%。根据MTT结果,选择AFB1的最佳浓度进行后续试验。
1.3.3 油茶籽壳总黄酮对AFB1致细胞损伤的预保护试验 细胞接板和MMT检测方法同“1.3.2”节,试验分组如下:设正常对照组、AFB1模型组和油茶籽壳总黄酮低剂量、中剂量、高剂量保护组。正常对照组:细胞先用含1%DMSO(CSF的溶剂)的完全培养基培养1 d,换液后再加入含1%DMSO(AFB1的溶剂)的完全培养基继续培养2 d;AFB1模型组:细胞先用含1%DMSO(CSF的溶剂)的完全培养基培养1 d,换液后加入含有最佳损伤浓度AFB1(20 μg/mL)的完全培养基继续培养2 d;CSF保护组:细胞先分别与含25、50、100 μg/mL CSF的完全培养基预孵1 d,换液后加入含有最佳损伤浓度AFB1(20 g/mL)的完全培养基继续培养2 d。3 d培养结束后检测细胞存活率,细胞存活率计算公式如下:
细胞存活率=D试验/ D对照×100%。(1)
1.3.4 HL-7702细胞内MDA生成量的检测 采用 “1.3.3”节所述方法处理HL-7702细胞,用硫代巴比妥酸(TBA)法测定MDA含量[12]。将各组细胞裂解后按照试剂盒说明书操作步骤进行操作,在532 nm处测定各孔吸光度,采用BCA试剂盒说明书规定的方法测定总蛋白浓度。
1.3.5 HL-7702细胞内ROS水平的检测 采用 “1.3.3”节所述方法处理HL-7702细胞,采用二氯荧光素双乙酸(DCFH-DA)法测定细胞内ROS水平。将各组细胞裂解后按照试剂盒说明书操作步骤进行,细胞裂解液与10 nmol/L DCFH-DA 37 ℃孵育30 min后,PBS洗细胞2次。荧光强度用荧光酶标仪以激发波长485 nm 和发射波长535 nm检测。ROS相对含量计算公式如下:
ROS相对含量=处理组荧光强度/对照组荧光强度×100%。(2)
1.3.6 HL-7702细胞内抗氧化酶系含量测定 采用 “1.3.3”节所述方法处理HL-7702细胞,收集各组细胞,用冰PBS洗,然后在冰上用超声破碎机200 V、30 s,间隔5 s,3次破碎细胞,取100 L细胞裂解液,按照试剂盒说明书操作步骤测定SOD、CAT、GSH-Px酶活性。酶活性以酶比活力单位(U/mg)表示,并用细胞总蛋白质含量作校正。
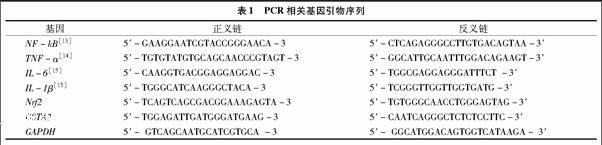
1.3.7 RT-PCR检测相关基因的改变 采用 “1.3.3”节所述方法处理HL-7702细胞,收集各组细胞,提取细胞总RNA,采用PrimeScript RT反转录试剂盒并进行逆转录,得到各组细胞cDNA。PCR扩增条件均为:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,72 ℃ 8 min;循环数30。最后PCR产物在1%琼脂糖凝胶中电泳分离,检测基因引物见表1,GAPDH为内参。
1.3.8 Western blot检测蛋白表达的改变 采用 “1.3.3”节所述方法处理HL-7702细胞,收集细胞,用PBS洗涤3次,加入裂解液,冰上充分裂解1 h,总蛋白样品进行SDS-PAGE分离,转移到硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,分别用稀释的Nrf2、GSTA2和标准内参β-actin一抗4 ℃孵育过夜,洗膜后加稀释的二抗室温孵育2 h,加ECL发光试剂,显影、定影。
1.3.9 统计学分析 所有试验均重复3次,数据采用x±s表示,采用SPSS 18.0软件统计分析,采用Duncans检验多重比较。
2 结果与分析
2.1 HL-7702细胞AFB1受损模型的建立
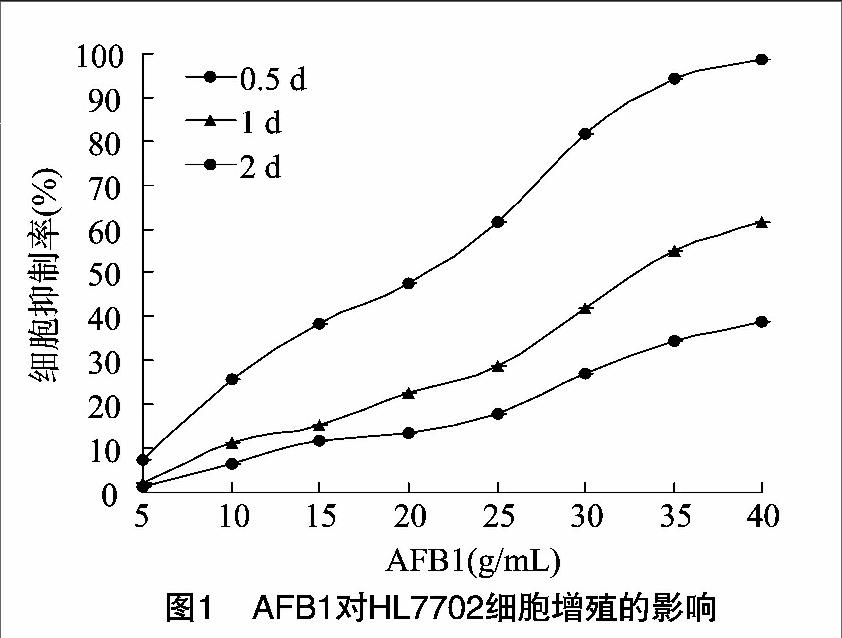
由图1可见,AFB1对HL-7702的细胞毒性呈现出剂量和时间依赖性。0.5、1 d组各浓度虽也可以明显抑制细胞增殖,但彼此之间差异不大,2 d组各浓度对应的细胞抑制率之间差异明显,且浓度与抑制率之间相关性好(r2=0.99),因此以2 d组数据确定AFB1的IC50浓度为20 μg/mL,以 此 作 为AFB1对HL-7702细胞损伤模型的最佳浓度。
2.2 油茶籽壳总黄酮对AFB1损伤的HL-7702细胞存活率的影响
将未经油茶籽壳总黄酮预处理的HL-7702细胞暴露于20 μg/mL AFB1 2 d,与对照组相比,细胞存活率明显下降(表2)。经25、50、100 μg/mL油茶籽壳总黄酮预保护过的HL-7702细胞再接受相同样剂量AFB1暴露相同时间后,细胞存活率较AFB1损伤组明显提高,且其保护效果呈显著的剂量效应关系。油茶籽壳总黄酮对HL-7702细胞进行预处理可以有效抑制AFB1造成的细胞增殖抑制。
2.3 HL-7702细胞内ROS和MDA水平的改变
由表3可知,与对照组相比,20 μg/mL AFB1作用HL-7702细胞2 d,显著增加了HL-7702细胞内ROS活性和MDA含量,说明AFB1造成了HL-7702细胞的氧化损伤。经25、50、100 μg/mL油茶籽壳总黄酮预处理后,受损细胞内的ROS活性逐渐降低,与AFB1损伤组相比差异显著,MDA含量也随着油茶籽壳总黄酮浓度升高而显著下降。
2.4 HL-7702细胞内抗氧化酶系的改变
由表4可见,与对照组相比,20 μg/mL AFB1作用HL-7702细胞2 d,显著降低细胞内抗氧化酶SOD、CAT、GSH-Px活性,说明细胞内源性抗氧化酶系统功能失调。经25、50、100 μg/mL油茶籽壳总黄酮预处理HL-7702细胞1 d,与AFB1损伤组相比,25 μg/mL保护组没有显著提升HL-7702细胞内CAT、GSH-Px活性。
2.5 HL-7702细胞内Nrf2及其下游抗氧化酶表达的改变
Nrf2被称为氧化还原敏感转录因子,是调节抗氧化应激反应的重要转录因子[16]。与对照组相比,AFB1损伤组Nrf2及其下游GSTA2的mRNA(图2-a)和蛋白表达水平(图2-b)均明显下调。随着油茶籽壳总黄酮预保护浓度的提高,与AFB1损伤组相比,Nrf2及GSTA2的mRNA和蛋白表达水平都呈现剂量依赖性上调。GSTA2是Nrf2调控的下游众多抗氧化蛋白之一,SOD、CAT、GSH-Px也受Nfr2的调控,由此可知,油茶籽壳总黄酮在细胞氧化应激的情况下,通过上调Nrf2表达,提高了其下游一系列抗氧化酶的活性,从而对抗由AFB1造成的细胞氧化损伤。
2.6 细胞内NF-κB及下游炎症因子mRNA表达的改变
研究表明,肝细胞遭受氧化受损及肝炎、肝癌发生时NF-κB信号通路被显著激活[17-18]。由图3可知,与对照组相比,AFB1损伤组核转录因子NF-κB表达明显上调,其相关下游炎症介导因子TNF-α、IL-6、IL-1β也随之高表达,随着油茶籽壳总黄酮预保护浓度的提高,与AFB1损伤组相比,NF-κB及炎症因子表达都呈现剂量依赖性下调。由此可知,油茶籽壳总黄酮对HL-7702细胞的预处理下调了由AFB1引起的NF-κB信号通路的激活,相关炎症因子表达随之减少,提示其在预防、治疗肝炎方面可能具有的功能。
3 结论与讨论
生物有氧代谢过程中产生的过多活性氧(ROS)会导致氧化应激,肝脏因含有丰富的线粒体,是产生ROS较多的器官,也是较易受到ROS攻击的器官。氧化应激会引起脂质过氧化,破坏酶活性,损伤DNA,造成肝损伤。研究表明,氧化应激与多种肝脏疾病、肝功能障碍密切相关[19]。AFB1进入肝细胞后,通过环氧化反应转变为有活性的AFB1-8,9环氧化合物,进而引发肝细胞内产生过量ROS,造成细胞的氧化应激,这是AFB1生物毒性尤其是肝脏毒性发生的主要机理[20]。
本研究表明,当肝细胞遭遇AFB1损伤时,油茶籽壳总黄酮与肝细胞的预孵显著降低了细胞内ROS、MDA水平,同时提升了肝细胞内抗氧化酶系(SOD、CAT、GSH-Px)的活性,因此改善了肝细胞AFB1暴露下的氧化-抗氧化平衡环境,提高了细胞存活率。El-Nekeety 等[3]、 Zhang等[21]、Hou等[22]都曾报道过:当细胞暴露于霉菌毒素时,天然抗氧化剂可以增强细胞内抗氧化酶活性,阻断脂质过氧化,从而缓解细胞的氧化应激。Nrf2是公认的细胞防御过氧化应激的重要调节因子,在氧化应激状态下,Nrf2与细胞核内抗氧化反应元件ARE结合,上调一系列解毒酶和抗氧化蛋白表达,从而增强肝细胞的解毒及抗氧化能力,减轻活性氧(ROS)和亲电子物质介导的细胞损害,对保护肝脏功能、阻止多种肝脏疾病的发生有着重要意义[23]。已经证明能通过Nrf2途径改善肝细胞氧化应激状态,进而发挥保护肝细胞作用的化合物有白藜芦醇[24]、姜黄素[25]、齐墩果酸[26]、熊去氧胆酸[27] 等,这些化合物主要集中在对肝细胞的乙醇或其他药物损伤方面的保护,由于这些化合物的来源十分有限,限制了其更为广泛的应用。本研究表明,来自油茶籽壳中的总黄酮物质与肝细胞的预孵上调了Nrf2、GSTA2表达,GSTA2是Nrf2调控的下游众多抗氧化蛋白之一,与肝脏解毒功能有关,SOD、CAT、GSH-Px也受Nfr2调控,抗氧化酶是细胞内对抗ROS的主要防御机制,因此可以认为油茶籽壳总黄酮预处理肝细胞后激活了Nfr2信号通路,上调其下游多种抗氧化酶基因的表达,提高细胞内抗氧化酶活性,从而对抗由ROS引起的肝细胞氧化损伤,起到保护肝细胞的作用。Costa等也报道了黄酮类物质在上调Nrf2蛋白和提高抗氧化酶活性方面的重要作用[28]。
细胞内产生过量ROS除了会导致MDA积累外,还可激活NF-κB信号通路,进而使其下游调控的许多炎症因子(包括TNF-α等)表达增加,持续释放,肝细胞氧化应激、凋亡,炎症细胞大量浸润,最终导致肝炎甚至引发肝癌[29] 。本研究表明,油茶籽壳总黄酮的预处理使得肝细胞NF-κB表达下降及其调控的炎症因子(TNF-α、 IL-6、IL-1β)下调,这提示其在预防、治疗肝炎方面可能具有的功能。油茶籽壳总黄酮通过上调Nrf2,提高Nfr2下游抗氧化酶系(SOD、CAT、GSH-Px、GSTA2)的活性,阻断了由ROS引起的脂质过氧化链式反应,同时下调NF-κB,减少炎症因子相关基因(TNF-α、IL-6、IL-1β)的表达,从而拮抗AFB1对肝细胞的毒性损伤,提高肝细胞存活率。油茶籽壳作为一种农业副产品,在我国资源丰富、价格低廉,本研究证明了其中的黄酮类物质具有拮抗AFB1肝细胞毒性的功能,为油茶籽壳的环保、高效利用提供了新途径。
参考文献:
[1]Rawal S,Kim J E,Coulombe R. Aflatoxin B1 in poultry:toxicology,metabolism and prevention[J]. Research in Veterinary Science,2010,89(3):325-331.
[2]Abdel-Aziem S H,Hassan A M,El-Denshary E S,et al. Ameliorative effects of thyme and calendula extracts alone or in combination against aflatoxins-induced oxidative stress and genotoxicity in rat liver[J]. Cytotechnology,2014,66(3):457-470.
[3]El-Nekeety A A,Mohamed S R,Hathout A S,et al. Antioxidant properties of Thymus vulgaris oil against aflatoxin-induce oxidative stress in male rats[J]. Toxicon,2011,57(7/8):984-991.
[4]Hassan A M,Abdel-Aziem S H,El-Nekeety A A,et al. Panax ginseng extract modulates oxidative stress,DNA fragmentation and up-regulate gene expression in rats sub chronically treated with aflatoxin B1 and fumonisin B1[J]. Cytotechnology,2015,67(5):861-871.
[5]El-Nekeety A A,Abdel-Azeim S H,Hassan A M,et al. Quercetin inhibits the cytotoxicity and oxidative stress in liver of rats fed aflatoxin-contaminated diet[J]. Toxicology Reports,2014,1:319-329.
[6]Guengerich F P,Kim D H. In vitro inhibition of dihydropyridine oxidation and aflatoxin B1 activation in human liver microsomes by naringenin and other flavonoids[J]. Carcinogenesis,1990,11(12):2275-2279.
[7]Farombi E O,Adepoju B F,Ola-Davies O E,et al. Chemoprevention of aflatoxin B1-induced genotoxicity and hepatic oxidative damage in rats by kolaviron,a natural bioflavonoid of Garcinia kola seeds[J]. European Journal of Cancer Prevention,2005,14(3):207-214.
[8]杨俊换,周建平,胡尧超. 油茶籽壳的化学成分分析与扫描电镜观察[J]. 湖南农业大学学报:自然科学版,2013,39(5):554-558.
[9]姜天甲,应铁进,陈秋平,等. 油茶籽壳总黄酮的提取及抗氧化研究[J]. 中国食品学报,2010,10(1):93-99.
[10]杨彤晖,于修烛,蔡学标,等. 超声波辅助提取油茶籽壳总黄酮及对猪油抗氧化能力研究[J]. 粮油食品科技,2012,20(1):26-29.
[11]高 扬,易若琨,宋家乐.竹叶总黄酮对UVB诱导 HaCaT细胞氧化损伤的保护作用[J]. 南京中医药大学学报,2015,31(2):165-169.
[12]Fraga C G,Leibovitz B E,Tappel A L. Lipid peroxidation measured as thiobarbituric acid-reactive substances in tissue slices:characterization and comparison with homogenates and microsomes[J]. Free Radical Biology & Medicine,1988,4(3):155-161.
[13]Zhong X L,Shi Y R,Chen J J,et al. Polyphenol extracts from Punica granatum and Terminalia chebula are anti-inflammatory and increase the survival rate of chickens challenged with Escherichia coli[J]. Biological & Pharmaceutical Bulletin,2014,37(10):1575-1582.
[14]He Y,Fang J,Peng X,et al. Effects of sodium selenite on aflatoxin B1-induced decrease of ileac T cell and the mRNA contents of IL-2,IL-6,and TNF-α in broilers[J]. Biological Trace Element Research,2014,159(1/2/3):167-173.
[15]Pan Z M,Fang Q,Geng S Z,et al. Analysis of immune-related gene expression in chicken peripheral blood mononuclear cells following Salmonella enterica serovar enteritidis infection in vitro[J]. Research in Veterinary Science,2012,93(2):716-720.
[16]李 平,李 芬,叶 昉,等. Nrf2信号通路在铅致SH-SY5Y细胞氧化应激中作用[J]. 中国公共卫生,2012,28(7):933-935.
[17]于晨辉,杜仲燕,高 佳,等. 4-HNE通过抑制TNF-α介导的NF-κB活化诱导酒精性肝损伤[J]. 中国病理生理杂志,2013,29(6):1046-1052.
[18]李亚萍,党双锁,翟 嵩,等. NF-κB、α-SMA及TGFβ1在实验性肝损伤中的表达[J]. 临床肝胆病杂志,2011,27(11):1207-1210.
[19]Cederbaum A I,Lu Y K,Wu D F. Role of oxidative stress in alcohol-induced liver injury[J]. Archives of Toxicology,2009,83(6):519-548.
[20]Beyki M,Zhaveh S,Khalili S T,et al. Encapsulation of mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against aspergillus flavus[J]. Industrial Crops and Products,2014,54(4):310-319.
[21]Zhang A H,Sun H,Wang X J. Recent advances in natural products from plants for treatment of liver diseases[J]. European Journal of Medicinal Chemistry,2013,63(33):570-577.
[22]Hou Y J,Zhao Y Y,Xiong B,et al. Mycotoxin-containing diet causes oxidative stress in the mouse[J]. PLoS One,2013,8(3):e60374.
[23]邵洛林,郭建强,许伟华. Nrf2在肝细胞中作用的研究进展[J]. 国际消化病杂志,2009,29(6):381-383,423.
[24]Rubiolo J A,Mithieux G,Vega F V. Resveratrol protects primary rat hepatocytes against oxidative stress damage:activation of the Nrf2 transcription factor and augmented activities of antioxidant enzymes[J]. European Journal of Pharmacology,2008,591(1/3):66-72.
[25]Farombi E O,Shrotriya S,Na H K,et al. Curcumin attenuates dimethylnitrosamine-induced liver injury in rats through Nrf2-mediated induction of heme oxygenase-1[J]. Food and Chemical Toxicology,2008,46(4):1279-1287.
[26]Reisman S A,Aleksunes L M,Klaassen C D. Oleanolic acid activates Nrf2 and protects from acetaminophen hepatotoxicity via Nrf2-dependent and Nrf2-independent processes[J]. Biochemical Pharmacology,2009,77(7):1273-1282.
[27]Kawata K,Kobayashi Y,Souda K,et al. Enhanced hepatic Nrf2 activation after ursodeoxycholic acid treatment in patients with primary biliary cirrhosis[J]. Antioxidants & Redox Signaling,2010,13(3):259-268.
[28]Costa S,Schwaiger S,Cervellati R,et al. In vitro evaluation of the chemoprotective action mechanisms of leontopodic acid against aflatoxin B1 and deoxynivalenol-induced cell damage[J]. Journal of Applied Toxicology,2009,29(1):7-14.
[29]Martindale J L,Holbrook N J. Cellular response to oxidative stress:signaling for suicide and survival[J]. Journal of Cellular Physiology,2002,192(1):1-15.姚 辉,杨悦君. 明清皇家陵寝的“祈福”文化与旅游开发——以清东陵为例[J]. 江苏农业科学,2016,44(4):578-582.

