分枝杆菌胞外聚合物EPS对芘增溶作用的影响
谷玥+贾春云+刘志红+卜宁+方玥蒙

摘要:为阐明分枝杆菌胞外聚合物(EPS)在土壤多环芳烃(PAHs)微生物修复过程中的作用机理,以芘为研究对象,研究在不同pH值、温度和EPS浓度条件下,EPS对芘增溶作用的影响。结果表明:在固定EPS浓度下,48 h内芘在EPS中的溶解量先增高后降低,于8 h芘溶解度达到最大值,为0.368 mg/L;当温度升高时(15~35 ℃),EPS浓度从65.2 mg/L增加到422.6 mg/L,芘溶解量的变化趋势均为先升高后降低,在25 ℃、216.3 mg/L条件下,芘溶解量达到最大值;随着pH值升高(pH值范围为1~9),芘的溶解量先升高后降低,于pH值=5(自然)时溶解量最多。研究证实了EPS能够促进芘的溶解,通过芘的溶解量受温度、EPS浓度及pH值影响而变化的研究,推测EPS增溶芘的作用过程,其中影响芘溶解的主要物质为蛋白质。
关键词:胞外聚合物(EPS);分枝杆菌;芘;pH值;温度;增溶
中图分类号: S182;X171.5
文献标志码: A
文章编号:1002-1302(2016)04-0445-03
多环芳烃是一类由多个苯环构成的持久性有机污染物,其“三致”(致突变、致癌、致畸)效应给生态环境、人类健康都会带来极大危害。基于多环芳烃广泛存在于环境中,多环芳烃的环境修复一直是研究热点,土壤作为一种重要的环境介质,其中的多环芳烃是空气中与水中多环芳烃的汇集源,因此土壤中多环芳烃的修复更是研究重点,但是多环芳烃在土壤中通常会发生老化,从而给修复带来很大的困难。通常土壤中多环芳烃的苯环数在2~3个时为低分子量多环芳烃,污染的土壤较易修复;而当多环芳烃分子中苯环数≥4个时,为高分子量多环芳烃,污染的土壤较难修复[1-2]。芘作为高分子量多环芳烃中最典型的一种,是很多多环芳烃环境修复的研究对象,而在众多修复技术中,微生物修复因其高效、针对性强等特点,是目前较为热门的修复技术。陆泗进等从土壤中分离纯化出2株芘的高效降解菌,并探讨了菌株在土壤环境中对芘的降解情况[3];李晓明等筛选驯化出可以降解芘的高效菌群,为多环芳烃的生物修复奠定了理论基础[4]。
微生物胞外聚合物(extracellular polymeric substances,EPS)是一种附着于细菌表层的有机高分子多聚化合物,主要由蛋白质、多糖、DNA和腐殖酸四大类物质构成,是微生物细胞外极其重要的组成部分,可以协助细胞摄入附近的营养物,对微生物的生长繁殖起重要作用[5-7],因微生物修复技术被广泛应用,EPS也成为微生物修复研究中的重要方面:如在重金属吸附方面,简磊等通过试验研究了EPS吸附重金属离子的作用机理、影响EPS吸附重金属的因素,以及EPS对铅铜等重金属的吸附特性[8]。在有机污染物降解方面,杨智临等将EPS与萘、菲的专一降解菌分别联用,萘降解率达96%,菲降解率达100%[9]。姜春阳等研究发现,真菌、细菌的EPS具有较强的降解土壤中芘的能力,且EPS浓度越高,土壤中芘的降解效果越好[10]。EPS能自发通过范德华力或乳化作用与水体中有机污染物作用促进污染物的降解[11-13]。Zheng等研究发现,从原油污染土壤中分离出2株可以产生PAHs乳化剂EPS的菌株[14]。因此,EPS在微生物降解芘反应过程中的作用十分重要,但是针对其在具体反应过程中的机制研究还尚显不足,本研究以EPS浓度、pH值、以及温度作为变量,研究3种因素在不同条件下EPS对溶液中芘溶解作用的影响,探究分枝杆菌EPS增溶芘的最适条件,并借以发现可能的反应机制及反应中的关键反应物质,以期为后续利用分枝杆菌进行土壤中污染物的微生物降解奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 仪器与试剂 主要仪器为:高速离心机(IECMultiRF,美国);空气恒温振荡器(HZQ-C,哈尔滨市东联电子技术开发有限公司);高效液相色谱仪(1200系列,美国安捷伦科技公司);总有机碳测定仪(multi N/C3100,德国耶拿);万分之一天平;0.45 μm水相滤器;0.22 μm有机相滤器。主要试剂为:芘(德国Fluka公司,纯度>97%);丙酮(分析纯,沈阳经济技术开发区试剂厂);二氯甲烷(分析纯,天津市富宇精细化工有限公司);甲醇(色谱纯,山东禹王实业总公司化工厂)。
1.1.2 菌种 分枝杆菌(Mycobacterium sp.),对芘的降解率为85.5%,由中国科学院沈阳应用生态研究所土壤污染生态组提供。
1.2 试验方法
1.2.1 芘储备溶液的配制 使用万分之一天平精确称取0.050 g 芘,溶于40 mL丙酮,移入50 mL容量瓶中,加丙酮定容,精确配制成1 mg/mL芘的丙酮储备溶液。
1.2.2 制备EPS
1.2.2.1 菌种培养 称取3 g牛肉膏、10 g蛋白胨、5 g NaCl,溶于1 000 mL蒸馏水中,调节pH值为7.0~7.2,配制成1 L的牛肉膏蛋白胨培养液,分装入锥形瓶内,121 ℃灭菌 30 min。将菌株接入培养基内,28 ℃、135 r/min培养 7 d。
1.2.2.2 EPS提取与有机碳测定 改进张宇等的方法[15],取菌体生长7 d的培养液于8 000 r/min离心4 min,弃上清液;补充无菌水至原体积,于8 000 r/min离心4 min,去上清液;加入适当无菌水(不同量无菌水制备不同浓度的EPS)制备成菌悬液。将该菌悬液放入60 ℃水浴锅中加热30 min。将样品于 12 000 r/min 离心5 min,上清液经0.45 μm滤膜抽滤,得到的无色透明溶液即为EPS样品,加入0.1 mg/L NaN3作为抑菌剂。用总有机碳测定仪(TOC)测定EPS中有机碳含量。
1.2.3 芘的增溶试验
1.2.3.1 EPS对芘增溶效果的影响 取0.2 mL芘的储备溶液于三角瓶中,待丙酮挥发完全后,加入10 mL TOC浓度为264.3 mg/L的EPS溶液。对照组加10 mL水,套上无菌膜,用牛皮纸密封,置于25 ℃、180 r/min摇床中振荡。分别于1、2、4、6、8、12、24、36、48 h定时取样。每组试验设3组平行。
1.2.3.2 温度、EPS浓度对芘增溶效果的影响 取0.2 mL芘的丙酮溶液于三角瓶中,待丙酮挥发完全后,分别加入10 mL TOC浓度为65.2、167.1、216.3、346.6、422.6 mg/L的1、2、3、4、5号EPS溶液。在对照组0号中加入10 mL无菌水,套上无菌膜,用牛皮纸密封,置于25 ℃、180 r/min的摇床中振荡8 h后取样。每组试验设置3组平行。
重复上述步骤,置于15、35 ℃条件下。
1.2.3.3 pH值对芘增溶效果的影响 取0.2 mL芘的丙酮溶液于三角瓶中,待丙酮挥发完全后,分别加入10 mL TOC浓度为178.6 mg/L、pH值为1、3、5、7、9的EPS溶液,在对照组中加入10 mL pH值为1、3、5、7、9的无菌水,套上无菌膜,用牛皮纸密封,置于25 ℃、180 r/min的摇床振荡8 h后取样。每组试验设置3组平行。
1.2.4 芘的提取与测定
1.2.4.1 溶液中芘的提取 采用液相萃取法,首先将三角瓶中溶液过0.45 μm水相滤器,然后向滤后溶液中加入等体积的二氯甲烷,放入振荡器中振荡5 min(25 ℃、180 r/min),全部移入50 mL分液漏斗中,静置5 min,分层后将下层有机相存入烧杯中,每个样品按此步骤重复萃取3次。将3次萃取液混匀,转移至烧杯中,使用普通氮气吹至近干,最后用甲醇定容,过0.22 μm有机滤膜后移入液相色谱专用进样瓶中。
1.2.4.2 芘的测定 采用高效液相色谱法,色谱仪主要设定参数为:流动相:100%甲醇;流速:0.8 mL/min;VWD检测波长:254 nm;柱箱温度:35 ℃;进样量:10 μL[16]。
1.2.5 数据处理 试验数据采用SPSS 20.0进行统计分析,使用Sigmaplot 10.0作图。
2 结果与分析
2.1 EPS对芘增溶效果的影响
由图1可以看出,在1~48 h的9个测试点上,芘在EPS中的溶解量与各自对照组(芘在水中的溶解量)相比均有显著差别(P<0.05):芘在EPS中的溶解量随着溶液与芘作用时间的变化呈现先增高而后降低的趋势,在1~8 h时,芘在EPS中的平均溶解量由0.293 mg/L增加到0.368 mg/L,与对照组比较,增溶量由79.9%上升至120.2%,呈明显上升趋势,在8 h时达最大值;但在8~48 h,随着培养时间的延长,芘的平均溶解量则呈现逐渐下降的趋势,与对照组比较,增溶量由120.2%降为45.0%以下,呈下降趋势,这可能与EPS中蛋白质失活有关。经SPSS计算分析可知:对照组中芘溶解量平均值为0.179 mg/L,EPS处理组中芘溶解量平均值为 0.318 mg/L,水处理组与EPS处理组间差异显著,与对照相比,芘在EPS处理组中的增溶达到77.65%。但对对照组与EPS处理组进行单因素方差分析可知,测试点间数据不成线性关系假设。
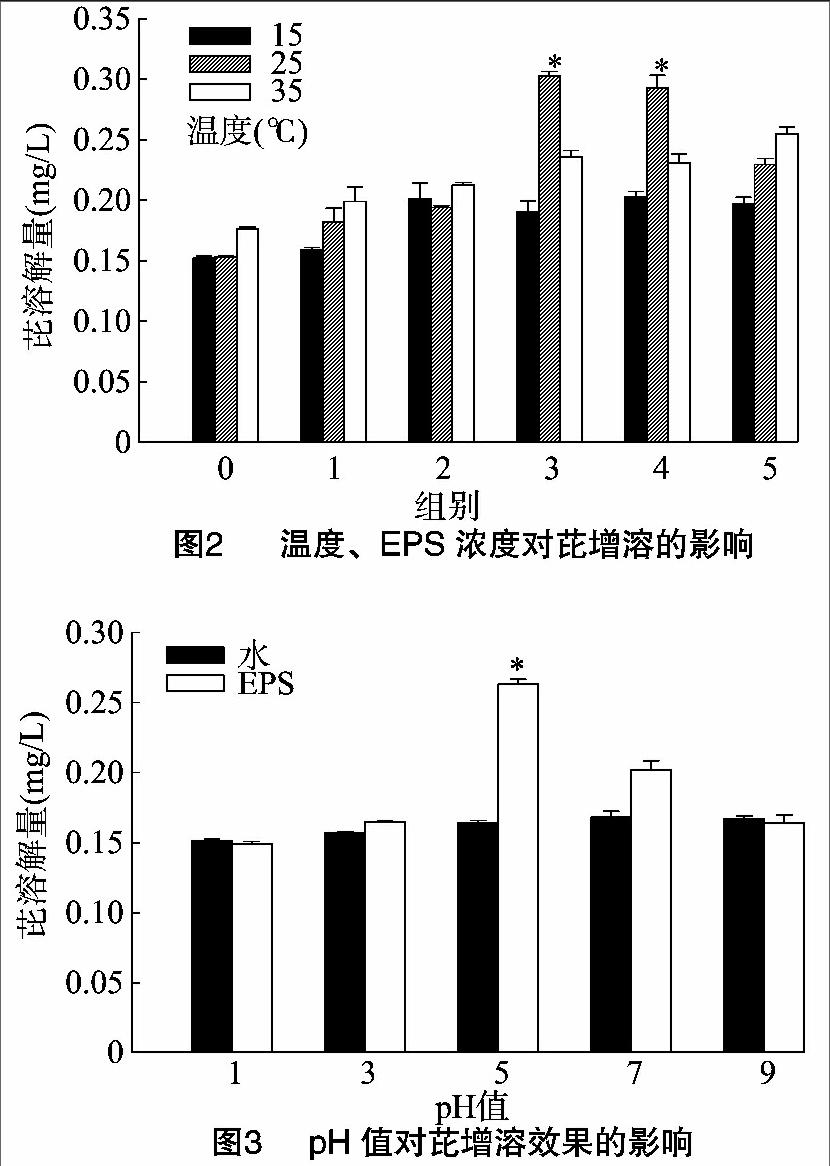
2.2 温度、浓度对芘增溶效果的影响
由图2可以看出,温度的升高可以增加芘的溶解量。0号水处理中,35 ℃与15、25 ℃比,芘溶解量略有增加;1号EPS处理组中,芘在水中的溶解量随温度升高而增加;2号EPS处理组中,15、25 ℃时芘的溶解量差异小,在35 ℃时芘的溶解量有所增加;3号EPS处理组中,25 ℃条件下芘的溶解量最高,35 ℃次之,15 ℃溶解量最低;4号EPS处理组中,芘的溶解量大小同样是25 ℃>35 ℃>15 ℃;5号EPS处理组中,芘的溶解量排序则是35 ℃>25 ℃>15 ℃。
在温度相同、EPS浓度不同的情况下,芘的增溶效果也不同:在15、35 ℃,随着EPS浓度的增加,芘的溶解量有所提高:TOC含量为422.6 mg/L的5号组芘溶解量分别达到0.197、0.255 mg/L;而在25 ℃,芘的溶解量随EPS浓度的增大先增高后降低,于TOC含量为263.3 mg/L时(3号组)溶解量最大,为0.303 mg/L,与相同温度下水处理芘溶解量相比,增溶率达97.3%。
2.3 pH值对芘增溶效果的影响
在不同pH值条件下,水、EPS组芘溶解量见图3。可以看出,pH值相同时,不同处理对芘的溶解量有较大影响:pH值=1、3时,芘在EPS处理组与水处理组溶解量差异不大;pH值=5时,芘的溶解量在2组中有明显差别:EPS处理组的溶解量增加到0.274 mg/L,远高于水组的0.163 mg/L,增溶率达到68.1%;pH值=7时,EPS处理组芘的溶解量只是略高于水组;pH值=9时,水处理与EPS处理芘溶解量几乎相等。溶剂相同、pH值不同时,水处理组pH值改变对芘溶解量的影响无差异,EPS处理组pH值改变对芘溶解量的影响差异很大,pH值=5时,芘的溶解量最大。
3 讨论与结论
3.1 讨论
EPS是细菌分泌到细胞周围所有物质的总称,主要包括多糖、蛋白质、腐殖酸及少量核酸,有研究表明,细菌分泌的胞外蛋白作为细菌与外界的“通道”,摄入外来物质;分泌的胞外多糖起到对物质的吸附和絮凝作用,而腐殖酸可以与有机物产生吸附和配合作用,形成大分子络合物[17-20]。这几种物质所构成的特殊结构模式对细菌摄入污染物起着复杂的作用:EPS与生物体间发生离子架桥、静电中和等反应所表现出的黏结性,有利于对多环芳烃的溶解吸附,提高细菌对多环芳烃的去除能力[21-22],本试验结果与其基本一致。EPS中多种有机官能团在溶液中离子化所表现出表面负电荷性,可以促进蛋白质-多糖反应、疏水反应、氢键、离子反应的发生[23],进而可以增强EPS与芘的相互作用,增加芘的溶解量。
多环芳烃的的溶解量可能还与所使用溶剂的亲水疏水性有关。Zhang等研究发现:EPS对多环芳烃的增溶主要靠松散层胞外聚合物的多糖部分[24];刘虹等在糖脂类生物表面活性剂对石油烃的增溶研究中发现:石油烃的溶解度随糖脂类生物表面活性剂浓度的增加而增加[25];赵东维研究发现,糖脂类表面活性剂对多环芳烃的增溶作用随pH值的增大而增强[26]。这些试验均与本试验结果有差异,说明EPS中起增溶作用的物质不单是糖类。有研究表明:蛋白质、腐殖酸是EPS中疏水部分的主要物质,而糖类则是亲水部分的主要物质[27],因此,EPS对芘的溶解可能是一个较为复杂的作用过程:首先疏水部分和芘相互作用聚集在内部,亲水部分包裹在外面与水相溶,随后二者共同作用,芘在水中的溶解量增加。鉴于蛋白质受温度、pH值的变化而变化[28],以及芘在分枝杆菌EPS中的溶解度随EPS浓度、温度以及pH值的变化而变化的特点,可以推测:EPS内的蛋白质对芘的增溶有很大影响。
3.2 结论
(1)EPS溶液能够增加芘的溶解量,与对照组相比平均提高77.65%。当EPS与芘相互作用8 h时,芘的溶解量最高,是对照组的1.2倍。(2)温度与EPS浓度也是影响芘的溶解量变化的因素,当温度为25 ℃、EPS的TOC浓度为 216.3 mg/L 时,芘的溶解量最大。(3)改变pH值也可以增加芘的溶解量:pH值=5是EPS增溶芘的最佳条件。(4)由于芘的溶解量受温度、胞外聚合物(EPS)浓度及pH值影响比较大,可以推测:EPS内影响芘溶解的主要因素是蛋白质。
参考文献:
[1]Boonchan S,Britz M L,Stanley G A. Degradation and mineralization of high-molecular-weight polycyclic aromatic hydrocarbons by defined fungal-bacterial cocultures[J]. Applied and Environmental Microbiology,2000,66(3):1007-1019.
[2]Watanabe M,Noma Y. Influence of combustion temperature on formation of nitro-PAHs and decomposition and removal behaviors in pilot-scale waste incinerator[J]. Environmental Science & Technology,2009,43(7):2512-2518.
[3]陆泗进,何立环,孙 聪. 土壤芘降解菌的分离及特性研究[J]. 环境科学与管理,2013,38(6):78-81,92.
[4]李晓明,张明江,金京华,等. 芘降解菌群驯化过程中的演变[J]. 微生物学报,2012,52(10):1260-1267.
[5]皋德祥,邓欢欢,张明华,等. 微生物胞外聚合物的研究进展[J]. 温州医科大学学报,2012,42(3):297-301.
[6]黄敏婷,陆 春. 生物膜胞外聚合物的检测技术与功能的研究进展[J]. 微生物学杂志,2010,30(6):82-85.
[7]蒋 巍,钟方丽,史晋宜,等. 生物膜胞外聚合物的研究进展[J]. 吉林化工学院学报,2001,18(3):85-88.
[8]简 磊,李炳辉,郭训文,等. 胞外聚合物对重金属离子的吸附[J]. 广东化工,2015,42(9):143-146.
[9]杨智临,李亚龙,白智勇,等. 生物与胞外聚合物偶联降解石油污染土壤中常见有机物[J]. 油气田地面工程,2014,33(12):14-15.
[10]姜春阳,贾春云,张丽芳,等. 微生物胞外聚合物对土壤中芘降解效果的促进作用[J]. 江苏农业科学,2015,43(6):303-306.
[11]Zhang Z,Xia S,Wang X,et al. A novel biosorbent for dye removal:extracellular polymeric substance (EPS) of Proteus mirabilis TJ-1[J]. Journal of Hazardous Materials,2009,163(1):279-284.
[12]Sheng G P,Zhang M L,Yu H Q. Characterization of adsorption properties of extracellular polymeric substances (EPS) extracted from sludge[J]. Colloids and Surfaces B-Biointerfaces,2008,62(1):83-90.
[13]Urai M,Anzai H,Ogihara J,et al. Structural analysis of an extracellular polysaccharide produced by Rhodococcus rhodochrous strain S-2[J]. Carbohydrate Research,2006,341(6):766-775.
[14]Zheng C,He J,Wang Y,et al. Hydrocarbon degradation and bioemulsifier production by thermophilic Geobacillus pallidus strains[J]. Bioresource Technology,2011,102(19):9155-9161.
[15]张 宇,梁彦秋,贾春云,等. 不同方法提取PAHs高效降解菌EPS的特性[J]. 生态学杂志,2014,33(4):1027-1033.
[16]全冬丽,双生晴,李晓军,等. 固定化菌剂载体材料腐解产物对污染土壤中芘解吸的影响[J]. 环境科学,2015,36(8):3018-3025.
[17]Czaczyk K,Myszka K. Biosynthesis of extracellular polymeric substances (EPS) and its role in microbial biofilm formation[J]. Polish Journal of Environmental Studies,2007,16(6):799-806.
[18]Johnsen A R,Karlson U. Evaluation of bacterial strategies to promote the bioavailability of polycyclic aromatic hydrocarbons[J]. Applied Microbiology and Biotechnology,2004,63(4):452-459.
[19]Seo Y,Lee W H,Sorial G,et al. The application of a mulch biofilm barrier for surfactant enhanced polycyclic aromatic hydrocarbon bioremediation[J]. Environmental Pollution,2009,157(1):95-101.
[20]Zhou Z,Sun H,Zhang W. Desorption of polycyclic aromatic hydrocarbons from aged and unaged charcoals with and without modification of humic acids[J]. Environmental Pollution,2010,158(5):1916-1921.
[21] Busscher H J,van der Mei H C. Initial adhesion events:mechanisms an implications[M]//Allison D G,Gilbert P,Lappin-Scott H M,et al. Community structure and cooperation in biofilms. Cambridge:Cambridge Unibersity Press,2000,59:25-36.
[22]Mayer C,Moritz R,Kirschner C,et al. The role of intermolecular interactions:studies on model systems for bacterial biofilms[J]. International Journal of Biological Macromolecules,1999,26(1):3-16.
[23 ] Morgan J W,Forster C F,Evison L. A coparative study of the nature of biopolymers extracted from anaerobic and activated sludges[J]. Water Research,1990,24(6):743-750.
[24]Zhang Y,Wang F,Yang X,et al. Extracellular polymeric substances enhanced mass transfer of polycyclic aromatic hydrocarbons in the two-liquid-phase system for biodegradation[J]. Applied Microbiology and Biotechnology,2011,90(3):1063-1071.
[25]刘 虹,刘 娜,毕白云,等. 糖脂类生物表面活性剂去除污染含水层中石油烃的研究[J]. 环境污染与防治,2015,37(5):6-10.
[26]赵东维. 生物表面活性剂产生菌对石油的降解及对石油烃的增溶作用研究[D]. 青岛:中国海洋大学,2013:38-45.
[27]Wilén B M,Jin B,Lant P. The influence of key chemical constituents in activated sludge on surface and flocculating properties[J]. Water Research,2003,37(9):2127-2139.
[28]彭 青,侯 冰,姚 芬,等. pH值、温度、底物浓度对L1型金属β-内酰胺酶活性的影响[J]. 中国抗生素杂志,2010,35(1):69-71,76.张宸赫,王 琳,赵天良,等. 气候变暖背景下中国冬小麦物候期的时空特征[J]. 江苏农业科学,2016,44(4):448-452.

