流式细胞术分析骨髓增生异常综合征小巨核细胞的初步研究*
刘 帅,曹 征,张晓飐,岳保红
(郑州大学第一附属医院检验科,郑州 450052)
流式细胞术分析骨髓增生异常综合征小巨核细胞的初步研究*
刘帅,曹征,张晓飐,岳保红△
(郑州大学第一附属医院检验科,郑州 450052)
[摘要]目的建立基于巨核细胞糖蛋白Ⅱb/Ⅲa(CD41a)和碘化丙啶(PI)双标记的流式细胞术(FCM)分析骨髓小巨核细胞的方法,并研究其在骨髓增生异常综合征(MDS)诊断中的意义。方法采用异硫氰酸荧光素标记的单克隆抗体标记CD41a,PI标记巨核细胞DNA,用FCM分析巨核细胞倍体分布。结果42例MDS患者,FCM检测小巨核细胞阳性率为90.5%,瑞氏-姬姆萨染色和免疫组织化学方法检测阳性率分别为54.8%和64.3%,三者比较差异有统计学意义(χ2=13.640,P=0.001);FCM检测MDS低危组和高危组小巨核细胞阳性率分别为81.8%和100%,差异有统计学意义(χ2=4.019,P=0.045)。结论FCM检测MDS小巨核细胞检出率高,且高危患者小巨核细胞检出率更高,有助于MDS的早期诊断和预后评估。
[关键词]流式细胞术;骨髓增生异常综合征;巨核细胞;DNA倍体;CD41a
巨核细胞(megakaryocyte)是人体骨髓中唯一的多倍体细胞[1],担负着生成血小板和参与止血、凝血的重要功能,其分化发育及倍体分布的情况与血小板生成的质与量紧密相关[2-3]。正常巨核细胞的体积较其他细胞系更大,通过骨髓涂片很容易识别,然而骨髓增生异常综合征(myelodysplastic syndrome,MDS)患者的骨髓中通常会出现一种大小与淋巴细胞相似的小巨核细胞(micromegakaryocyte),该类细胞不能增殖成熟形成多倍体化,亦不能完成正常巨核细胞的功能[4]。仅通过细胞形态很难准确识别这种小巨核细胞,且受个人主观因素影响,很难获得真实的骨髓巨核细胞增生情况和与增殖相关的DNA倍体数,因此单纯的形态学检查会影响MDS的诊断,建立一种客观、准确、特异的方法来识别和鉴定小巨核细胞对MDS的诊断具有重要价值。本研究利用单克隆抗体与抗原特异性结合的特性,以及碘化丙啶(PI)检测DNA倍体的特性,可以准确地识别巨核细胞并获得巨核细胞的倍体数,进而为临床提供更为可靠、准确的小巨核细胞数量、倍体和性质的数据。
1资料与方法
1.1一般资料收集42例MDS初诊患者,其中男25例,女17例,年龄19~83岁,中位年龄56岁。所有病例均符合MDS临床诊断标准[5]。按照WHO标准将其分为低危组(包括MDS-RA,RCMD和5q-)22例和高危组(包括MDS-RAEB-1和RAEB-2)20例。所有患者均选取髂后上棘作为骨髓穿刺部位,取约5 μL骨髓液推片,另取1~2 mL骨髓液用乙二胺四乙酸二钾(EDTA-K2)抗凝。
1.2方法
1.2.1主要仪器和试剂FACSCalibur流式细胞仪(美国BD公司);LD5-2A型低速离心机(北京雷郣尔公司);异硫氰酸荧光素标记的巨核细胞糖蛋白Ⅱb/Ⅲa(CD41a)单克隆抗体(3199548,CD41a-FITC,美国BD公司);PI(美国Sigma公司);标准微球(340486,CaliBRITE 3,美国BD公司);Percoll 细胞分离液(美国GE公司);细胞透膜液(PERM,美国BD公司);RNA酶(RNase,美国Sigma公司);巨核细胞免疫组织化学染色试剂盒(10342,北京赛驰生物科技有限公司);Olympus显微镜等。
1.2.2试验方法
1.2.2.1瑞氏-姬姆萨染色用瑞氏-姬姆萨染液对骨髓涂片进行染色,在光学显微镜下识别有无小巨核细胞。
1.2.2.2免疫组织化学染色按照免疫组织化学染色试剂盒说明书对骨髓涂片进行染色,在光学显微镜下识别有无小巨核细胞。
1.2.2.3巨核细胞分离富集用等渗的Percoll细胞分离液和磷酸盐缓冲液(PBS)将骨髓中有核细胞数量调整至20×106个,并将其Percoll密度调至1.020 g/mL。将配好的1.020 g/mL骨髓液缓缓加在2 mL密度为1.056 g/mL Percoll分离液上方,然后再加入2 mL PBS。400 g离心20 min,吸取Percoll分离液上面的灰白色细胞层,加入1.5倍体积的PBS,300 g离心10 min,弃上清液。留取细胞沉淀待用。
1.2.2.4巨核细胞的免疫荧光染色将富集好的巨核细胞悬液用PBS调成(2~3)×106个/mL。加入透膜液500 μL,混匀,室温放置10 min。加入2 mL PBS,400 g离心5 min,弃上清液。加入CD41a-FITC 10 μL,混匀,避光,室温下放置20 min。加2 mL PBS,100 g离心7 min,弃上清液。加入RNase100 μL,放入37 ℃水浴箱孵育30 min。将细胞悬液调整至500 μL左右,加入5 mg/mL PI染色。用200目尼龙网过滤后上流式细胞仪检测。
1.2.2.5流式细胞术(FCM)检测运用标准微球校准流式细胞仪光路、电压及补偿。采用双激发光,波长分别为488 nm和633 nm,进行4色荧光分析。共获取500 000~1 000 000个细胞。以CD41a/SSC设门,圈定巨核细胞(R1);在CD41a/PI双坐标图中,分析各个巨核细胞DNA倍体分布情况。选择未表达CD41a骨髓细胞(R2)的DNA倍体2N峰作为参考标准,见图1。
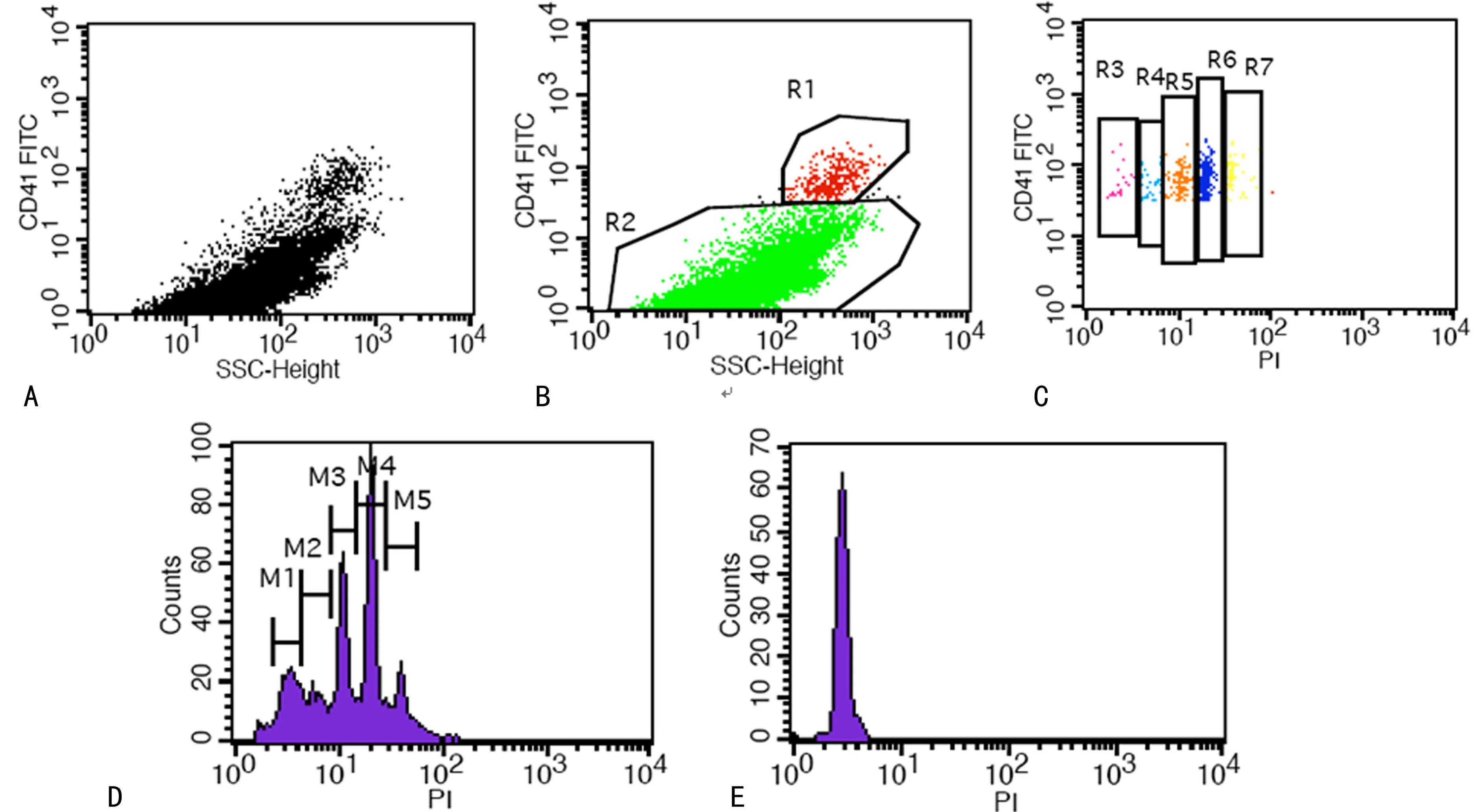
A:采用CD41a/ SSC设门,富集后骨髓巨核细胞的获取散点图;B:采用CD41a/ SSC设门,富集后骨髓巨核细胞的分析图,其中R1门内为巨核细胞,R2门内为阴性对照细胞;C:采用CD41a/PI 双坐标图中,富集后骨髓巨核细胞的CD41a表达及在各倍体百分率分析图。图中R3、R4、R5、R6、R7分别表示巨核细胞的2、4、8、16、32 N;D:巨核细胞各倍体分布直方图,M1、M2、M3、M4、M5分别表示巨核细胞的2、4、8、16、32 N;E:阴性对照细胞DNA 2N峰。
图1FCM分析巨核细胞DNA倍体
1.3统计学处理采用SPSS17.0统计软件进行分析,计数资料用率表示,组间采用χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2结果
2.1FCM、瑞氏-姬姆萨染色及免疫组织化学方法检测小巨核细胞阳性率的比较42例MDS患者,3种检测方法检测小巨核细胞的阳性率比较差异有统计学意义(χ2=13.640,P=0.001),FCM检测阳性率高于其他两种方法,见表1。

表1 3种方法检测42例MDS患者骨髓小巨核细胞
2.2高危组和低危组小巨核细胞阳性率比较FCM检测小巨核细胞,高危组阳性率高于低危组,差异有统计学意义(χ2=4.019,P=0.045),见表2。

表2 FCM方法检测高危组和低危组MDS病例小巨核
3讨论
病态巨核细胞尤其是淋巴样小巨核细胞是MDS鉴别于其他血液疾病的一项重要参考依据,其数量多少可以反映巨核细胞系病态造血的严重程度[6-9]。亦有研究表明,小巨核细胞对于MDS诊断特异性为100%[10]。
瑞氏-姬姆萨化学染色方法、免疫组织化学染色方法、FCM分别是3种不同水平的细胞检测方法。瑞氏-姬姆萨染色方法经典且实用,但存在病态造血时细胞形态常发生异常改变,加上主观因素及制片等因素影响,必然遗漏许多病态小巨核细胞,目前多采用巨核细胞酶标染色(APAAP)法检测巨核细胞,结果明显优于瑞氏-姬姆萨染色方法[10-11],但也受到实践经验、观察细胞数量有限等因素的影响,仍有局限性。而FCM则以计数细胞数量多、易标记细胞、快速分析为其特点,尤其在分析低比例含量的细胞方面,更能客观反映该细胞在骨髓中的真实情况。本研究结果显示,FCM检测小巨核细胞阳性率明显高于其他两种方法检测的阳性率,结果精确、可靠,充分体现了FCM检测巨核细胞的优势。
MDS患者通常巨核细胞总数不减少,但血小板数量却明显减少,说明巨核细胞DNA倍体数与血小板的产生直接相关。本研究建立了FCM检测小巨核细胞的方法,利用CD41a特异性单克隆抗体和特定激发光下发射荧光且可以插入到DNA双联的PI染液,以CD41a/SSC设门细胞,既可区分出巨核细胞,又能确定巨核细胞DNA倍体数。因巨核细胞内DNA呈指数增加,PI染色后DNA荧光强度理论上应是连续成倍增加,本研究结果中巨核细胞DNA分布直方图上可以看到各个DNA倍体组PI染色的平均荧光强度也正是连续成倍增加,说明这些峰群反映的正是巨核细胞DNA的倍性分布,而不是细胞随机凝集原因所致。另外,在这些峰群间未见到由于细胞随机凝集所致的其他倍体峰群(6、10、12 N等)。因此,通过FCM检测巨核细胞DNA倍体分布从而准确识别出MDS患者骨髓中的低倍体巨核细胞这一方法是可行的,对MDS的诊断有极大的帮助。
王小卫等[12]对MDS病态巨核细胞所作的FISH研究发现,二倍体占据绝对优势,此类二倍体巨核细胞既代表了形态上的不成熟,也隐含了功能上的缺陷。该研究结果和本课题用FCM分析巨核细胞的倍体分布相一致。张海燕等[13]通过FCM对特发性血小板减少性紫癜患者巨核细胞DNA倍体和糖蛋白表达水平的变化进行了研究,同样显示出可行性和优势性。
单因素分析显示有淋巴样小巨核细胞为MDS不良预后因素[14]。刘娟等[15]对38例初诊的MDS患者、8例再生障碍性贫血患者及17例健康对照的骨髓进行免疫表型检测,结果显示CD41阳性的淋巴样小巨核细胞在MDS组中较特异出现,且以RCMD组出现率最高。邱燕等[16]研究表明,健康组和良性血液病组未见淋巴样小巨核细胞,而MDS及其他恶性血液病均可见病态巨核细胞,淋巴样小巨核细胞在MDS中最为明显,提示淋巴样小巨核细胞的存在意味着骨髓恶性增生程度呈递增趋势。
本试验对42例MDS患者进行了分组,高危组2N巨核细胞检出率明显高于低危组,提示随病情进展,小巨核细胞检出率随之增高,该结果与上述观点一致。多篇关于FCM识别骨髓病态造血的试验数据亦显示,准确的巨核细胞倍体数对于MDS的诊断和预后评估有极其重要的作用[17-18]。
参考文献
[1]Geddis AE,Kaushansky K.Megakaryocytes express functional aurora-B kinase in endomitosis[J].Blood,2004,104(4):1017-1024.
[2]Kie JH,Yang WI,Lee MK,et al.Decrease in apoptosis and increase in polyploidization of megakaryocytes by stem cell factor during ex vivo expansion of human cord blood CD34+ cells using thrombopoietin[J].Stem Cells,2002,20(1):73-79.
[3]Mattia G,Vulcano F,Milazzo L,et al.Different ploidy levels of megakaryocytes generated from peripheral or cord blood CD34+ cells are correlated with different levels of platelet release[J].Blood,2002,99(3):888-897.
[4]师晓东,胡涛,冯燕玲,等.儿童骨髓增生异常综合征骨髓巨核细胞的研究[J].中国实验血液学杂志,2004,12(1):74-78.
[5]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:157.
[6]Bhasin TS,Sharma S,Manjari M,et al.Changes in megakaryocytes in cases of thrombocytopenia:bone marrow aspiration and biopsy analysis[J].J Clin Diagn Res,2013,7(3):473-479.
[7]李红卫,李建兰.小巨核细胞在骨髓增生异常综合征中的诊断意义[J].临床医药实践,2014,23(5):357-359.
[8]邓明凤,陈永玲,汪永红,等.病态巨核细胞在骨髓增生异常综合征中诊断和鉴别诊断的意义[J].实用检验医师杂志,2012,4(4):229-231.
[9]李佳,张曼.病态造血特征对骨髓增生异常综合征分型诊断价值的探讨[J].中国实验血液学杂志,2013,21(3):657-661.
[10]吴希锋,崔为发,马传香.巨核细胞酶标染色法在骨髓增生异常综合征诊断中的意义[J].临床医学,2009,29(2):28-29.
[11]李萍,陈建兰,颜金花,等.骨髓活检小巨核细胞酶标染色对骨髓增生异常综合征的诊断价值[J].中国实用医药,2012,7(31):4-6.
[12]王小卫,李晓,吴凌云,等.骨髓增生异常综合征骨髓病态造血细胞的克隆性分析[J].上海交通大学学报:医学版,2008,28(4):395-398.
[13]张海燕,屈晨雪,王建中,等.流式细胞术分析ITP巨核细胞分化发育异常的初步研究[J].中国实验诊断学,2010,14(4):546-550.
[14]陈悦丹,徐泽锋,崔蕊,等.骨髓增生异常综合征患者血小板减少的预后意义初步研究[J].中华血液学杂志,2012,33(7):532-535.
[15]刘娟,王京华,陈曦,等.免疫表型检测对骨髓增生异常综合征诊断的意义[J].哈尔滨医科大学学报,2009,43(6):600-602.
[16]邱燕,陈俊清.血液病患者骨髓病态巨核细胞分析[J].国际检验医学杂志,2011,32(8):917-918.
[17]Maynadié M,Picard F,Husson B,et al.Immunophenotypic clustering of myelodysplastic syndromes[J].Blood,2002,100(7):2349-2356.
[18]van de Loosdrecht AA,Westers TM,Westra AH,et al.Identification of distinct prognostic subgroups in low- and intermediate-1-risk myelodysplastic syndromes by flow cytometry[J].Blood,2008,111(3):1067-1077.
Study on micromegakaryocytes of patients with myelodysplastic syndrome by flow cytometry*
LiuShuai,CaoZheng,ZhangXiaozhan,YueBaohong△
(DepartmentofCytologyLaboratory,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou,Henan450052,China)
[Abstract]ObjectiveTo setup a measurement of human bone marrow micromegakaryocyte which based on CD41a and PI double-labeled flow cytometric analysis,and study the significance in the diagnosis of MDS.MethodsIn 42 cases of MDS patients,their bone marrow megakaryocytes were obtained by Percoll density gradient separation medium.The megakaryocyte glycoprotein Ⅱb/Ⅲa(CD41a)were marked with fluorescein isothiocyanate through its corresponding monoclonal antibody,and their DNA were marked with PI.Then the megakaryocyte ploidy was analyzed by flow cytometry(FCM).ResultsThe method for micromegakaryocyte identification and analysis was established.In 42 patients with MDS,the detection rate of micromegakaryocyte was 90.5 percent by FCM analysis,but only 54.8 percent by Wright-Giemsa staining test and 64.3 percent by immunohistochemistry,the difference among them was statistically significant(χ2=13.640,P=0.001).The 42 patients with MDS were divided into two groups(low-risk group and high-risk group).The detection rates of micromegakaryocyte were 81.8 percent in low-risk group and 100 percent in high-risk group separately by FCM analysis,the difference was statistically significant(χ2=4.019,P=0.045).ConclusionThe detection rate of micromegakaryocyte by FCM with CD41a and PI double marker is higher than that by cytochemical staining.The detection rate of micromegakaryocyte in the high-risk group is higher than that of the low-risk group,which shows that the detection of micromegakaryocyte is of great significance for MDS prognosis assessment.
[Key words]flow cytometry;myelodyplastic sydrome;megakaryocyte;DNA ploidy;CD41a
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.03.020
*基金项目:国家自然科学基金资助项目(81271911);河南省医学科技攻关项目(201002006)。
作者简介:刘帅(1980-),主管技师,硕士,主要从事白血病发病机制及实验诊断研究。△通讯作者,E-mail:ybh2002@163.com。
[中图分类号]R551.3
[文献标识码]A
[文章编号]1671-8348(2016)03-0351-03
(收稿日期:2015-08-08修回日期:2015-10-16)

