紫杉醇生物合成途径中羟化酶的研究进展
陈清浦,廖卫芳,付春华,2,赵春芳,2,余龙江,2
1 华中科技大学 生命科学与技术学院 生物技术系,湖北 武汉 4300742 华中科技大学 分子生物物理教育部重点实验室,湖北 武汉 430074
紫杉醇生物合成途径中羟化酶的研究进展
陈清浦1,廖卫芳1,付春华1,2,赵春芳1,2,余龙江1,2
1 华中科技大学 生命科学与技术学院 生物技术系,湖北 武汉 430074
2 华中科技大学 分子生物物理教育部重点实验室,湖北 武汉 430074
陈清浦, 廖卫芳, 付春华, 等. 紫杉醇生物合成途径中羟化酶的研究进展. 生物工程学报, 2016, 32(5): 554–564.
Chen QP, Liao WF, Fu CH, et al. Research progress in hydroxylase in taxol biosynthetic pathway. Chin J Biotech, 2016, 32(5): 554–564.
摘 要:紫杉醇是一种从红豆杉植物中提取的具有显著抗癌效果的萜类化合物,但在红豆杉中含量很低,难以满足日益增长的临床需求。近年来,利用合成生物学技术建立新的紫杉醇来源途径已成为研究热点。目前,紫杉醇合成相关酶基因大部分已被克隆和鉴定,但其中羟化酶基因的发现与应用仍是目前研究的热点和难点。本文对紫杉醇生物合成途径研究进展进行了综述,对其中羟化酶的克隆及功能研究体系进行了重点深入分析,最后探讨了本领域未来的研究方向并对其前景进行展望,以期为紫杉醇合成途径中未知羟化步骤的羟化酶基因克隆,以及利用合成生物学技术实现紫杉醇的大量生产提供依据。
关键词:紫杉醇,生物合成,羟化酶,研究进展
Received: September 13, 2015; Accepted: November 13, 2015
Supported by: The Specialized Research Fund for the Doctoral Program of Higher Education (No. 20120142130009), Independent Innovation Fund Project of Huazhong University of Science and Technology (No. 2013TS079).
高等学校博士学科点专项科研基金 (No. 20120142130009),华中科技大学校自主创新基金 (No. 2013TS079) 资助。
紫杉醇是从红豆杉中分离得到的一种萜类化合物,能促进微管形成和稳定,并阻止其解聚,从而达到阻止癌细胞分裂的目的,对乳腺癌、卵巢癌、黑色素瘤等都具有明显疗效[1],市场供需矛盾突出。紫杉醇在红豆杉树皮中的含量最高,也仅为万分之六左右,天然提取导致了红豆杉资源的毁灭性破坏。因此,人们一直在致力于开发获取紫杉醇的新途径。目前,化学合成、化学半合成、植物细胞大规模培养法、内生真菌合成等新途径的探索都相继展开。其中,化学合成途径较早打通,但因其步骤多且收率低没有进一步商业化意义;而化学半合成是以红豆杉枝叶中的10-去乙酰基巴卡亭Ⅲ、巴卡亭Ⅲ等前体通过化学合成得到紫杉醇,由于该途径的本质依然要依赖红豆杉资源,其发展同样受限;红豆杉细胞大规模培养和内生真菌发酵生产紫杉醇是人们一直致力于取得突破的途径,但仍然未取得重大突破。
随着代谢工程尤其是合成生物学新技术的蓬勃发展,青蒿素、人参皂甙等重要天然产物已成功实现异源大量合成[2-3]。Ajikumar等[4]通过多功能模块优化手段在大肠杆菌中实现了紫杉醇重要前体紫杉二烯的高量表达,将利用合成生物学技术大量生产紫杉醇新途径的实现推进了一大步。同时指出紫杉二烯以后的有效羟化反应的解析是当今的研究难点,这也是限制利用合成生物学方式大量生产紫杉醇的瓶颈问题。随着紫杉醇合成途径中相关羟化酶基因的克隆与鉴定,利用合成生物学生产紫杉醇有望取得突破。
本文对紫杉醇合成途径进行了综述,并对其中羟化酶的克隆及功能研究进行了深入探讨,以期为紫杉醇合成途径中紫杉二烯后续的相关羟化酶基因克隆,以及利用合成生物学技术实现紫杉醇的大量生产提供依据。
1 紫杉醇生物合成途径
红豆杉中紫杉醇的生物合成途径分为3个部分 (图1):一是合成萜类化合物的通用前体异戊烯焦磷酸 (IPP) 和甲基丙烯基焦磷酸(DMAPP);二是以GGPPS为起点经过约20步酶促反应合成紫杉醇前体10-去乙酰基巴卡亭Ⅲ (10-deacety baccatin Ⅲ) 或巴卡亭Ⅲ (Baccatin Ⅲ);三是C-13苯基异丝氨酸侧链组装至巴卡亭Ⅲ形成紫杉醇。以上3个部分中,第一部分和第三部分的合成过程及相关酶已基本解析,第二部分的具体过程还未完全清楚。第一部分中,IPP和DMAPP通常可认为是由位于质体的非甲羟戊酸途径 (2-C-甲基-D-赤藓醇-4-磷酸,2-C-methyl-D-eythritol-4-phosphate, MEP) 和位于胞质中的甲羟戊酸 (又名甲瓦龙酸,mevalonic acid, MVA) 途径合成[5]。但对于紫杉醇合成前体的来源还没有定论,仅有用上述2条途径抑制剂分别处理红豆杉细胞后紫杉醇合成均受到抑制的报道[6-7]。MEP和MVA途径中的所有基因在植物中都已被克隆得到。第三部分中,C-13苯基异丝氨酸侧链起源、侧链的连结次序和方式、组装至巴卡亭Ⅲ形成紫杉醇的路径都已清楚,绝大部分相关酶也已被克隆[8-12]。此外,紫杉醇手性侧链合成和紫杉醇的半合成技术已非常成熟[13]。第二部分中,首先是GGPP在紫杉二烯合成酶催化下环化形成紫杉醇的三环二萜骨架结构紫杉4(5), 11(12) 二烯,接着在C1、C2、C4、C5、C7、C9、C10和C13位发生羟基化,羟基上再进行酰基化、酮基化,以及形成环氧丙烷,最终形成巴卡亭Ⅲ[14]。
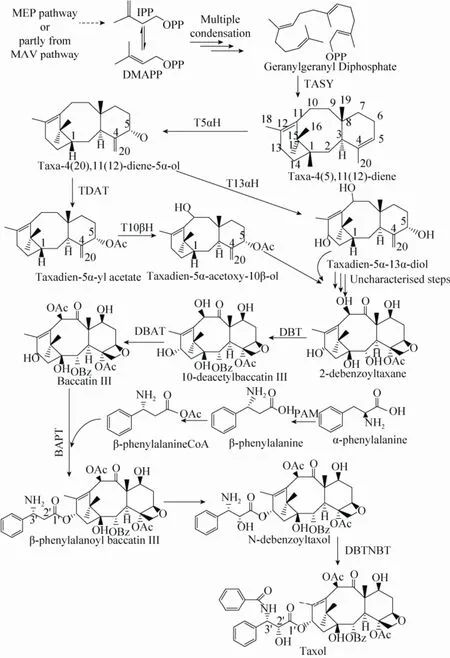
图1 紫杉醇生物合成途径[15,18]Fig. 1 Taxol biosynthetic pathway[15,18]. TASY: taxadiene synthase; T5αH: cytochrome P450 taxadiene-5αhydroxylase; T13αH: taxoid 13α-hydroxylase; TDAT: taxadiene-5α-ol-o-acetyl transferase; T10βH: taxoid 10β-hydroxylase; DBT: 2α-O-benzoyl transferase; DBAT: 10-deacetyl-baccatin III-10-O-acetyl transferase; BAPT: C-13-phenylpropanoyl-CoA transferase; PAM: phenylalanine aminomutase; DBTNBT: 3’-N-debenzoyl-2’-deoxytaxol N-benzoyl transferase.
但紫杉醇的生物合成是一个复杂的代谢网络而非线性途径,第二部分反应中的酶仅有部分已克隆,而且上述8个羟化位点的反应次序以及参与酶的底物特异性仍不明确[15]。现在比较清楚的是首先在C5位上由细胞色素P450单加氧酶催化引入羟基,并发生丙烯基重排,生成紫杉-4(20),11(12)-二烯-5α-醇[16],接着有两种推测反应的报道:一是此萜烯中间体在5α羟基上发生乙酰化反应形成乙酸紫杉-4(20),11(12)-二烯-5α-酯,再在10位上发生羟化;二是此萜烯中间体在13位上发生羟化。对于其他位点C1、C2、C4、C7、C9位发生的羟基化作用,4,5-环氧丙烷环的形成,C2、C5、C10位羟基上的酰基化和C9位的酮基化,以及因中间产物在细胞器之间运输而被暂时酰基化和去酰基化反应发生的顺序尚不明确[17-18]。且有三步反应C1位、C4位和C9位的羟化酶基因至今尚未见报道[19]。因此,紫杉醇生物合成途径中的细胞色素P450羟化酶的进一步研究,将有助于利用合成生物学手段大量获得紫杉醇的实现。
2 紫杉醇生物合成相关的羟化酶的鉴定及特征分析
细胞色素P450 (Cytochrome P450,P450s)是一类在动物、植物、细菌及真菌中拥有广泛功能的含有血红素的氧化酶类,其还原型与CO结合后在波长450 nm处有最大吸收峰,因此命名为细胞色素P450。P450自1969年首次发现至今,已有超过69 000篇关于其研究的文章发表,1 091个不同家族的基因被挖掘。细胞色素P450在植物体内主要有两大功能:参与次级代谢物(萜类、植物激素、甾醇、黄酮等) 的生物合成;降解外源有毒物质如农药、除草剂等[20-22]。
紫杉醇合成过程中,其母核紫杉二烯需经8个碳位的有效羟化,分别是C1位、C2位、C4位、C5位、C7位、C9位、C10位、C13位,其中部分碳位的羟化酶基因已被克隆验证。Eisenreich等[23]证实紫杉烷环上的所有羟基化反应均由依赖细胞色素P450的单加氧酶类催化完成。本文对这些羟化酶基因的克隆及功能研究进行了综述,以期为新的羟化酶基因的挖掘提供依据。
2.1紫杉烷5α-羟化酶
Jennewein等[24]基于PERF模体、血红素结合元件、必有半胱氨酸等保守特征,采用同源克隆的方法从诱导过的红豆杉细胞文库中得到候选基因,并在酿酒酵母WAT11菌株中异源表达进行功能研究。WAT11菌株拥有1个来源于拟南芥的CPR基因,完善了电子传递系统,可使植物P450高效表达并具有好的催化活性。通过体内饲喂的方法添加系列外源底物研究酶活性,发现只有两种紫杉烯异构体底物转化成了极性化合物,90%以上产物是5α-羟基-紫杉二烯。紫杉烷-5α-羟基化酶在紫杉醇母核骨架C5位置特异性地加入一个羟基,同时催化C4(5)的双键转移到C4(20) 位置上,从而将紫杉-4(5), 11(12)-二烯羟化为5α-羟基-紫杉-4(20),11(12)-二烯。
2.2紫杉烷10β-羟化酶与紫杉烷13α-羟化酶
由于反向基因克隆获取P450基因的可行性有限,研究者们利用诱导处理的红豆杉细胞为材料,发展了一种基于mRNA反转录PCR差异显示 (DD-RT-PCR) 的方法,得到了13个与P450相关的特定全长序列[25]。将这些基因在酵母中异源表达,结合原位分光光度法和体内饲喂紫杉烷类底物来研究酶活性,成功发掘了系列紫杉类代谢酶以及一个紫杉烷10β-羟化酶。在紫杉烷10β-羟化酶的研究中,候选基因酵母表达后饲喂5α-乙酰氧基-紫杉-4(20),11(12)-二烯,10β-羟化酶能将其转化为5α-乙酰氧基-10β-羟基-紫杉-4(20),11(12)-二烯。
采取同样的方法,酵母异源表达并未成功筛选出紫杉烷13α-羟化酶。研究者们改用草地夜蛾杆状病毒系统表达,以5α-羟基-紫杉二烯及其乙酸酯为饲喂底物,据相应的重组酶催化产品的色谱及光谱学特性成功鉴定到一个紫杉烷13α-羟化酶基因。该酶具有高度的区域特异性和立体结构特异性,只催化5α-羟基-紫杉-4(20),11(12)-二烯反应生成5α,13α-二羟基-紫杉-4(20),11(12)-二烯[26]。
2.3紫杉烷2α-羟化酶和紫杉烷7β-羟化酶
由于羟化顺序尚未精确鉴定,使得紫杉醇生物合成中间羟化步骤难以解析,同时,高度官能团化的紫杉烷底物较难获取,阻碍了羟化酶的研究进展。研究者选用支流紫杉烷作为替代底物,如紫杉素 (5α, 9α, 10β, 13α-四乙酰氧基-紫杉-4(20),11(12)-二烯),用以研究紫杉烷2α-羟化酶和紫杉烷7β-羟化酶,具体研究方法类5α-羟化酶的研究体系[27-28]。
紫杉烷2α-羟化酶和紫杉烷7β-羟化酶两者都能利用紫杉素作为底物,而且能互相将各自的羟基化物氧化,获得同一个产物2α, 7β-二羟基-紫杉素。
2.4紫杉烷9α-羟化酶
紫杉烷9α-羟化酶候选基因曾在酵母中表达并以5a-乙酰氧基-紫杉-4(20),11(12)-二烯为底物进行研究,但产物NMR检测并未得阳性结果,当时认为是产物合成不足所致,也有可能是表达体系不当或者酶底物特异性较高 (底物使用不准确) 等原因。Dai等[29]发现银杏悬浮细胞可催化2α, 5α,10β, 14β-四乙酰氧基-紫杉-4(20),11(12)-二烯 (Sinenxan A,缩写SIA) 形成9α-羟基-SIA。2013年,Zhang等[30]从银杏转录组中找到候选基因 (KF773141),体外表达蛋白并以SIA为底物成功验证出该酶具有上述的C-9位羟化活性,该基因全长1 458 bp,编码485个氨基酸,蛋白分子量54.841 9 kDa,拥有细胞色素P450典型保守特征。
2.5紫杉烷14β-羟化酶
Jennewein等[31]克隆验证的紫杉烷14β-羟化酶能使5α-乙酰氧基-10β-羟基-紫杉-4(20),11(12)-二烯转化生成5α-乙酰氧基-10β,14β-二羟-紫杉-4(20),11(12)-二烯,但对5α,13α-二羟基-紫杉-4(20),11(12)-二烯没有作用。紫杉烷14β-羟化酶基因在红豆杉诱导cDNA文库中丰度较高 (1.5‰),考虑到在紫杉烷的结构中,14位并没有被氧化,因此,推断该酶并未参与紫杉醇生物合成,但参与紫杉烷类的支路合成途径,作用于早期代谢分支流向14β-羟基-紫杉烷 (如云南紫杉烷C),而这类紫杉烷在红豆杉细胞紫杉烷提取物中占主要成分,抑制该酶活性或许可以增加紫杉醇代谢流。
综上可以看出,紫杉醇生物合成过程中的羟化酶研究已取得一些进展,已克隆了5位、2位、7位、10位、13位羟化酶基因,同时建立了体外表达细胞色素P450中的氧化酶并实现相应底物的不同位点的羟基化的研究体系,为进一步研究这些羟化酶的羟化顺序及对应的特异性羟化酶打下了基础,同时为进一步挖掘新的羟化酶提供了线索。但目前GenBank中登录的紫杉烷羟化酶全长基因有18个,催化C5位的羟化酶有4个,C2位的2个,C7位的4个,C10位的4个,C13位的4个,但上述催化同一位点的羟化酶中哪个效率最高,未见系统研究。另外,关于紫杉醇合成过程中羟化酶基因的作用顺序,比较肯定的是在紫杉二烯形成之后,首先C5位进行羟化,之后的顺序仅Wheeler等[32]根据红豆杉细胞内合成的紫杉烷的数量,推测紫杉烷母核发生羟化的可能顺序是C10,接着是C2和C9,之后是C13,最后是C7和C1。因此,除C5位紫杉二烯羟化在其他各位点羟化之前已确定外,其他位点的羟化顺序及对应的特异性羟化酶尚不清楚,有待进一步研究,而获得全面的羟化酶序列是开展此研究的前提。
2.6紫杉醇生物合成相关的P450羟化酶特征分析
本课题组前期利用RNA-seq技术对红豆杉细胞进行转录组测序分析,共发现了266个细胞色素P450酶基因序列,大部分植物中独有的CYP亚家族均有发现。为从中筛选挖掘新的候选羟化酶,对已克隆的C2、C5、C7、C10和C13位羟化酶特征进行了分析,发现这些羟化酶基因均存在细胞色素P450典型保守特征 (表1),如:分子量约54–57 kDa,血红素结合域PFG(第420个氨基酸左右),氧化还原结合模体PERF或PSRF (第410个氨基酸左右),必有半胱氨酸C (第440个氨基酸),EXXR盐桥 (第360个氨基酸左右)。据此,对266个片段进行亚家族分类,共发现归属于CYP716和CYP725亚家族的基因片段共有35个,包括了GenBank中登录的18个全长基因及17个未知功能的CYP450家族基因,为筛选紫杉醇母核有效羟化位点的特异羟化酶基因打下了基础。
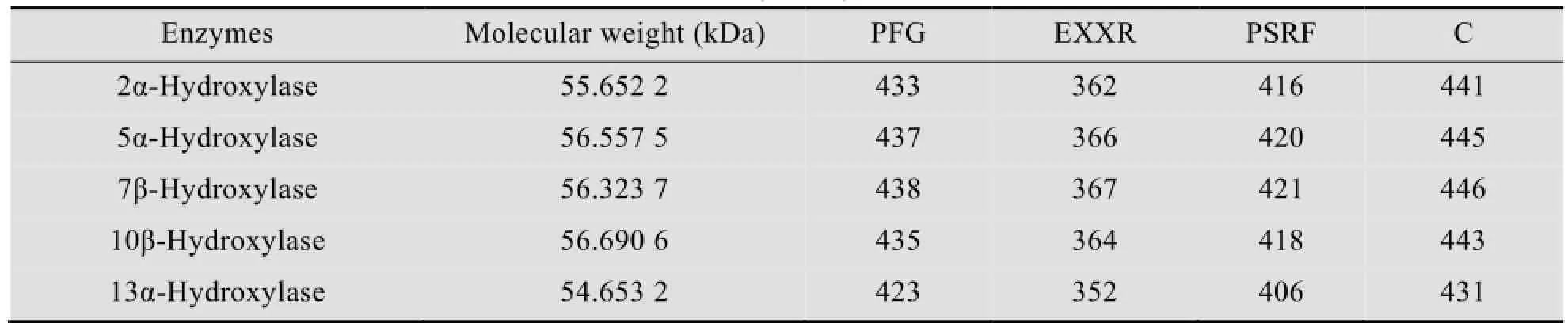
表1 已知紫杉烷羟化酶的保守特征Table 1 The conservative feature of known taxane hydroxylase
3 P450羟化酶功能研究体系
细胞色素P450羟化酶基因功能研究时,常用原核表达系统和真核表达系统进行异源表达获得有活性蛋白,进而采用体外反应体系进行功能验证。现对不同表达体系的特征、适应性、注意事项综述如下,为P450羟化酶基因的表达及功能研究提供依据。
3.1原核表达系统
原核表达宿主大肠杆菌的遗传背景清楚,具有周期短、操作方便、表达水平高和成本较低等优点,是表达外源蛋白使用最多的底盘细胞[33-34]。许多研究利用该系统成功对系列P450羟化酶进行表达,获得了有活性的蛋白。Barnes研究组首次成功用E. coli表达出有催化活性的CYP17A1,为P450在细菌中的表达奠定了基础[35];Sueyoshi等[36]在E. coli中成功表达出小鼠CYP2A4蛋白;此外,人类基因组中发现的57种P450酶中有接近一半 (26种) 在大肠杆菌中成功表达,部分蛋白已用X射线晶体学确定其三维结构,该系列工作有利于指导异源表达策略的研究。但是原核表达系统的产物往往不能有效地加工和修饰,从而影响了表达产物的结构与功能,表达的蛋白活性降低甚至没有活性。此外大肠杆菌产生的内毒素也会导致目标蛋白表达不成功。研究者们通常对其cDNA进行适当的修饰,如:末端修饰,密码子替换等,来避免这些缺点[37-39]。近年来,利用大肠杆菌生物合成紫杉醇的研究取得了一定进展。通过优化启动子、增加相关基因的拷贝数、模块多元化等策略,成功在大肠杆菌中过量表达紫杉二烯合成酶和紫杉烷5α-羟化酶,紫杉二烯和5α-羟基-紫杉二烯的产量分别达到1.02 g/L和58 mg/L[4]。
3.2真核表达系统
真核表达系统包括酵母、昆虫和哺乳动物细胞等,具有翻译后的加工修饰体系,表达的外源蛋白构象上更接近天然蛋白质,但又有蛋白表达成本高、操作复杂、表达量较低等缺点[40-43]。酵母具有十分完整的细胞、亚细胞结构 (例如内质网等),其内源的CPR可以支持电子向P450传送,对P450酶的功能鉴定具有十分重要的作用。此外,酵母有多个选择标记和营养缺陷型可供选择[44-46]。目前已有小鼠、大鼠以及人的若干P450酶在酵母中表达;在已报道的紫杉醇生物合成细胞色素P450羟化酶中,大部分候选基因均通过酵母表达并具有酶活性;昆虫细胞系统具有能较为正确的进行蛋白糖基化、分泌和组织定位表达、蛋白表达量较高等特点,如CYP2C9在昆虫细胞表达系统中表达蛋白的活性比在人淋巴细胞中表达的活性提高7或8倍[47]。哺乳动物细胞的CYP本底含量高,重组蛋白表达量相对较低,但细胞中含有辅助因子CPR和细胞色素B5等,已被用于表达CYP蛋白的哺乳动物细胞系种类广泛,如人细胞系、小鼠细胞系Hepalclc,BALB3T3等、大鼠细胞系RLE(肝上皮细胞系) 和PC-12 (肾上腺嗜铬细胞瘤细胞系) 等[48]。这些研究为新的细胞色素P450酶的克隆与表达提供了线索。
在紫杉醇生物合成相关的P450酶研究中,除了克隆验证出5个碳位对应的酶基因外,也有研究者对紫杉烯羟化物的异源合成进行了探索。Dejong等[49]在酵母细胞中表达了紫杉醇生物合成相关的8个基因,紫杉烯的产量为1 mg/L,而5α-羟基紫杉二烯的产量仅可检测,说明细胞色素P450 5α-羟基化酶活性为代谢瓶颈。Ajikuma等[4]在已构建的产紫杉二烯大肠杆菌工程菌基础上,通过多功能模块工程手段构建了紫杉烯 5α-羟基化酶和细胞色素P450-还原酶的融合基因,5α-羟基-紫杉二烯的产量达
58 mg/L,是酵母表达系统的2 400倍。近来,该实验室开发了一种大肠杆菌与酵母工程菌共培养合成紫杉醇的技术,发现将含有紫杉烷5α-羟化酶及其还原酶基因CPR的酵母与含有紫杉二烯合成酶基因 (TS) 的大肠杆菌共培养72 h后,5α-羟基-紫杉二烯的产量为2 mg/L。他们对该共培养体系进行了进一步优化,使得5α-羟基-紫杉二烯的产量提高到了33 mg/L。而再向该共培养体系的酵母工程菌中引入5α-羟基-紫杉二烯乙酰基转移酶基因 (Taxadien-5α-olacetyltransferase gene) 和紫杉烷 10β-羟化酶基因共培养后,每升培养物中5α-乙酰氧基-10β-羟基-紫杉二烯 (Taxadien-5α-acetate-10β-ol) 的产量达到了30 mg/L[50]。这些研究为体外研究羟化酶的羟化顺序及特异性提供了参考。
4 展望
不同碳位羟化酶的典型保守特征、底物特异性的差别、酶促形式和酶促活性的不同,反映出紫杉醇生物合成独有羟化酶亚家族(CYP725) 的多面性。整个紫杉醇生物合成羟化酶的发掘历程闪耀着研究者们的智慧光芒,同源克隆与mRNA差异显示反转录PCR等基因克隆策略的运用,酵母或草地夜蛾杆状病毒等酶蛋白表达系统的利用,以及替代底物的使用,大大丰富了羟化酶研究的理念,亦为紫杉醇其余碳位羟化酶的克隆及功能验证夯实了基础。
紫杉烷羟化酶的研究虽然已取得了一些进展,但由于其分布广泛性和功能多样性,以及缺乏现成的反应底物,使得彻底解析紫杉醇生物合成的羟化步骤仍然是一个巨大挑战。在未来的研究中,我们可以从两方面入手:1) 对酿酒酵母WAT11上游代谢途径进行改造,提高紫杉二烯的产量。然后在该酵母菌株中导入相关的羟化酶基因,诱导培养后,检测产物的结构,从而确定该羟化酶基因的功能。2) 将羟化酶基因在酿酒酵母WAT11中异源表达,喂食可获得的紫杉烷类物质,诱导培养,再通过液质联用(LC-MS),核磁共振 (NMR) 检测物质结构的变化反映该基因的功能。
随着转录组测序技术的兴起,生物信息学方法的日益成熟,酶学理念的完善以及其他相关生物学科的发展,将加速紫杉醇有效羟化步骤的解析。本课题组从红豆杉细胞转录组中筛选获得了系列紫杉醇母核有效羟化的细胞色素P450氧化酶候选基因,并克隆获得了4个新的候选基因[51]。课题组的下一步研究思路是利用无细胞体系对羟化酶功能及羟化顺序进行研究,具体是先将紫杉二烯合成酶与5-羟紫杉二烯酶基因共转化酵母,体系中添加GGPP底物合成5-羟基-紫杉二烯;利用酵母分别构建并表达其他羟化酶;再采用单独或组合的羟化酶无细胞体系对5-羟基-紫杉二烯进行催化,通过产物确认位点特异性羟化酶及其催化顺序;再进一步优化不同羟化酶组合模块,在酵母中实现紫杉醇母核的有效羟化,为最终合成有效酰化紫杉烷奠定坚实基础。相信在不久的将来,紫杉醇生物合成的整个途径会得到彻底的攻破,实现产业化不是梦。
REFERENCES
[1] De Furia MD. Paclitaxel (Taxol): a new natural product with major anticancer activity. Phytomedicine, 1997, 4(3): 273–282.
[2] Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940–943.
[3] Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast. Cell Res, 2014, 24(6): 770–773.
[4] Ajikumar PK, Xiao WH, Tyo KEJ, et al. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70–74.
[5] Roberts SC. Production and engineering of terpenoids in plant cell culture. Nat Chem Biol, 2007, 3(7): 387–395.
[6] Liu Z, Yu LJ, Li CY, et al. Effects of fosmidomycin and lovastatin treatment on taxol biosynthesis in suspension culture cells of Taxus chinensis. J Plant Physiol Mol Biol, 2005, 31(2): 199–204 (in Chinese).刘智, 余龙江, 李春艳, 等. 磷甘霉素和洛伐它汀处理对中国红豆杉悬浮培养细胞生物合成紫杉醇的影响. 植物生理与分子生物学学报, 2005, 31(2): 199–204.
[7] Malik S, Cusidó RM, Mirjalili MH, et al. Production of the anticancer drug taxol in Taxus baccata suspension cultures: a review. Process Biochem, 2011, 46(1): 23–34.
[8] Fleming PE, Mocek U, Floss HG. Biosynthesis of taxoids. Mode of formation of the taxol side chain. J Am Chem Soc, 1993, 115(2): 805–807.
[9] Walker KD, Floss HG. Detection of a phenylalanine aminomutase in cell-free extracts of Taxus brevifolia and preliminary characterization of its reaction. J Am Chem Soc, 1998, 120(21): 5333–5334.
[10] Miller RW. A brief survey of Taxus alkaloids and other taxane derivatives. J Nat Prod, 1980, 43(4): 425–437.
[11] Guéritte-Voegelein F, Guénard D, Potier P. Taxol and derivatives: a biogenetic hypothesis. J Nat Prod, 1987, 50(1): 9–18.
[12] Fleming PE, Knaggs AR, He XG. Biosynthesis of taxoids. Mode of attachment of the taxol side chain. J Am Chem Soc, 1994, 116(9): 4137–4138.
[13] Yan JQ. Chiral synthesis of the taxol side chain and semisynthesis of taxol. Fine Spec Chem, 2005, 13(18): 1–6 (in Chinese).阎家麒. 紫杉醇手性侧链合成与紫杉醇半合成. 精细与专用化学品, 2005, 13(18): 1–6.
[14] Croteau R, Hefner J, Hezari M. Phytochemicals and health. Curr Top Plant Physiol, 1995, 15: 95–104. [15] Croteau R, Ketchum REB, Long RM, et al. Taxol biosynthesis and molecular genetics. Phytochem Rev, 2006, 5(1): 75–97.
[16] Hefner J, Rubenstein SM, Ketchum REB, et al. Cytochrome P450-catalyzed hydroxylation of taxa-4(5), 11(12)-diene to taxa-4(20), 11(12)-dien-5α-ol: the first oxygenation step in taxol biosynthesis. Chem Biol, 1996, 3(6): 479–489.
[17] Walker K, Ketchum REB, Hezari M, et al. Partial purification and charaterization of acetyl coenzyme A: taxa-4 (20), 11(12)-dien-5α-ol-O-acetyl transferase that catalyzes the first acytation step of taxol biosynthesis. Arch Biochem Biophys, 1999, 364: 273–279.
[18] Howat S, Park B, Oh IS, et al. Paclitaxel: biosynthesis, production and future prospects. New Biotechnol, 2014, 31(3): 242–245.
[19] Qiu DY, Zhang B, Yang YF, et al. History, current status and the prospects of taxol biosynthesis research. Biotechnol Bull, 2015, 31(4): 56–64 (in Chinese).邱德有, 张彬, 杨艳芳, 等. 紫杉醇生物合成研究历史、现状及展望. 生物技术通报, 2015, 31(4): 56–64.
[20] Omura T. Forty years of cytochrome P450. Biochem Biophys Res Commun, 1999, 266(3): 690–698.
[21] Schuler MA, Werck-Reichhart D. Functionalgenomics of P450s. Annu Rev Plant Biol, 2003, 54(1): 629–667.
[22] Nelson DR, Ming R, Alam M, et al. Comparison of cytochrome P450 genes from six plant genomes. Trop Plant Biol, 2008, 1(3/4): 216–235.
[23] Eisenreich W, Menhard B, Lee MS. Multiple oxygenase reactions in the biosynthesis of taxoids. J Am Chem Soc, 1998, 120(37): 9694–9695.
[24] Jennewein S, Long RM, Williams RM, et al. Cytochrome P450 taxadiene 5α-hydroxylase, a mechanistically unusual monooxygenase catalyzing the first oxygenation step of taxol biosynthesis. Chem Biol, 2004, 11(3): 379–387.
[25] Schoendorf A, Rithner CD, Williams RM, et al. Molecular cloning of a cytochrome P450 taxane 10β-hydroxylase cDNA from Taxus and functional expression in yeast. Proc Natl Acad Sci USA, 2001, 98(4): 1501–1506.
[26] Jennewein S, Rithner CD, Williams RM, et al. Taxol biosynthesis: taxane 13α-hydroxylase is a cytochrome P450-dependent monooxygenase. Proc Natl Acad Sci USA, 2001, 98(24): 13595–13600.
[27] Chau M, Croteau R. Molecular cloning and characterization of a cytochrome P450 taxoid 2α-hydroxylase involved in taxol biosynthesis. Arch Biochem Biophys, 2004, 427(1): 48–57.
[28] Chau M, Jennewein S, Walker K, et al. Taxol biosynthesis: molecular cloning and characterization of a cytochrome P450 taxoid 7β-hydroxylase. Chem Biol, 2004, 11(5): 663–672.
[29] Dai JG, Guo HZ, Lu DD, et al. Biotransformation of 2α, 5α, 10β, 14β-tetra-acetoxy-4(20), 11-taxadiene by Ginkgo cell suspension cultures. Tetrahedron Lett, 2001, 42(28): 4677–4679.
[30] Zhang N, Han ZT, Sun GL, et al. Molecular cloning and characterization of a cytochrome P450 taxoid 9α-hydroxylase in Ginkgo biloba cells. Biochem Biophys Res Commun, 2014, 443(3): 938–943.
[31] Jennewein S, Rither CD, Williams RM, et al. Taxoid metabolism: taxoid 14β-hydroxylase is a cytochrome P450-dependent monooxygenase. Arch Biochem Biophys, 2003, 413(2): 262–270.
[32] Wheeler AL, Long RM, Ketchum REB, et al. Taxol biosynthesis: differential transformations of taxadien-5α-ol and its acetate ester by cytochrome P450 hydroxylases from Taxus suspension cells. Arch Biochem Biophys, 2001, 390(2): 265–278.
[33] Friedberg T, Pritchard MP, Bandera M, et al. Merits and limitations of recombinant models for the study of human P450-mediated drug metabolism and toxicity: an intra-laboratory comparison. Drug Metab Rev, 1999, 31(2): 523–544.
[34] Wang JM, Liu W, Xu X, et al. Progress in engineering Escherichia coli for production of high-value added organic acids and alcohols. Chin J Biotech, 2013, 29(10): 1363−1373 (in Chinese).王纪明, 刘炜, 徐鑫, 等. 工程大肠杆菌生产高附加值有机酸、醇研究进展. 生物工程学报, 2013, 29(10): 1363–1373.
[35] Barnes HJ, Arlotto MP, Waterman MR. Expression and enzymatic activity of recombinant cytochrome P450 17 alpha-hydroxylase in Escherichia coli. Proc Natl Acad USA, 1991, 88(13): 5597-5601.
[36] Sueyoshi T, Park LJ, Moore R, et al. Molecular engineering of microsomal P450 2a-4 to a stable, water-soluble enzyme. Arch Biochem Biophys, 1995, 322(1): 265−271.
[37] Zhu LQ, Lou JS. Resent studies on cytochrome P450 and drug metabolism. Chin J Clin Pharmacol Ther, 2004, 9(10): 1081–1086 (in Chinese).朱立勤, 娄建石. 细胞色素P450与药物代谢的研究现状. 中国临床药理学与治疗学, 2004, 9(10): 1081–1086.
[38] Sandhu P, Baba T, Guengerich FP. Expression of modified cytochrome P450 2C10 (2C9) in Echerichia coli, purification, and reconstitution of catalytic activity. Arch Biochem Biophys, 1993, 306(2): 443–450.
[39] Larson JR, Coon MJ, Porter TD. Alcohol-inducible cytochrome P-450IIE1lacking the hydrophobic NH2-terminal segment retains catalytic activity and is membrane-bound when expressed in Escherichia coli. J Biol Chem, 1991, 266(12): 7321–7324.
[40] Gellissen G, Janowicz ZA, Merkelbach A. Heterologous gene expression in Hansenula polymopha: efficient secretion glucoamylase. Nat Biotechnol, 1991, 9(3): 291–295.
[41] Li XY, Zhang JB, Ren WZ, et al. Application of yeast two-hybrid system in protein interaction. J Tradit Chin Vet Med, 2011, 30(1): 26–28 (in Chinese).李向阳, 张嘉保, 任文郅, 等. 酵母双杂交系统在蛋白质相互作用中的应用. 中兽医医药杂志, 2011, 30(1): 26–28. .
[42] Hitchman RB, Possee RD, Crombie AT, et al. Genetic modification of a baculovirus vector for increased expression in insect cells. Cell Biol Toxicol, 2010, 26(1): 57–68.
[43] Soler E, Saux AL, Guinut F, et al. Production of two vaccinating recombinant rotavirus proteins in the milk of transgenic rabbits. Transgenic Res, 2005, 14(6): 833–844.
[44] Julsing MK, Koulman A, Woerdenbag HJ, et al. Combinatorial biosynthesis of medicinal plant secondary metabolites. Biomol Eng, 2006, 23(6): 265–279.
[45] Chemler JA, Yan YJ, Koffas MA. Biosynthesis of isoprenoids, polyunsaturated fatty acids and flavonoids in Saccharomyces cerevisiae. Microb Cell Fact, 2006, 5(1): 20–28.
[46] Wang W, Meng C, Zhu P, et al. Preliminary study on metabolic engineering of yeast for producing taxadiene. China Biotechnol, 2005, 25(8): 103–108 (in Chinese).王伟, 孟超, 朱平, 等. 代谢工程酵母菌合成紫杉烯的研究. 中国生物工程杂志, 2005, 25(8): 103–108.
[47] Grogan J, Shou MG, Andrusiak EA, et al. Cytochrome P450 2A1, 2E1, and 2C9 cDNA-expression by insect cells and partial purification using hydrophobic chromatography. Biochem Pharmacol, 1995, 50(9): 1509–1515.
[48] Sawada M, Kamataki T. Genetically engineered cells stably expressing cytochrome P450 and their application to mutagen assays. Mutat Res, 1998, 411(1): 19–43.
[49] Dejong JM, Liu YL, Bollon AP, et al. Genetic engineering of taxol biosynthetic genes in Saccharomyces cerevisiae. Biotechnol Bioeng, 2006, 93(2): 212–224.
[50] Zhou K, Qiao KJ, Edgar S, et al. Distributing a metabolic pathway among a microbial consortium enhances production of natural products. Nat Biotechnol, 2015, 33(4): 377–383.
[51] Chen QP. Cloning and function analysis of new hydroxylase in Taxus chinensis[D]. Wuhan: Huazhong University of Science and Technology, 2015 (in Chinese).陈清浦. 中国红豆杉中新的羟化酶基因克隆与功能分析[D]. 武汉: 华中科技大学, 2015.
(本文责编 郝丽芳)
Research progress in hydroxylase in taxol biosynthetic pathway
Qingpu Chen1, Weifang Liao1, Chunhua Fu1,2, Chunfang Zhao1,2, and Longjiang Yu1,2
1 Department of Biotechnology, College of Life Science and Technology, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China
2 Key Laboratory of Molecular Biophysics Ministry of Education, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China
Abstract:Taxol is a secondary metabolite with prominent anti-tumor activity, but the yield cannot meet the growing clinical demand due to lower content in yew. Now, most enzyme genes involved in taxol biosynthesis have been cloned andidentified, so that obtaining this drug by using synthetic biology method has become a hotspot in recent years. However, most hydroxylases involved in taxol biosynthetic pathway have not been explored. Here, we reviewed the progress on the biosynthesis pathway of taxol, especially concerning hydroxylase. The future research areas of taxol biosynthesis through synthetic biology were also discussed to provide basis for the discovery of uncharacterized hydroxylase genes and the mass taxol production by synthetic biology technology.
Keywords:taxol, biosynthesis, hydroxylase, research progress
Corresponding author:Longjiang Yu. Tel: +86-27-87792264; Fax: +86-27-87792265; E-mail: yulongjiang@hust.edu.cn

