海南4个地区暹罗炭疽菌群体遗传结构分析
蒋仕强 李杨 周国英 刘君昂 万智 蒋越西 李河


摘 要 对分离自海南4个地区13种寄主植物上暹罗炭疽菌的ITS-CAL-GAPDH 3基因序列进行群体遗传结构分析。95条暹罗炭疽菌多基因序列可定义为16个单倍型,其中,单倍型H5为主要单倍型,分布于所有寄主植物。AMOVA分析显示,遗传变异主要发生在种群内;病菌未经历过大规模的种群扩张过程。研究结果表明,暹罗炭疽菌种群具有丰富的遗传多样性。
关键词 暹罗炭疽菌;寄主植物;多基因序列;群体遗传结构
中图分类号 S432.4 文献标识码 A
炭疽菌属(Colletotrichum Corda)真菌是一类全球性分布的植物病原菌,尤其是在热带、亚热带地区,可侵染油茶(Camellia oleifera)、辣椒(Capsicum annuum)、苹果(Malus domestica)、山茶(Camellia sinensis)、檀香(Santalum albumL.)等多种植物[1-3],导致植物落叶、落果,甚至枯死,造成重大经济损失。暹罗炭疽菌(C. Siamense)是胶孢炭疽菌(C. Gloeosporioides)复合种之一,最早在泰国咖啡上被发现可引起咖啡炭疽病[4];韩永超等[5]发现C. siamense可引起武汉地区草莓炭疽病;李河等[3]从湖南、广西等地区油茶树上采集炭疽病样品,通过病菌分离鉴定,发现C. siamense为油茶炭疽病病原之一。
目前国内外对Colletotrichum siamense的研究仅限于种的鉴定,而对其遗传结构进行分析可为弄清该病菌进化历程提供理论依据。由于海南岛独特的热带季风气候,非常适合炭疽病菌的生长繁殖,近年来油茶在海南地区大面积种植,油茶林中杂草、灌木等植物种类较多,炭疽病害越来越严重。本研究从海南4个地区油茶林中采集油茶及其他寄主植物炭疽病样品,并利用ITS-CAL-GAPDH 3基因序列对不同寄主来源的暹罗炭疽菌的群体遗传结构进行分析,以期从分子水平弄清海南地区不同寄主上暹罗炭疽菌种群的遺传变化规律,这对于阐明该病害流行机制具有重要的意义。
1 材料与方法
1.1 材料
菌株来源:样品采自海南省五指山市南圣镇、通什镇、屯昌县枫木林场和澄迈林场4个样地,寄主植物包括油茶(Camellia oleifera)、桃花心木(Khaya senegalensis)、羊蹄甲(Bauhinia purpurea)、石楠(Photinia serrulata)、山麻杆(Alchornea davidii)、香樟(Cinnamomum camphora)、黄兰(Michelia champaca)、檵木(Loropetalum chinensis)、鲫鱼胆(Maesa perlarius)、山矾(Symplocos caudata)、茶树(Camellia sinensis)、檀香(Santalum album)和葛根(Pueraria lobata)共13种植物。病原菌分离方法参考方中达[6]的组织分离法,从病健交界处组织进行分离,于PDA培养基纯化培养后4 ℃冰箱保存备用。经回接实验、形态观察和多基因分子鉴定,确定了95株暹罗炭疽菌。本实验寄主来源及菌株数量等信息见表2。
1.2 方法
1.2.1 菌株DNA提取 用灭菌牙签刮取0.5 g菌丝,使用DNA快速提取试剂盒提取DNA,提取方法参见说明书,-20 ℃保存。
1.2.2 基因选择、PCR扩增及测序 基因选择及目的片段扩增与测序参照Weir等[7]的方法、反应体系及条件。对所有分离筛选获得的菌株,选择核糖体转录间隔区(internal transcribed spacers,ITS)、钙调蛋白基因(calmodulin,CAL)和甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)进行扩增。相应的PCR扩增引物和退火温度见表1。PCR反应产物测序由上海铂尚生物技术有限公司完成。
1.3 数据分析
DNA序列采用BioEdit软件[8]进行编辑加工并辅以手工调整。使用MEGA6.0软件对核苷酸组成、变异位点等信息进行分析。不同寄主炭疽病菌群体的ITS-CAL-GAPDH单倍型分析利用软件GenALEx6完成,同时对不同群体的单倍型多样性进行分析。运用DnaSP5.0软件[9]计算暹罗炭疽菌3个基因拼接序列的核苷酸多样性(nucleotide diversity,Pi)、不同寄主群体间遗传分化指数(fixation index,FST)及对所有病菌群体序列的单倍型错配进行分析;使用TCS1.21软件[10]构建暹罗炭疽菌单倍型的网络图。采用MEGA 6.0软件构建系统发育树:将依据ITS-CAL-GAPDH 3个基因推导出的单倍型序列与GenBank中炭疽属真菌菌株的ITS-CAL-GAPDH 3个基因序列进行分析比对,构建近邻归群(neighbor-joining,NJ)系统发育树,利用自展法(Bootstrap,1 000次重复)检验各分支的置信度[11]。
2 结果与分析
2.1 暹罗炭疽菌单倍型分布及其多样性
ITS-CAL-GAPDH 3个基因拼接序列共1 385个碱基,核苷酸组成分析表明:A+T含量46.0%略低于C+G含量54.0%;共发现28个变异位点,其中,简约信息位点25个,单突变位点3个;95条暹罗炭疽菌ITS-CAL-GAPDH 3个基因序列定义了16种单倍型,各单倍型在不同种群中的分布见表2。在所有单倍型中,单倍型H5为主要单倍型,分布于所有寄主植物,占总序列数量的66.3%,结果表明种群间存在基因交流。此外,油茶上含有单倍型最多,含有6种单倍型,而檀香与檵木含有单倍型的数量最少,仅有1种单倍型。多种寄主均含有自己独特的单倍型,如鲫鱼胆含有H11,山麻杆含有H6,油茶含有H15等,这表明每个群体内存在独立进化,群体间存在一定程度的遗传分化。
暹罗炭疽菌不同种群的单倍型多样性见表2,除檀香及檵木病菌样品只有1种单倍型,单倍型多样性为0外,其他种群的单倍型多样性在0.245~0.667之间,其中黄兰及香樟病菌样品的单倍型多样性最高,均为0.667;山麻杆病菌样品的单倍型多样性最低,为0.245。暹罗炭疽菌的ITS-CAL-GAPDH 3个基因拼接后核苷酸多样性(Pi)也处于较高水平(表2),除檀香及檵木种群的Pi为0外,其他11个种群的Pi在0.000 21~0.001 25之间。结果表明,暹罗炭疽菌在海南多种寄主上具有丰富的遗传多样性。
2.2 单倍型网络分析及种群扩张分析
由病菌ITS-CAL-GAPDH 3个基因拼接序列单倍型网络结构图(图1)可知,暹罗炭疽菌各单倍型并未依寄主植物形成各自的分支,而是以单倍型H5为辐射中心,呈现出一个非典型星状发散图,H5可能为原始单倍型。从图中还可以看出大部分单倍型通过一次或数次突变与原始单倍型H5相连。此外,由暹罗炭疽菌不同种群3基因拼接序列的核苷酸不配对分布图(图2)可知,分布曲线呈单峰曲线,说明海南地区不同寄主上暹罗炭疽菌可能经历过种群扩张或“瓶颈效应”。
2.3 不同寄主种群暹罗炭疽菌的AMOVA分析
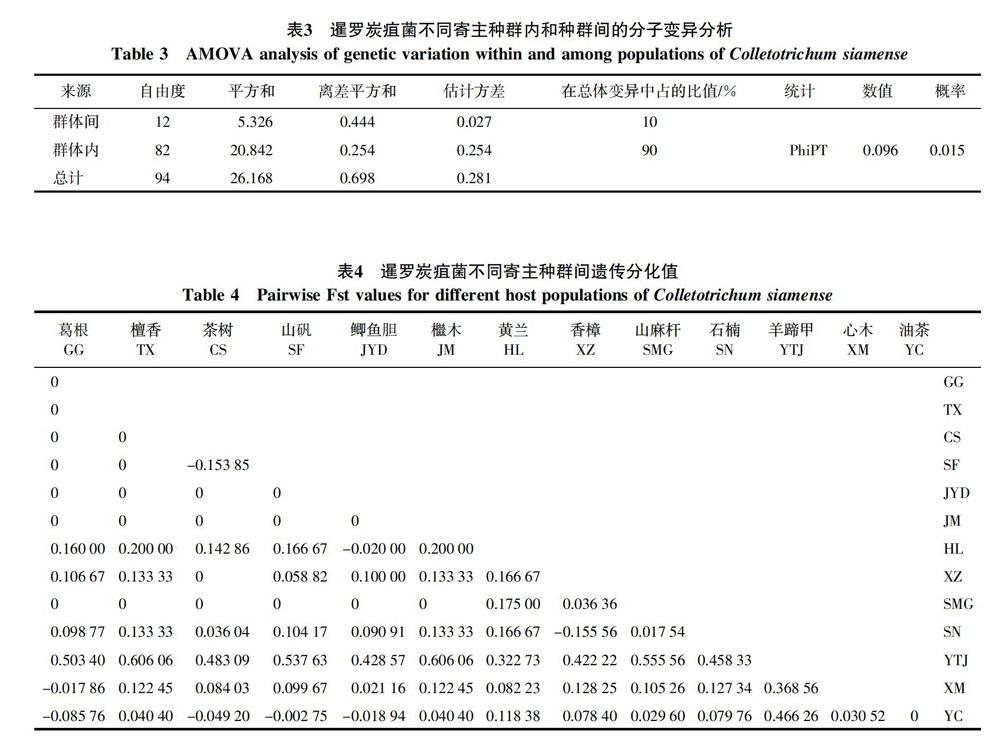
由表3可知暹罗炭疽菌种群变异主要发生在种群内,占总变异的90%,而种群间的变异仅占10%,这说明病菌不同寄主群体间基因交流频繁。暹罗炭疽菌不同寄主种群间和种群内的变异差异显著大于0,表明暹罗炭疽菌不同寄主种群内的遗传变异显著(p<0.05)。
2.4 暹罗炭疽菌不同寄主种群间遗传分化分析
Wright[12]提出遗传分化指数(Fst)小于0.05,群体间遗传分化很弱;Fst值介于0.05~0.15之间,群体间存在中等程度遗传分化;Fst值介于0.15~0.25之间,群体间遗传分化較大;Fst值大于0.25,表明群体间遗传分化极大。本研究中海南4个地区暹罗炭疽菌不同寄主种群间遗传分化值见表4,羊蹄甲与其余12个种群的Fst值大于0.25,群体间遗传分化极大;黄兰与葛根、檀香、山矾、檵木、香樟、山麻杆及石楠之间的Fst值介于0.15~0.25之间,群体间遗传分化较大;石楠、香樟分别与葛根、檀香、山矾、鲫鱼胆及檵木之间的Fst值介于0.05~0.15之间,心木与石楠、山麻杆、香樟、黄兰、檵木、山矾、茶树及檀香之间的Fst值介于0.05~0.15之间,油茶与葛根、黄兰、香樟、石楠和茶树与黄兰之间的Fst值也介于0.05~0.15之间,表明这些群体间存在中等程度遗传分化;其余种群间Fst值小于0.05,表明这些种群间遗传分化很弱,基因交流十分频繁。
2.5 基于ITS-CAL-GAPDH 3基因序列的系统发育树分析
暹罗炭疽菌ITS-CAL-GAPDH 3基因序列单倍型的系统发育树见图3,所有种群单倍型散乱地分布在系统树中,同一种群的单倍型序列并未聚在一起,不同种群的独特单倍型并未完全形成自己特有的进化枝。此外,16种单倍型与GenBank中的模式菌株C. siamense(ICMP18578*、ICMP18642*)以很高的支持率聚为一支,也验证了从13种寄主植物上分离到的95个菌株均为暹罗炭疽菌。
3 讨论
炭疽病是由炭疽病菌引起的一种重要植物病害,可造成严重的经济损失。暹罗炭疽菌为植物炭疽病病原之一,其地理分布较广,寄主植物较多,对经济树种、农作物等植物造成很大的危害[3-5]。遗传多样性是生物多样性的基础,一个物种的多样性越高,其在复杂的自然环境中生存的几率越高,对不同生存环境的适应力也越强[13]。研究病菌遗传结构可为弄清病菌对不同环境、寄主的适应能力提供理论基础。刘诗胤等[14]对浙江地区不同寄主来源的炭疽菌ITS序列进行分析,发现不同寄主来源的菌株聚在一起,亲缘关系较近,且不同菌株ITS序列具有丰富的多态性。
植物炭疽病菌为了适应不同地理、寄主环境的变化,表现出了较为丰富的遗传变异。易克贤等[15]对43株中国柱花草炭疽菌株进行基因组DNA分析,并和国外菌株进行综合聚类分析,发现同一地区或同一寄主的菌株聚成一类,表明炭疽菌在遗传上存在寄主专化性,在地理距离上具有各自独立的进化历程。但在本研究的暹罗炭疽菌单倍型的系统发育树中,发现暹罗炭疽菌同一种群的单倍型并未聚在一起,而是散乱的分布在系统树中;同时发现种群间存在一定程度的遗传分化,这可能是病菌受寄主选择等因素所致。李利霞等[16]采用SRAP分子标记对不同地区葡萄胶孢炭疽菌进行群体遗传多样性分析,发现葡萄胶孢炭疽菌群体遗传多样性丰富,但各菌株间存在遗传差异。这与本研究得到的暹罗炭疽菌群体遗传多样性丰富,不同寄主的病菌之间遗传分化较大的结论相同。
很多学者研究发现,植物病原菌在进化过程中存在基因流,同时种群间存在遗传变异。朱丹雪等[17-18]对我国不同油茶产区油茶炭疽病菌进行群体遗传结构分析,发现油茶炭疽病菌种群变异主要发生在种群内,病菌种群间基因交流频繁。本研究发现暹罗炭疽菌种群变异也主要发生在种群内,种群间变异仅占10%,且病菌可在不同寄主间传递基因流。王玲等[19]对水稻纹枯病菌5个种群的遗传结构研究时发现单倍型H5分布于每一个种群中;Pascual等[20]也发现在不同玉米纹枯病菌种群间存在相同单倍型。本研究中,发现主要单倍型H5存在于所有寄主植物上,这表明单倍型H5能够适应生存环境的变化;同时也发现不同寄主种群间存在其他相同单倍型,例如茶树、山矾、香樟和油茶均存在单倍型H16。这说明暹罗炭疽菌种群间的基因流未受寄主差异的影响,其优势单倍型可在不同寄主间进行传播,导致毒性较强的基因型在种群内维持下去,因而增加了对该病害的防治难度。
在本研究中,发现鲫鱼胆、黄兰、山麻杆、羊蹄甲、心木及油茶等6个寄主上均含有至少一个独特的单倍型。在长时间进化过程中,病菌为了适应环境变化或寄主选择,形成了自己独特的单倍型,增加了种群的遗传多样性。而目前很多地区大量使用单一杀菌剂来防治植物炭疽病,导致某些耐药性的单倍型菌株仍会存活下去[21-22],进而繁殖、传播其优势单倍型,导致植物炭疽病在全世界广泛发生并难以有效控制。本研究所分析样品序列来自海南4个地区13种寄主植物,不同种群样品序列数存在一定差异,但本研究的结果已能够清晰的显示海南4个地区不同寄主植物暹罗炭疽菌具有丰富的遗传多样性,揭示了该病害在海南乃至全国广泛发生和危害严重的理论基础。为了更加全面了解暹罗炭疽菌在不同寄主植物上的进化关系,从分子水平为有效控制植物炭疽病提供理论依据。下一步将扩大采样范围,增加更多地区、寄主来源病菌,同时应用其他分子标记,以获取暹罗炭疽菌更多的遗传信息,为阐明该病害流行机制提供理论依据。
参考文献
[1] Hyde K D, Cai L, Cannon P F, et al. Colletotrichum-names in current use[J]. Fungal Diversity, 2009, 39: 147-182.
[2] 张 荣, 王素芳, 崔静秋, 等. 陕、豫两省苹果炭疽病病原鉴定[J]. 中国农业科学, 2009, 42(9): 3 224-3 229
[3] 李 河, 周国英, 徐建平. 一种新油茶炭疽病原多基因序列鉴定[J]. 植物保护, 2015, 41(2): 92-96.
[4] Prihastuti H, Cai L, Chen H, et al. Characterization of Colletotrichum species associatedwith coffee berries in northern Thailand[J]. Fungal Diversity, 2009, 39: 89-109.
[5] 韩永超, 向发云, 曾祥国, 等. 草莓根颈腐烂病的病原鉴定[J]. 中国农业科学, 2014, 47(1): 53-60
[6] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 122-145.
[7] Weir B S, Johnston P R, Damm U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2012, 73: 115-180.
[8] HALL T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series, 1999, 41: 95-98.
[9] Librado P, Rozas J. DnaSP v5: Asoftware for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics, 2009, 25(11): 1 451-1 452.
[10] Clement M, Posada D, Crandall K A. TCS: a computer program to estimate gene genealogies[J]. Molecular Ecology, 2000, 9(10): 1 657-1 660.
[11] Tamura K, Nei M, Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method[J]. Proceedings of the National Academy of Sciences(USA), 2004, 101(30): 11 030-11 035.
[12] Wright S. Evolution and the Genetics of Populations. Volume 4: Variability within and among natural populations[M]. Chicago: The University of Press, 1978: 325-327.
[13] 袁 娟, 張其中, 李 飞, 等. 铜鱼线粒体控制区的序列变异和遗传多样性[J]. 水生生物学报, 2010, 34(1): 9-19.
[14] 刘诗胤, 邱海萍, 姜 华, 等. 浙江地区不同寄主来源的炭疽菌ITS序列PCR-RFLP多态性分析[J]. 浙江农业学报, 2012, 24(1): 61-65.
[15] 易克贤, 黄俊生, 刘国道, 等. 中国柱花草炭疽病原菌遗传多态性的RAPD分析[J]. 微生物学报, 2003, 43(3): 379-387.
[16] 李利霞, 赵奎华, 刘长远, 等. 葡萄炭疽病菌SRAP遗传多样性分析[J]. 中国农学通报, 2012, 28(12): 230-235.
[17] 朱丹雪, 周国英, 徐建平, 等. 果生刺盘孢菌Colletotrichum fructicola群体遗传结构研究[J]. 菌物学报, 2015, 34(3): 366-374.
[18] 李 河, 朱丹雪, 徐建平, 等. 引起油茶炭疽病胶孢炭疽菌种群遗传结构研究[J]. 植物病理学报, 2014, 44(6): 620-628.
[19] 王 玲, 黄雯雯, 黄世文, 等. 浙皖鄂地区水稻纹枯病菌5个种群的遗传结构分析[J]. 生态学报, 2010, 30(20): 5 439-5 447.
[20] Pascual C B, Toda T, Raymondo A D. Characterization by conventional techniques and PCR of Rhizoctonia solani isolates causing banded leaf sheath blight in maize[J]. Plant Pathology, 2000, 49(1): 108-118.
[21] 詹儒林, 李 伟, 郑服丛. 芒果炭疽病菌对多菌灵的抗药性[J]. 植物保护学报, 2005, 32(1): 71-76.
[22] 陈 聃, 时浩杰, 吴慧明, 等. 浙江省葡萄炭疽菌对甲基硫菌灵和戊唑醇的抗药性研究[J]. 果树学报, 2013, 30(4): 665-668.

