川芎嗪对庆大霉素耳聋豚鼠SOD同工酶蛋白表达的调控
沈晓丽 周静 王永华 王一鸣 顾伟忠宁波卫生职业技术学院(宁波500)浙江中医药大学(浙江005)浙江大学医学院附属儿童医院(浙江000)
川芎嗪对庆大霉素耳聋豚鼠SOD同工酶蛋白表达的调控
沈晓丽1周静1王永华2王一鸣2顾伟忠3
1宁波卫生职业技术学院(宁波315100)2浙江中医药大学(浙江310053)3浙江大学医学院附属儿童医院(浙江310003)
【摘要】目的研究川芎嗪(tetraethylplyrazine,TMP)对庆大霉素(Gentamycin,GM)耳蜗毒性的抗氧化作用并探讨该机制与铜锌超氧化物歧化酶(Cu/Zn superoxide dismutase,Cu/Zn SOD或SOD1)、锰超氧化物歧化酶(Mn-superox⁃ide dismutase,Mn SOD或SOD2)及细胞外超氧化物歧化酶(ECSOD或SOD3)蛋白表达的关系。方法将60只听力正常成年豚鼠随机分为4组,即GM组、TMP组、GM+TMP组、对照组。GM组(15只)肌注硫酸庆大霉素120mg·kg-1·d-1,连续12天;TMP组(15只)腹腔注射盐酸川芎嗪30mg·kg-1·d-1,连续12天;GM+TMP组(15只)肌注硫酸庆大霉素120 mg·kg-1·d-1及腹腔注射盐酸川芎嗪30mg·kg-1·d-1,连续12天;对照组(15只)腹腔注射与GM组等量的生理盐水2.5ml·kg-1·d-1,连续12天。每组豚鼠首次用药前及末次用药后第一天均行ABR检测。实验结束后将豚鼠断头处死并取耳蜗标本,免疫组化法对其细胞内SOD1、SOD2、SOD3蛋白表达进行定位研究。结果用药后GM组听力阈值明显升高,与正常组、GM+TMP组比较有明显差异(P<0.01),正常对照组与TMP组听力阈值用药前后相比无显著性差异(P>0.05)。耳蜗螺旋神经节处模型组和拮抗组SOD1、SOD2、SOD3阳性蛋白表达无统计学差异(P>0.05),毛细胞处拮抗组SOD1、SOD2阳性蛋白表达较模型组明显(P<0.05),SOD3阳性蛋白表达无统计学差异(P>0.05)。结论庆大霉素具有耳毒性,可导致豚鼠耳蜗毛细胞损伤,川芎嗪可通过对毛细胞处SOD1、SOD2的蛋白表达调控机制来实现抗氧化防护作用。
【关键词】庆大霉素;川芎嗪;耳毒性;抗氧化;SOD1;SOD2;SOD3
氨基糖甙类抗生素(Aminoglycoside Antibiotics,AmAn)是临床上治疗革兰阴性杆菌感染的重要药物。但其致命的弱点是会造成耳蜗感音结构及螺旋神经节损伤而引起听觉障碍,其中以庆大霉素(Genta⁃mycin,GM)引起的耳聋发生率最高,主要表现为听觉系统的慢性中毒,导致耳蜗及前庭毛细胞死亡[1]。
川芎嗪(Tetramethylpyrazine,TMP)是川芎的重要成分,属酰氨类生物碱,具有强心、降低血压、抗氧自由基和抑制血小板聚集、抗组织纤维化等作用,有实验研究表明[2,3],TMP也可有效减轻GM耳毒性损伤,且与TMP具有抗氧化作用有关,但尚不明确其确切的抗氧化机制。超氧化物歧化酶(superoxide dis⁃mutase,SOD)是机体内抗氧化防御系统的第一道防线[4],在哺乳动物体内有三种同工酶,分别是位于胞浆的铜锌超氧化物歧化酶(Cu/ZnSOD或SOD1)、位于线粒体的锰超氧化物歧化酶(MnSOD或SOD2)和分泌到细胞外的细胞外超氧化物歧化酶(ECSOD或SOD3),基本功能分别是降低细胞内的O2-浓度、清除由呼吸链相关反应产生的O2-和胞外环境的主要抗氧化酶。本研究前期[5]已表明庆大霉素作用于豚鼠,引起耳毒性的发生与血清中SOD活性的降低具有相关性,川芎嗪的作用可使SOD活性升高从而减轻内耳的损伤,但目前尚不明确该机制与SOD1、SOD2、SOD3蛋白表达的关系。
本研究在建立庆大霉素引发豚鼠内耳损伤模型的基础上,观察川芎嗪对庆大霉素耳毒性作用的抗氧化机制,并初步探讨该机制与SOD1、SOD2和SOD3在耳蜗内蛋白表达的关系,试图为临床应用提供实验依据。
1 材料与方法
1.1材料
实验动物:成年健康豚鼠60只,雌雄不拘,体重290~350g,均经电耳镜检查排除外耳道炎及中耳炎,耳廓反射灵敏。由浙江中医药大学实验动物中心提供,许可证号:SCXK(浙)2008-0037,标准饲料养于标准实验动物中心,适应性饲养一周。
主要试剂:硫酸庆大霉素注射剂(8万单位/支,20111215,浙江瑞新药业股份有限公司);注射用盐酸川芎嗪(40mg/支,110505A2,哈尔滨三联药业有限公司);免疫组化检测试剂盒EnVisionTM Two-Step (1701777A,丹麦DAKO公司);SOD1 antibody (abl6831,abcam公司);SOD2 antibody(abl16956,ab⁃cam公司);SOD3 antibody(abl80946,abcam公司)。
主要仪器:ZEP脑干诱发电位仪(北京中科电气高技术公司);MICROM HM340E石蜡切片机(德国MICROM公司)。
1.2实验方法
1.2.1实验动物分组及处理
60只豚鼠适应性分笼饲养一周后随机分为4组,即GM组、TMP组、GM+TMP组、对照组。GM组(15只)肌注硫酸庆大霉素120mg·kg-1·d-1,连续12天;TMP组(15只)腹腔注射盐酸川芎嗪30mg·kg-1· d-1,连续12天;GM+TMP组(15只)肌注硫酸庆大霉素120mg·kg-1·d-1及腹腔注射盐酸川芎嗪30mg· kg-1·d-1,连续12天;对照组(15只)腹腔注射与GM组等量的生理盐水2.5ml·kg-1·d-1,连续12天。每组豚鼠首次用药前及末次用药后第一天检测ABR阈值,末次检测完毕后,断头处死豚鼠并取耳蜗标本,制备耳蜗组织石蜡切片,免疫组化法测其蛋白表达。整个过程中避免接触噪声,每天测量体重以调整药量并严密观察豚鼠的毛发及精神状况等变化。
1.2.2听性脑干诱发电位反应(ABR)测试
动物用1%戊巴比妥钠40mg·kg-1腹腔注射麻醉后,在隔音的电屏蔽室内用ZEP诱发电位仪进行ABR测试。将记录电极置双耳廓上缘连线中点之颅顶正中,参考电极放置于给声耳的耳后皮下,接地电极放置在对侧耳的耳后皮下。刺激声为交替短声(click),带通滤波100~3000Hz,TDH-39型耳机输出,耳机距离豚鼠外耳道口约0.5cm,刺激声重复率为10次/秒,叠加512次,扫描时程10ms。测试强度由110dB SPL开始,按10dB递减,接近阈值时按5dB逐档递减,听阈确定以测定以Ⅲ波为基准。ABR阈值检测于每组豚鼠首次用药前及末次用药后第一天进行。
1.2.3耳蜗组织石蜡切片
ABR检测结束后,将豚鼠立即断头处死,迅速取出双侧听泡,打开听泡即可见耳蜗,用尖针在蜗尖钻孔,沿圆窗剪开其下缘骨壁,再将蹬骨轻轻推入卵圆窗,从蜗尖注入10%福尔马林固定液,看到固定液从圆窗和卵圆窗流出后,将标本置于该固定液中,4℃固定24h以上,脱钙4周,常规石蜡包埋,平行于蜗轴方向连续切片,片厚5μm,烘干,室温储藏备用。
1.2.4免疫组化方法检测耳蜗组织中SOD1、SOD2、SOD3表达
具体操作步骤参照免疫组化SABC法完成,一抗SOD1、SOD2和SOD3工作浓度参照试剂盒,设置阴性对照(以PBS液代替一抗,其他步骤相同),用DAB进行呈色,常规脱水,透明,封片。每个耳蜗在光学显微镜200倍视野下分别选择确定3-5个视野并拍照(在同等条件下选择耳蜗的中回进行观察),对视野内阳性的毛细胞和螺旋神经节细胞采用im⁃age-plus 5.0图像分析软件进行IOD值测量。淡黄色作为阳性表达,在螺旋神经节细胞,毛细胞和侧壁的血管纹细胞胞浆上均可见表达,细胞核呈蓝色。
1.3统计学方法
所有实验数据均采用SPSS13.0统计软件处理,ABR反应阈行自身前后对照比较应用配对t检验;组间比较采用单因素ANOVA分析。以P<0.05为差异有统计学意义。
2 结果
2.1ABR阈值检测结果
各组豚鼠用药前后ABR阈值结果如表1所示,用药前各组豚鼠正常ABR阈值大小与文献(使用ZEP诱发电位仪测试)报道基本一致[6]。用药12天后GM+TMP组与GM组比较有明显差异(P<0.01),听力阈值虽然也有升高,但较GM组明显降低。
表1 用药前后各组豚鼠ABR阈值比较(dB SPL±s)Table 1 Comparison of ABR threshold of each group before and after treatment(dB SPL±s)
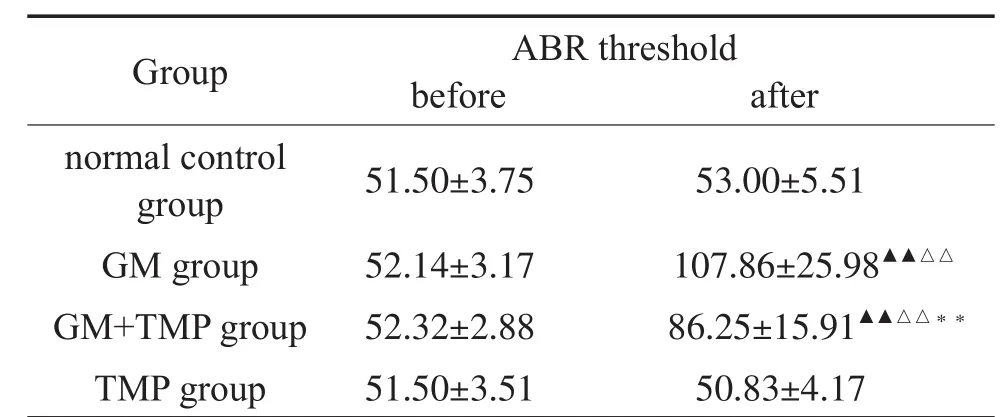
表1 用药前后各组豚鼠ABR阈值比较(dB SPL±s)Table 1 Comparison of ABR threshold of each group before and after treatment(dB SPL±s)
Note:Compared with the same group before treatment,▲▲P<0.01;after treatment,compared with the normal control group,□□P<0.01;compared with the GM group,**P<0.01.
Group ABR threshold before after normal control group GM group GM+TMP group TMP group 51.50±3.75 52.14±3.17 52.32±2.88 51.50±3.51 53.00±5.51 107.86±25.98▲▲△△86.25±15.91▲▲△△**50.83±4.17
2.2免疫组化检测结果
2.2.1各组豚鼠耳蜗SOD1表达变化的影响
四组豚鼠耳蜗SOD1阳性反应的表达IOD值结果如表2所示,在毛细胞处:与正常组比较,GM+TMP 组SOD1阳性细胞表达IOD值明显上调(P<0.05);与GM组比较,GM+TMP组SOD1阳性细胞表达IOD值较高,两者比较有统计学意义(P<0.05),其中GM组、TMP组与正常对照组之间无统计学差异(P>0.05)。各实验组在毛细胞处SOD1阳性细胞表达情况见图1。在螺旋神经节(SGC)部位:GM组、GM+TMP组及正常组SOD1阳性细胞表达IOD值均无明显统计学差异(P>0.05)。各实验组在SGC部位SOD1阳性细胞表达情况见图4。
表2 各组耳蜗切片毛细胞处、螺旋神经节(SGC)SOD1表达(IOD)±s)Table 2 expressions of SOD1 on hair cell and spiral ganglion cell in each group(IOD)±s)
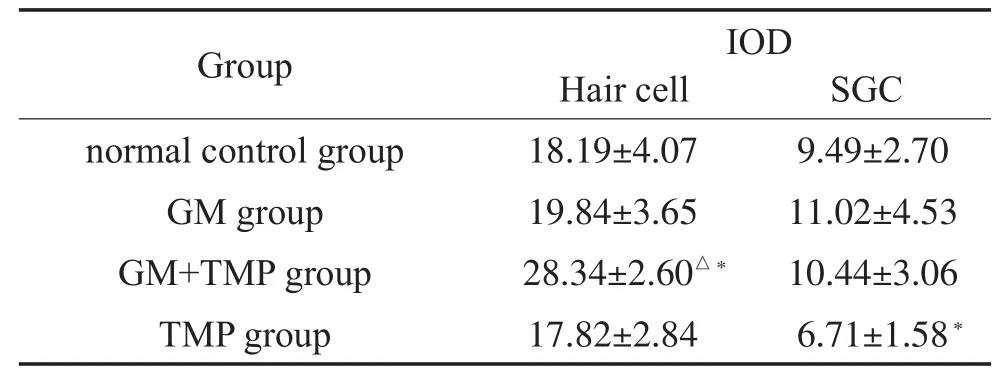
表2 各组耳蜗切片毛细胞处、螺旋神经节(SGC)SOD1表达(IOD)±s)Table 2 expressions of SOD1 on hair cell and spiral ganglion cell in each group(IOD)±s)
Note:Compared with the normal control group,□P<0.05;compared with GM group,*P<0.05.
Group normal control group GM group GM+TMP group TMP group IOD Hair cell SGC 18.19±4.07 19.84±3.65 28.34±2.60△*17.82±2.84 9.49±2.70 11.02±4.53 10.44±3.06 6.71±1.58*
2.2.2各组豚鼠耳蜗SOD2表达变化的影响
四组豚鼠耳蜗SOD2阳性反应的表达IOD值结果如表3所示,在毛细胞处:GM+TMP组SOD2阳性细胞表达IOD值明显上调,与正常组、GM组比较有统计学差异(P<0.05),其中GM组、TMP组与正常对照组之间无统计学差异(P>0.05)。各实验组在毛细胞处SOD2阳性细胞表达情况见图2。在SGC部位:GM组、GM+TMP组SOD2阳性细胞表达IOD值明显上调,与正常组比较有统计学差异(P<0.05),其中GM+TMP组与GM组比较,两者无统计学差异(P>0.05)。各实验组在SGC部位SOD2阳性细胞表达情况见图5。
2.2.3各组豚鼠耳蜗SOD3表达变化的影响
四组豚鼠耳蜗SOD3阳性反应的表达IOD值结果如表4所示,在毛细胞处:GM组、GM+TMP组SOD3阳性细胞表达IOD值与正常组比较无明显上调(P>0.05)。各实验组在毛细胞处SOD3阳性细胞表达情况见图3。在SGC部位:GM组、GM+TMP组、正常组、TMP组四组间无统计学差异(P>0.05)。各实验组在SGC部位SOD3阳性细胞表达情况见图6。
表3 各组耳蜗切片毛细胞处、螺旋神经节(SGC)SOD2表达(IOD)±s)Table 3 expressions of SOD2 on hair cell and spiral ganglion cell in each group(IOD)±s)
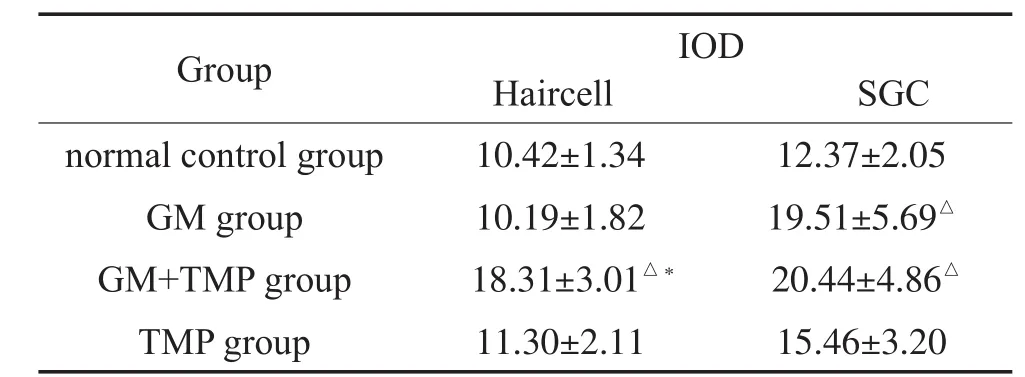
表3 各组耳蜗切片毛细胞处、螺旋神经节(SGC)SOD2表达(IOD)±s)Table 3 expressions of SOD2 on hair cell and spiral ganglion cell in each group(IOD)±s)
Note:Compared with the normal control group,△P<0.05;compared with GM group,*P<0.05.
Group IOD Haircell SGC normal control group GM group GM+TMP group TMP group 10.42±1.34 10.19±1.82 18.31±3.01△*11.30±2.11 12.37±2.05 19.51±5.69△20.44±4.86△15.46±3.20
表4 各组耳蜗切片毛细胞处、螺旋神经节(SGC)SOD3表达(IOD)±s)Table 4 expressions of SOD3 on hair cell and spiral ganglion cell in each group(IOD)±s)
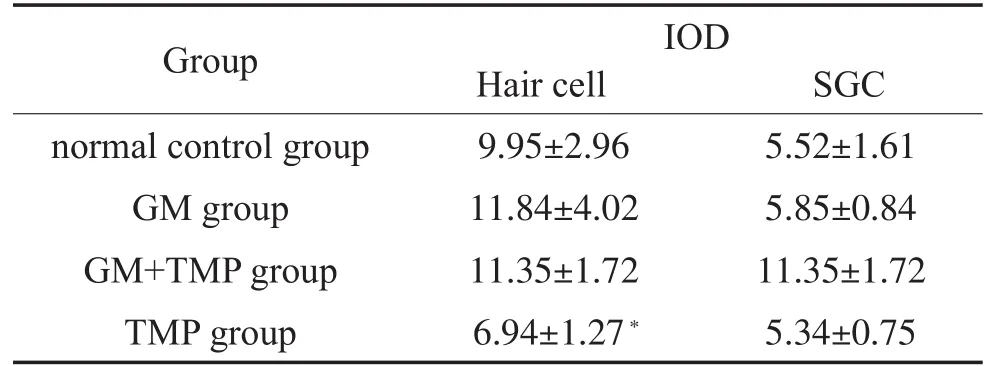
表4 各组耳蜗切片毛细胞处、螺旋神经节(SGC)SOD3表达(IOD)±s)Table 4 expressions of SOD3 on hair cell and spiral ganglion cell in each group(IOD)±s)
Note:Compared with GM group,*P<0.05.
Group normal control group GM group GM+TMP group TMP group IOD Hair cell SGC 9.95±2.96 11.84±4.02 11.35±1.72 6.94±1.27*5.52±1.61 5.85±0.84 11.35±1.72 5.34±0.75
3 讨论
氨基糖苷类抗生素通过导致耳蜗细胞内氧自由基的过量生成[7],引起线粒体膜性物质损伤,线粒体功能障碍又进一步导致内耳大量氧自由基蓄积和抗氧化酶过度消耗,诱导耳蜗毛细胞和螺旋神经节细胞凋亡或死亡,最终引起耳聋。从本研究ABR测试结果来看,GM组、GM+TMP组与正常对照组相比较,均存在统计学差异,GM组、GM+TMP组ABR阈值升高,验证了本次造模成功。而GM+TMP组听力阈值虽然也有升高,但较GM组明显降低(P<0.01),TMP组听力阈值用药前后无改变,表明川芎嗪对正常豚鼠耳蜗听阈无影响,但可使庆大霉素耳中毒豚鼠ABR阈值明显降低,显示川芎嗪能显著降低庆大霉素耳毒性损伤而使听力得以改善,该结果可能与SOD是抗氧化应激损伤的关键酶类之一有关。
SOD是机体抵抗自由基损害的第一道防线,能催化过氧化物阴离子自由基O2-形成O2及H2O2,H2O2又在抗坏血酸和过氧化氢酶的作用下生成O2及H2O,从而保护机体免受超氧阴离子的损害,使超氧阴离子自由基的产生和消除维持在一个平衡状态。目前已知的哺乳动物体内SOD有三种同工酶,即SOD1、SOD2和SOD3。SOD3本质上也是一种SOD2,是1982年Marklund等人首先在动物血浆中发现的。已有研究发现在耳蜗中也有SOD1和SOD2的分布[8]。本研究采用免疫组化法进行定位研究,对SOD同工酶在豚鼠耳蜗组织螺旋神经节、毛细胞等部位的阳性表达进行了检测,除了发现有SOD1,SOD2的表达,还检测到了SOD3的蛋白表达,三种同工酶在不同的组织及不同的疾病状态下存在着活性及表达差异,在机体中发挥着独立作用[9]。在螺旋神经节处,GM组与GM+TMP组间三种超氧化物歧化酶同工酶阳性表达无显著差异,但在毛细胞处,GM+TMP组较GM组SOD1及SOD2阳性细胞表达IOD值明显上调,推测毛细胞是SOD1、SOD2蛋白表达水平变化的重要部位,而SOD3是胞外环境的抗氧化酶,主要分泌到细胞外,故未见SOD3蛋白表达在螺旋神经节及毛细胞处的明显变化。SOD同工酶在内耳不同部位表达出现差异的原因,推测可能与不同内耳组织所在的内环境、亚细胞结构差异和各自的功能不同引起生理生化条件不同有关。毛细胞处GM+TMP组较GM组SOD1及SOD2阳性细胞表达IOD值升高,推测川芎嗪可能主要通过作用于耳蜗毛细胞引起SOD1,SOD2蛋白表达增强,高表达的SOD1、SOD2可清除早期产生的大量O2-,从而保护细胞,因此川芎嗪对耳蜗细胞起到了保护作用。
综上所述,作为抗氧化剂,川芎嗪可通过毛细胞处SOD1、SOD2的蛋白表达调控机制来拮抗庆大霉素耳中毒的发生,实现抗氧化防护作用,但由于内耳毛细胞及听神经复杂的氧化机制,川芎嗪对庆大霉素耳毒性作用的抗氧化机制还有待于进一步深入研究。
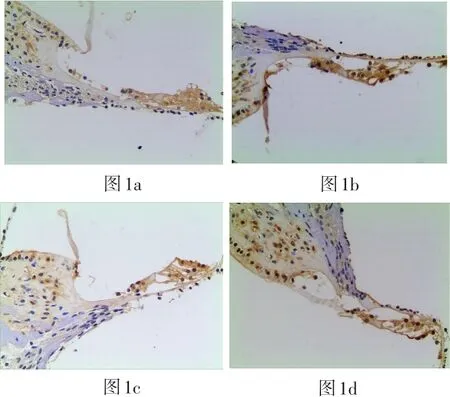
图1 a-d光学显微镜200倍视野下各组耳蜗切片(中回)毛细胞处SOD1阳性细胞表达(1a、1b、1c、1d分别为GM组、GM+ TMP组、TMP组、正常对照组)Fig.1a-d Optical microscopic observation with magnification 200x shows the SOD1 expressing on hair cells in each cochlear slices group(middle area)(a1:GM group,a2:GM+TMP group,a3:TMP group,a4:normal control group)
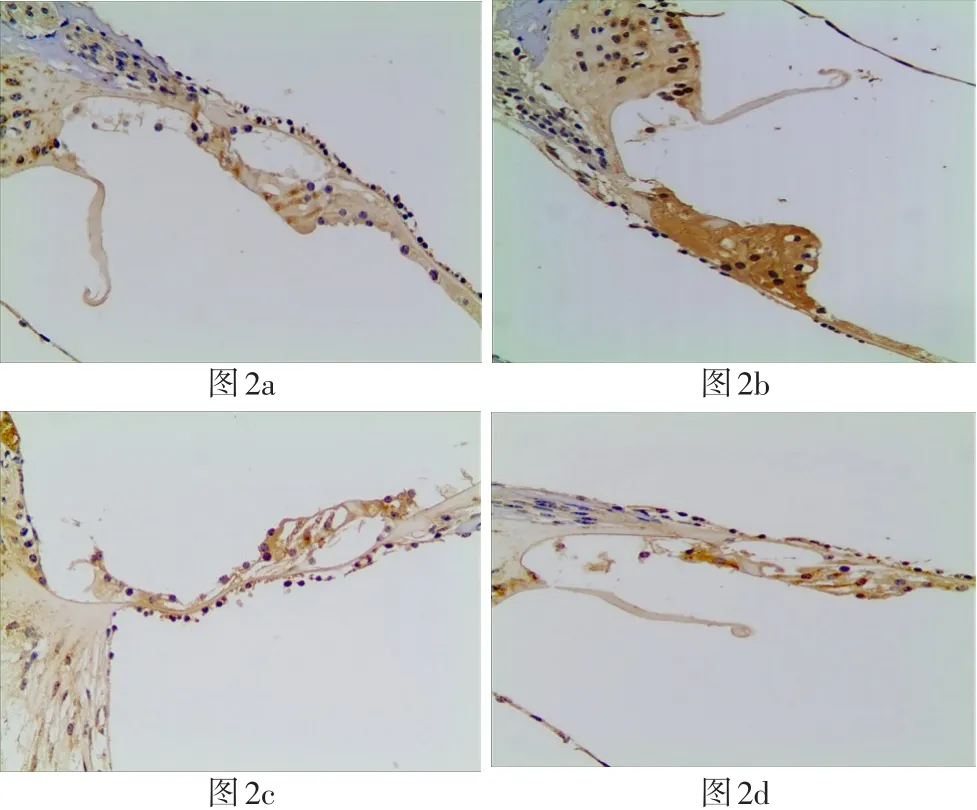
图2 a-d光学显微镜200倍视野下各组耳蜗切片(中回)毛细胞处SOD2阳性细胞表达(2a、2b、2c、2d分别为GM组、GM+ TMP组、TMP组、正常对照组)Fig.2a-d Optical microscopic observation with magnification 200x shows the SOD2 expressing on hair cells in each cochlear slices group(middle area)(2a:GM group,2b:GM+TMP group,b3:TMP group,b4:normal control group)
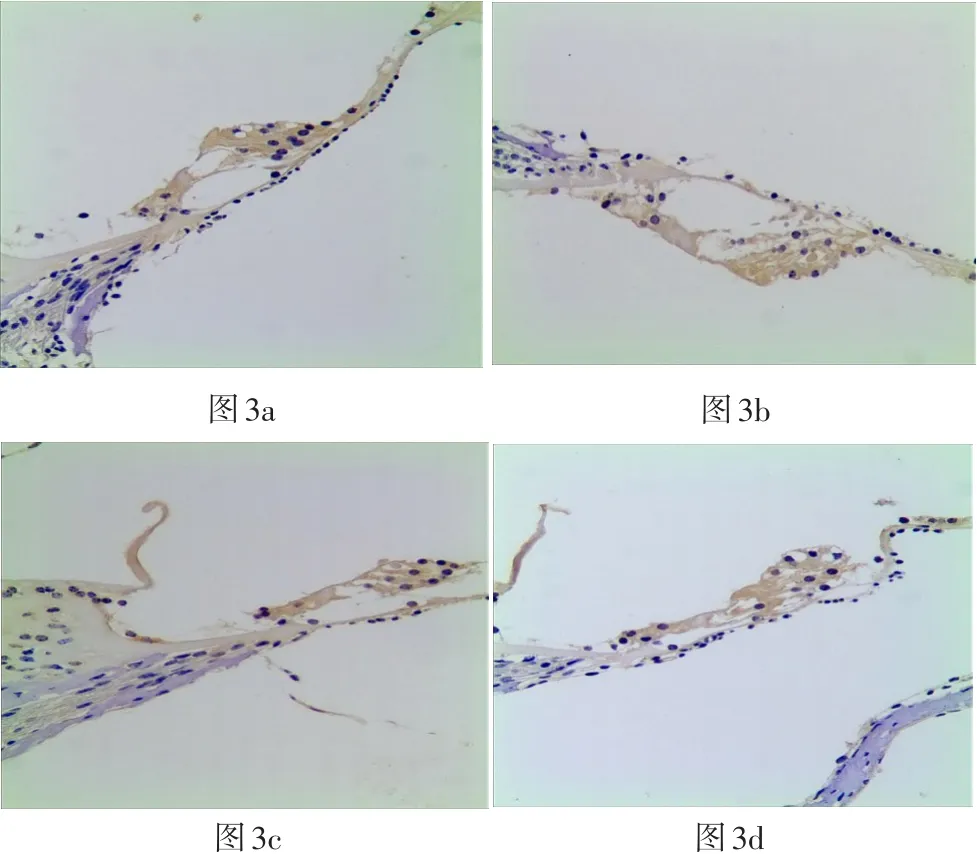
图3 a-d光学显微镜200倍视野下各组耳蜗切片(中回)毛细胞处SOD3阳性细胞表达(3a、3b、3c、3d分别为GM组、GM+ TMP组、TMP组、正常对照组)Fig.3a-d Optical microscopic observation with magnification 200x shows the SOD3 expressing on hair cells in each cochlear slices group(middle area)(3a:GM group,3b:GM + TMP group,3c:TMP group,3d:normal control group)
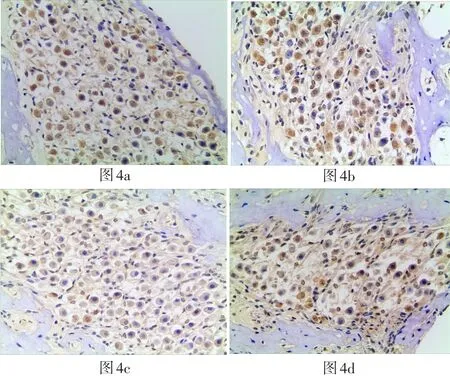
图4 光学显微镜200倍视野下各组耳蜗切片(中回)螺旋神经节处SOD1阳性细胞表达(4a、4b、4c、4d分别为GM组、GM+ TMP组、TMP组、正常对照组)Fig.4 Optical microscopic observation with magnification 200x shows the SOD1 expressing on spiral ganglion cells in each cochlear slices group(middle area)(4a:GM group,4b:GM+TMP group,4c:TMP group,4d:normal control group)
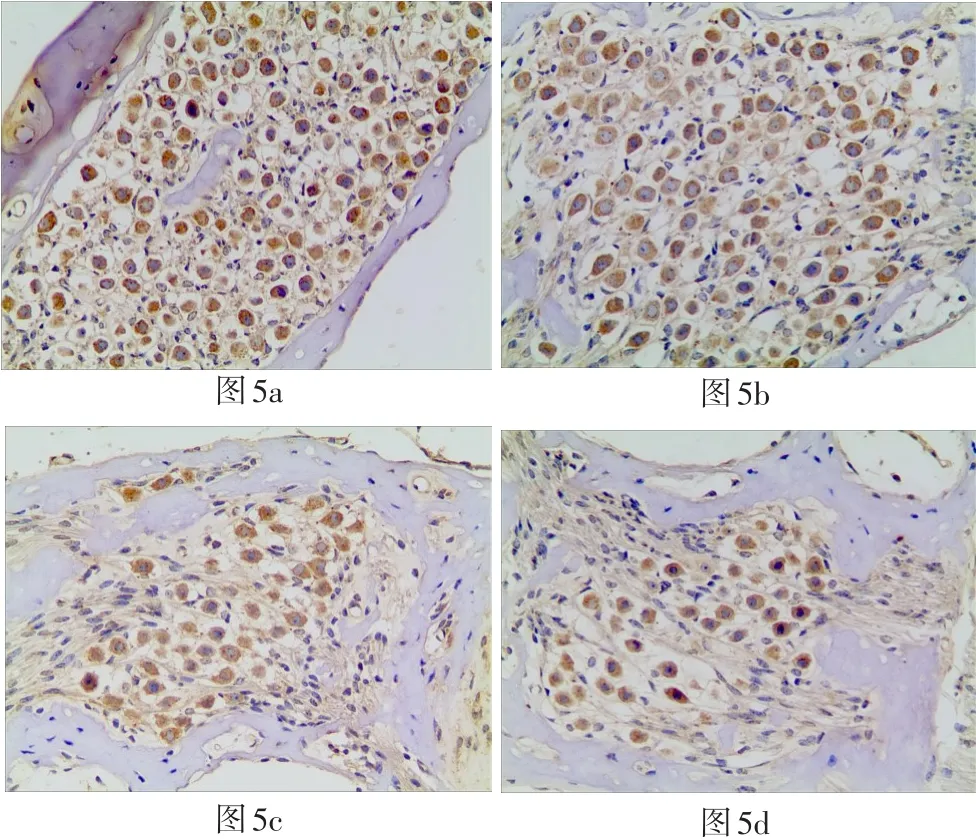
图5 光学显微镜200倍视野下各组耳蜗切片(中回)螺旋神经节处SOD2阳性细胞表达(5a、5b、5c、5d分别为GM组、GM+ TMP组、TMP组、正常对照组)Fig.5 Optical microscopic observation with magnification 200x shows the SOD2 expressing on spiral ganglion cells in each cochlear slices group(middle area)(5a:GM group,5b:GM+TMP group,5c:TMP group,5d:normal control group)
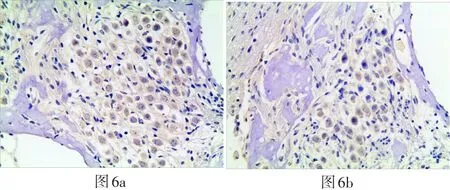
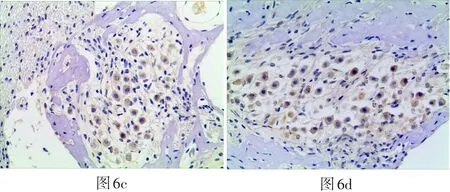
图6 光学显微镜200倍视野下各组耳蜗切片(中回)螺旋神经节细胞处SOD3阳性细胞表达(6a、6b、6c、6d分别为GM组、GM+TMP组、TMP组、正常对照组)Fig.6a-d Optical microscopic observation with magnification 200x shows the SOD3 expressing on spiral ganglion cells in each cochlear slices group(middle area)(6a:GM group,6b:GM+TMP group,6c:TMP group,6d:normal control group)
参考文献
1Selimoglu E.Aminoglycoside- induced ototoxicity[J].Curr Pharm Des,2007,13(1):119-126.
2王永华,王一鸣,沈晓丽,等.川芎对庆大霉素致聋豚鼠耳蜗氧自由基生成的影响[J].听力学及言语疾病杂志,2014,22(1):73-75.Wang Yonghua,Wang Yiming,Shen Xiaoli,et al.Effects of Ligustra⁃zine(TMP)on Acute Drug-induced Free Radical Formation in Guin⁃ea Pig Cochlear[J].Journal of Audiology and Speech Pathology,2014,22(1):73- 75.
3温丽民,倪月秋.川芎嗪对药物耳毒性线粒体DNA缺失的影响[J].中国医疗前沿,2012,7(19):13- 14.Wen Limin,Ni Yueqiu.The effect of tetramethylpyrazine on drug to⁃toxicity with mtDNAdeletion[J].National Medical Frontiers of Chi⁃na,2012,7(19):13- 14.
4刘宏伟,冷辉,孙海波.川芎嗪对顺铂耳聋大鼠耳蜗Fas/Fas L及caspase8的调控研究[J].中华耳科学杂志,2015,13(2):335-339.Liu Hongwei,Leng Hui,Sun Haibo.Effects of Ligustrazine on Ex⁃pression of Fas/Fas L and Caspase8 in Cochlea of Rat with Cisplat⁃in-induced Hearing Loss[J].Chinese Journal of Otology,2015,13 (2):335-339.
5O'Brien KM,Dirmeier R,Engle M,et al.Mitochondrial protein oxi⁃dation in yeast mutants lacking manganese-(MnSOD)or copper and zinc-containing superoxide dismutase(CuZnSOD):evidence that Mn-SOD and CuZnSOD have both unique and overlapping func⁃tions in protecting mitochondrial proteins from oxidative damage[J].J Biol Chem,2004,279(50):51817-51827.
6王枫,赵乌兰,魏小琴.金匮肾气丸对耳聋豚鼠血清SOD、MDA的影响[J].浙江中医杂志,2011,8(46):562-563.Wang Feng,Zhao Wulan,Wei Xiaoqin.Influence of Jinkui Shenqi Pills on SOD,MDA in Deaf Guinea Pigs[J].Zhejiang Journal of Tra⁃ditional Chinese Medicine,2011,8(46):562-563.
7胡旭君,王永华,罗嵩.补肾活血中药对缺氧肾虚豚鼠听功能、耳蜗形态学、酶影响的实验研究[J].中华中医药学刊,2013,31(3):477-480.Hu Xujun,Wang Yonghua,Luo Song.Experimental Study on Effect of Tiangu Granule on Audiology function,Cochlear Morphology and Enzymes of Guinea Pig with hypoxia and Kidney Deficiency[J].2013,31(3):477-480.
8Somdaş MA,Korkmaz F,Gürgen SG,et al.N-acetylcysteine pre⁃vents gentamicin ototoxicity in a rat model[J].The Journal of Inter⁃national Advanced Otology,2015,11(1):12-18.
9丁大连,Richard Salvi.氨基糖甙类抗生素耳毒性研究[J].中华耳科学杂志,2007,5(2):125-130.Ding Dalian,Richard Salvi.Experiences in ototoxic investigations in am inoglycoside antibiotics[J].Chinese Journal of Otology,2007,5 (2):125-130.
10Rarey KE,YaoX.Loealization of Cu/Zn-SOD and Mn-SOD in the rat cochlea[J].Aeta Otolaryngol,1996,116(6):833-835.
11Sentman M L,Granstrom M,Jakobson H,et al.Phenotypes of mice.lacking extracellular superoxide dismutase and copper and zine con⁃taining superoxide dismutase[J].J Biol Chem,2006,281(11):6904-6909.
·综述·
Effects of TMPon Expression of SOD1,SOD2 and SOD3 in Cochlea of Guinea Pigs with Gentamycin-Induced Hearing Loss
SHEN Xiaoli,ZHOU Jing,WANG Yonghua,WANG Yiming,GU Weizhong
1Ningbo College of Health Sciences 315100 2Zhejiang University of Traditional Chinese Medicine 310053 3 Children’s Hospital,Zhejiang University School of Medicine Corresponding author:SHEN XiaoliEmail:shenxiaoli515@126.com
【Abstract】Objective To study the anti-oxidant effects of tetraethylplyrazine(TMP)on cochlea hair cells and spiral ganglion cells damaged by gentamycin(GM)and the relations between such effects and the expression level and activity of Cu/Zn superoxide dismutase(Cu/Zn SOD or SOD1),Mn-superoxide dismutase(Mn SOD or SOD2)and ECSOD (SOD3).Methods Sixty healthy guinea pigs were randomly divided into a model group(GM group),a GM+TMP treatment group,a TMP treatment group and a normal control group(n=15 in each group).Animals in the GM group were injected with Gentamycin sulfate at 120 mg/kg/d;those in the TMP group were injected with TMP at 30 mg/kg/d;those in the GM+TMP group were injected with Gentamycin sulfate and TMP with the same dosages;and those in the normal control group were injected with saline at 2.5 ml/kg/d.All animals were injected for 12 consecutive days.Before injection and one day after the last injection,ABR thresholds were measured in all groups.At the end of the experiment,guinea pigs were sacrificed and immuno-histochemical methods were used to determine the level of SOD1,SOD2 and SOD3 protein expression in cochlear tissues.Results After treatment,ABR thresholds in the GM group were significantly high-er than the GM+TMP and normal control groups(P<0.01),while ABR thresholds in the TMP and normal control groups did not change significantly from before treatment(P>0.05).There were no significant differences in the expression of SOD1,SOD2 or SOD3 in spiral ganglion cells when the GM and GM+TMP groups were compared(P>0.05),but the expression of SOD1 and SOD2 in hair cells was different between the two groups(P<0.05),although SOD3 expression in hair cells was not significantly different between the two groups(P>0.05).Conclusions GM is ototoxic and causes cochlea hair cell damage.TMP plays an anti-oxidant role through regulation of SOD1,SOD2 expression in hair cells.
【Keywords】GM;TMP;ototoxicity;anti-oxidant;SOD1;SOD2;SOD3
【中图分类号】r917.795
【文献标识码】A
【文章编号】1672-2922(2016)03-408-6
DOI:10.3969 / j.issn.1672-2922.2016.03.020
作者简介:沈晓丽,硕士,助教,研究方向:耳聋康复研究
通讯作者:沈晓丽,Email:shenxiaoli515@126.com
收稿日期:(2016-01-12审核人:翟所强)

