某县近3年中成药不良反应的分析
蒋 静(沭阳县市场监督管理局药械监管科,江苏 沭阳 223600)
某县近3年中成药不良反应的分析
蒋 静
(沭阳县市场监督管理局药械监管科,江苏 沭阳 223600)
【摘要】目的 了解我县近三年中成药不良反应(ADR)监测工作状况,促进合理使用中成药。方法 收集我县2013年~2015年上报至国家药品不良反应监测中心的中成药ADR报告,对患者的性别、年龄、给药途径、涉及药物品种、临床表现等进行统计和分析。结果 762例中成药ADR 监测报告中,中成药ADR的高发年龄段为40~79岁,共486例(占总例数的(63.78%,下同);发生率最高的给药途径是注射给药,共622例(81.63%);中成药引发ADR的前8位药品都为注射剂,共443例(58.14%),主要临床表现以为皮肤及附件损害最多,共256例(33.60%)。结论 加强和重视中成药ADR的监测工作,特别是中药注射剂ADR监测工作,是临床合理用药、安全用药的一项重要内容。
【关键词】中成药;药物不良反应;分析
近年来,随着中成药用量的不断增加,其不良反应也日渐增多,中成药ADR带来的危害已日益引起人们的关注。其原因是多方面的,有制药工艺的问题,有多药配伍的问题,也有用药不恰当的问题等。2001年12月1日施行的《中华人民共和国药品管理法》第七十一条规定:“国家实行ADR报告制度。药品生产企业、药品经营企业和医疗单位必须经常考察本单位所生产、经营、使用的药品质量、疗效和反应。发现可能与用药有关的严重ADR,必须及时向省、自治区、直辖市人民政府药品监督管理局和卫生行政部门报告[1]”。《药品不良反应报告和监测管理办法》已于2011年7月1日起正式施行。法律法规的健全与完善推动着我国中成药ADR监测工作的进一步开展,给临床安全用药提供了法律保障。
1 现状分析
《药品不良反应报告和监测管理办法》将药品不良反应(ADR)定义为“合格药品在正常用法用量下出现的与用药目的无关的有害反应[2]”,清晰而准确地将ADR限定为一种伴随正常药物治疗的风险。根据WHO在发展中国家的资料调查,住院患者的ADR发生率为10%~20%,其中有5%的患者是因ADR而住院的。对于中成药注射剂的不良反应已经引起人们的强烈关注[3-4]。中药汤剂讲究“辨证论治”,注重药味组成、用量的随证加减,以达到用药安全效果。而中成药是按照既定的处方,依一定的生产工艺制成的制剂,在临床应用时缺乏灵活性,不能做到随证加减。ADR是药物治疗中必须伴随的风险,它的发生并不完全取决于药物本身,可因性别、年龄、个体差异、患者病理状况、生活环境、饮食习惯、给药途径、联合用药等的不同而产生。
2 材料来源与分析方法
收集我县2013年~2015年上报至国家药品不良反应监测中心的中成药ADR报告,对患者的性别、年龄、给药途径、涉及药物品种、临床表现等进行统计和分析,以掌握我县中成药ADR发生的一般规律及特点,降低药物不良反应的发生率,更好地为临床合理用药提供依据。
3 结果评价
3.1 中成药ADR患者的性别和年龄分布:762例不良反应报告中,男性366例(48.03%),女性394例(51.70%),另有2例性别不详,男女之比为1∶1.08。ADR在各年龄段均有发生,最小年龄4个月,最大年龄95岁,高发年龄段为40~79岁,共486例(63.78%),具体分布见表1。

表1 发生ADR的患者的年龄分布
3.2 给药途径:762例中成药ADR报告中,以注射给药导致的ADR最多,共622例(81.63%),其中静脉滴注方式给药共606例(79.53%),肌内注射方式给药共16例(2.10%);其次为口服给药给药方式,共133例(17.45%);其他给药方式为7例(0.92%)。见表2。

表2 发生ADR的给药途径分布
从分析的结果可以看出,中成药的不良反应还是集中在注射剂型方面,这和目前不断报道的文献结果是吻合的,也反映出中药注射剂在生产工艺、药物配伍、药理毒理等方面还有大量工作要做。
3.3 中成药ADR涉及的药物分布:762例中成药ADR中,涉及的药物有132个品种,其中前8位的品种都为中药注射剂,其共引起的ADR总数为443例,占总数的58.14%,充分说明了ADR监测工作对中药注射剂的质量评价和品种的选择有积极的意义。具体引起ADR的前8位中成药药物分布见表3。

表3 引起ADR的药物类别及构成比
3.4 中成药ADR累及的器官/系统分类及临床表现:762例中成药ADR累及多个器官/系统,其中以皮肤及附件损害最多,临床表现以皮疹、瘙痒为主,其次为神经系统及消化系统。ADR累及的器官/系统及临床表现见表4。
通过对我县近三年中成药的ADR的监测工作的分析,发现还存在以下一些问题:如ADR监测报告表项目填写不全,不良反应过程表述不准确,例如症状发生时间表述、采取措施表述等;不良反应分类不准确,有的不良反应为新的不良反应,说明书没有记载的,但被填为一般不良反应。
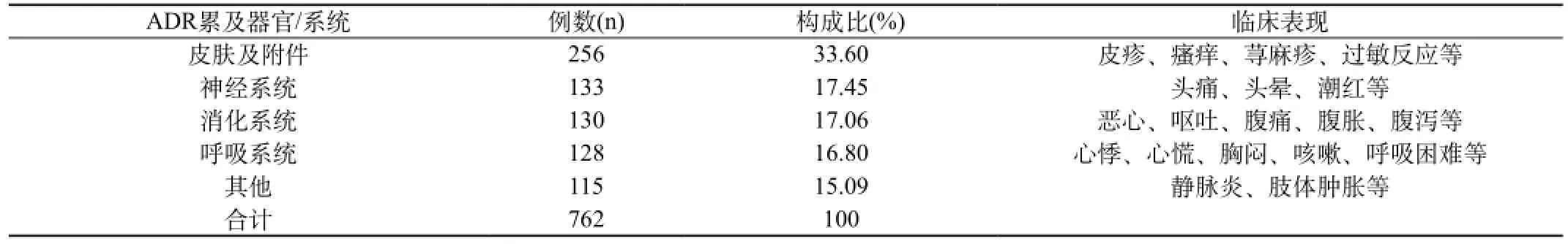
表4 中成药ADR累及器官/系统及临床表现
4 结 论
加强和重视中成药ADR监测工作,是保证临床安全、有效、合理用药的一项重要内容。要把中成药ADR检测工作做好,必须强化药品生产、经营、使用单位以及药品监管部门对中成药ADR危害性的认识,要广泛收集上报中成药ADR监测报告,特别关注中药注射剂ADR监测工作,为中成药的合理用药提供支持。
参考文献
[1] 中华人民共和国.中华人民共和国药品管理法[S].中华人民共和国主席令第45号,2001-02-28.
[2] 卫生部.药品不良反应报告和监测管理办法[S].卫生部令第81号,2011-05-04.
[3] 周超凡,徐植灵,林育华.中药注射剂的回顾和展望[J].中国中药杂志,2006,31(24):2094-2096.
[4] 王越,崔佳,徐厚明,等.我国中药注射剂不良反应10年文献计量学评析[J].药物流行病学杂志,2007,16(3):129-132.
中图分类号:R954
文献标识码:B
文章编号:1671-8194(2016)10-0187-02

