芍药苷对血虚肝郁证大鼠海马CA1区sGCβ1和5种PDE亚型蛋白表达的影响
王景霞 周恬恬 朱映黎 王成龙 吴丽 张建军
·论著·
芍药苷对血虚肝郁证大鼠海马CA1区sGCβ1和5种PDE亚型蛋白表达的影响
王景霞周恬恬朱映黎王成龙吴丽张建军
100029北京中医药大学基础医学院中药教研室[王景霞、周恬恬(硕士研究生)、朱映黎(博士研究生)、王成龙(硕士研究生)、吴丽(硕士研究生)、张建军]
【摘要】目的研究芍药苷对血虚肝郁证大鼠海马环磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)含量及CA1区cGMP合成酶即可溶性鸟苷酸环化酶(soluble guanylyl cyclaseβ1,sGCβ1)和水解酶即磷酸二酯酶(phosphodiesterase,PDE)不同亚型(PDE1A、PDE2A、PDE5A、PDE9A、PDE10A)蛋白表达的干预作用。方法56只SD大鼠随机分为空白组、模型组、芍药苷高剂量组、芍药苷低剂量组,每组14只。采用辐射结合束缚法建立血虚肝郁证模型,空白组、模型组灌胃等量蒸馏水,给药组分别灌以40 mg/kg、 20 mg/kg的芍药苷,共造模21天。治疗结束后,采用放射免疫法测定cGMP含量;免疫组化法检测sGCβ1、PDE1A、PDE2A、PDE5A、PDE9A、PDE10A的蛋白表达。 结果与模型组相比,芍药苷高剂量组可降低cGMP含量(P<0.01),并下调PDE1A、PDE2A、PDE5A、PDE9A的蛋白表达(P<0.05),且上调PDE10A的蛋白表达(P<0.05)。结论芍药苷对于cGMP水解酶不同亚型存在双向调控,与抑制合成酶发挥协同作用,降低cGMP的含量,下调NO/cGMP通路,从而改善血虚肝郁证引起的大脑功能损伤。
【关键词】血虚肝郁证;芍药苷;环磷酸鸟苷;磷酸二酯酶;可溶性鸟苷酸环化酶
白芍为毛茛科植物芍药PaeoniaLactifloraPall. 的根,首载于《神农本草经》,苦酸微寒,归肝脾经,功能养血敛阴,柔肝止痛,平抑肝阳,是临床治疗血虚肝郁证的常用药物[1]。芍药苷是白芍的主要有效成分,课题组前期研究表明其对血虚肝郁证候模型大脑功能损伤确有改善作用[2],并发现其作用机制可能与调节环磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)的合成和水解有关[3-4],但具体作用靶点尚不明确。由于影响cGMP水解的磷酸二酯酶(phosphodiesterase,PDE)存在多种亚型[5],其中PDE1、PDE2、PDE10作为针对cGMP和cAMP两种底物的水解酶类,又存在着对于cGMP含量调节的不一致[6]。故本实验通过观察芍药苷对血虚肝郁模型大鼠海马cGMP含量及CA1区cGMP合成酶即可溶性鸟苷酸环化酶(soluble guanylyl cyclase β1,sGCβ1)和水解酶即磷酸二酯酶各亚型PDE1A、PDE2A、PDE5A、PDE9A、PDE10A蛋白表达的干预作用,探讨cGMP与血虚肝郁证的内在联系,以及芍药苷影响模型大鼠海马cGMP动态平衡的高效靶点。
1材料与方法
1.1实验动物
雄性SD大鼠56只,清洁级,体质量180~200 g,由斯贝福(北京)实验动物技术有限公司提供,动物许可证编号:SCXK(京)2011-0004。
1.2实验药品
芍药苷:自制,经白芍饮片提取分离精制而成,HPLC法测定纯度高达96%;白芍饮片购自安徽亳州,由北京中医药大学基础医学院中药教研室鉴定。
1.3试剂与仪器
鸟苷酸环化酶测试盒(北京华英生物技术研究所);ab24824兔抗大鼠sGCβ1(批号:GR89594-9,购自Abcam公司);ab14599兔抗大鼠PDE1A(批号:GR86777-8,购自Abcam公司);ab125677兔抗大鼠PDE2A(批号:GR9115-4,购自Abcam公司);ab14672兔抗大鼠PDE5A(批号:GR69387-5,购自Abcam公司);ab125672兔抗大鼠PDE9A(批号:GR168578-1,购自Abcam公司);ab177933兔抗大鼠PDE10(批号:GR141519-3,购自Abcam公司);abSV0002-兔IgG两步法免疫组化试剂盒(批号:08CD4A,购自武汉博士德公司生物工程有限公司);DAB试剂盒(批号:1309170031,购自福州迈新生物技术开发有限公司)。
1.4分组和给药
雄性SD大鼠56只,随机分为空白组、模型组、芍药苷低剂量组(20 mg/kg)和芍药苷高剂量组(40 mg/kg)分别相当于白芍饮片的1 g/kg、2 g/kg,每组14只。从造模第1天开始给药,正常组和模型组灌胃等量蒸馏水,其余各组灌胃相应药物,共造模21天。
1.5造模方法
不难看出, 有限差分近似式(3)引入了两类数值误差. 数值色散修正的是波的相速度, 即c*(ξ)=; 数值耗散修正的是波的振幅, 记作e-λt, 衰减率对应于一种特征衰减时间尺度的倒数, 该时间尺度仅当时才有意义.
大鼠常规单笼饲养适应数天后称重。除正常组外,其余各组每天不定时束缚3小时,于束缚第7天,釆用60Co-γ放射源全身辐照1次,剂量为3.5 Gy,剂量率为191.55 cGy/min,辐照距离4 m。辐照后,各组大鼠继续单笼饲养,模型组每天不定时束缚3小时,连续14天[7]。
1.6放射免疫法检测cGMP含量
于造模结束后第2天,动物断头取海马组织,匀浆后加入2 mL无水乙醇离心,取上清;用75%乙醇洗沉淀,匀浆后再离心;去上清,于60℃烤箱烘干备用。按试剂盒操作,测定大鼠海马组织中cGMP含量。以全自动放射免疫-γ-计数器测定沉淀组织中每分钟的放射性脉冲数,并采用Log-Logic数学模型拟合标准曲线,由计算机读出测定值。
1.7免疫组化法测定芍药苷对血虚肝郁证大鼠sGCβ1及5种PDE亚型蛋白表达的影响
于造模结束后第2天,各组取7只大鼠,用生理盐水和多聚甲醛进行心脏灌流固定;取大鼠脑组织置于4%多聚甲醛溶液中4℃固定24小时后,石蜡包埋切片。经常规脱蜡处理后,置于3%H2O210分钟灭活内源性酶,浸入0.01 mol/L枸橼酸盐缓冲液热修复10分钟;滴加5% BSA封闭液,37℃滴加一抗,4℃过夜,滴加聚合HRP标记抗兔IgG(SV-0002)。以上各步之间除5%BSA封闭液外均用0.1 mol/L PBS洗3次,每次3分钟。使用DAB显色试剂盒室温显色,蒸馏水充分洗涤,苏木精复染;脱水封片。用Nikon 4500数码相机和Nikon E200型显微镜组合拍摄图像,Image pro Plus 6.0图像分析系统进行图像分析。每组随机测试5张切片,每张切片测试一个视野,测定光密度(intergralopt density,IOD)。
1.8统计学处理
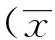
2结果
经过21天的复合造模,模型组大鼠大脑中第二信使发生了较大改变。与空白组相比,海马组织cGMP含量显著升高(P<0.01);与模型组相比,给予高剂量芍药苷能降低cGMP含量,差异显著(P<0.01)。见表1。
2.2芍药苷对海马CA1区sGCβ1及5种PDE亚型蛋白表达的影响
经过21天的复合造模,模型组大鼠海马中cGMP合成酶与水解酶都发生了变化,其中sGCβ1蛋白表达较空白组有所升高,但差异无统计学意义;与空白组相比,PDE1A、PDE2A、PDE5A、PDE9A蛋白表达显著升高(P<0.05),PDE10A蛋白表达显著降低(P<0.05)。

表1 各组大鼠海马组织cGMP的含量
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.01。
与模型组相比,给予低剂量芍药苷有降低sGCβ1和PDE1A蛋白表达的趋势,但无统计学差异;并能显著降低PDE2A、PDE5A、PDE9A蛋白的表达(P<0.05),升高PDE10A蛋白的表达(P<0.05)。
与模型组相比,给予高剂量芍药苷可以降低sGCβ1蛋白的表达,并能够降低PDE1A、PDE2A、PDE5A、PDE9A蛋白表达(P<0.05),升高PDE10A蛋白的表达(P<0.05)。见表2,图1~6。

表2 各组大鼠海马组织sGCβ1、PDE1A、 PDE2A、PDE5A、PDE9A、PDE10A积分光密度
注: 与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。

A空白组B模型组C芍药苷低剂量组D芍药苷高剂量组
图1各组大鼠海马 CA1 区 sGCβ1表达的影响(IHC ×200)
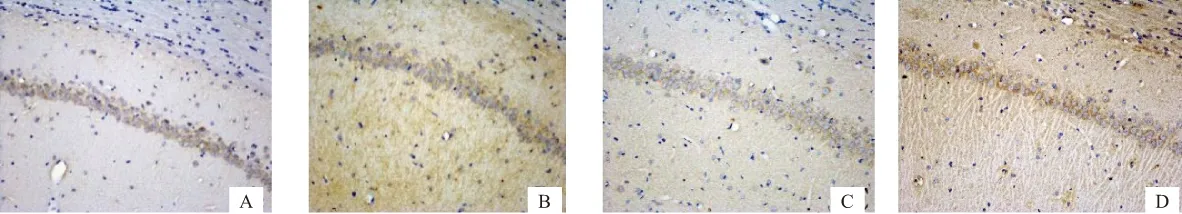
A空白组B模型组C芍药苷低剂量组D芍药苷高剂量组
图2各组大鼠海马 CA1 区 PDE1表达的影响(IHC ×200)

A空白组B模型组C芍药苷低剂量组D芍药苷高剂量组
图3各组大鼠海马 CA1 区 PDE2表达的影响(IHC ×200)
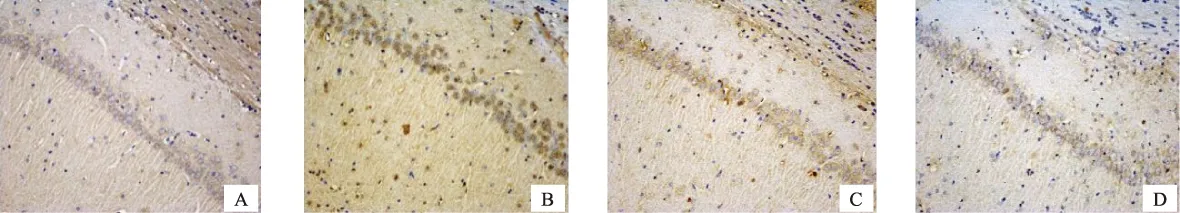
A空白组B模型组C芍药苷低剂量组D芍药苷高剂量组
图4各组大鼠海马 CA1 区 PDE5表达的影响(IHC ×200)

A空白组B模型组C芍药苷低剂量组D芍药苷高剂量组
图5各组大鼠海马 CA1 区 PDE9表达的影响(IHC ×200)

A空白组B模型组C芍药苷低剂量组D芍药苷高剂量组
图6各组大鼠海马 CA1 区 PDE10表达的影响(IHC ×200)
3讨论
血虚肝郁证常见于现代医学的慢性心理应激引起的多种疾病[8]。而“肝主疏泄”和“肝主藏血”的功能可维持和促进全身气血的正常运行,调适各脏器对应激的反应。由于肝体阴而用阳,喜柔而恶刚,所以治疗当养血柔肝,以柔制刚,顺应肝的条达之性[9]。因此,养血柔肝也是中医抗慢性应激常采用的治疗法则。辐照结合束缚应激建立的血虚肝郁证候模型,形成了强烈的刺激,使得模型大鼠处于持续应激状态,必将导致大脑功能结构的异常。
慢性应激中信号通路失调,抗应激作用与脑中功能异常的NO/cGMP信号通路的正常化有关[10]。而cGMP作为新的信使分子,通过激活下游效应分子cGMP依赖性蛋白激酶、环核苷酸门控离子通道和磷酸二酯酶的合成来发挥多种生物效应,影响丝氨酸/苏氨酸磷酸化[11],影响信号转导[12],以及细胞内Ca2+浓度,介导细胞效应[13]。前期研究结果表明[3],芍药苷可以对抗应激产生的海马区谷氨酸(glutamic acid,Glu)和NO含量的升高,从而下调NO/cGMP信号通路,本实验通过测定海马组织cGMP含量,也验证了芍药苷对cGMP水平的下调作用。
现代研究表明,sGC作为NO的受体及cGMP合成酶,sGC的活化、失活以及脱敏对于NO信号通路非常重要[14]。NO与sGC结合后会激活sGC的催化活性, 即催化GTP转化为cGMP。因此,以sGC为靶标的疾病治疗手段可以消除过多NO细胞毒性及NO耐受性的缺陷[15],sGC抑制剂ODQ可下调NO/cGMP通路,增强4 mg/kg(亚有效剂量)芍药苷的作用[16]。本实验结果表明,芍药苷能显著减少sGCβ1的蛋白表达,说明芍药苷能通过发挥sGC抑制剂样作用,直接影响合成酶活性,导致cGMP生成减少。而由于cGMP参与调解抑郁焦虑与学习障碍等中枢神经系统疾病,它的含量是由合成酶和水解酶共同调控的,磷酸二酯酶PDE5、PDE9特异性水解cGMP, PDE1、PDE2、PDE10能同时水解环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和cGMP[17]。研究表明,PDE5和PDE9的抑制剂被认为是改善记忆和增加神经发生的候选药,并且二者表达和活性的增强影响cGMP浓度的下降[18-19]。而PDE1和PDE2作为双重底物酶,对cGMP和cAMP含量的影响并不一致;PDE2抑制剂可以选择性提高兴奋性突触cGMP水平,并提高突出可塑性和记忆功能[20]。本实验结果显示,给予芍药苷后能显著下调PDE5、PDE9的表达,降低PDE1和PDE2的表达,升高PDE10的表达。另一方面,由于PDE2抑制剂具有增加NO活性、反馈调节NO/cGMP通路、增加cGMP含量的作用[21],而芍药苷所引起的PDE10的上调又对抗了由于PDE抑制剂样作用反馈引起的cGMP的合成,所以推测芍药苷是通过作用于多个靶点,相互影响,从而发挥最终的调节效应。
综上,芍药苷对于血虚肝郁证的干预作用可能是参与了NO/cGMP通路中影响cGMP含量的多个环节,不仅通过降低sGC含量进一步下调NO,还对PDE不同亚型存在双向调节的功能,综合抵抗机体应激引起的cGMP的升高,发挥神经保护作用。芍药苷针对sGC和PDE10等高效靶标的调控作用,有可能就是揭示白芍养血柔肝解郁的作用特点和优势的重要环节。但是,作为共同参与情志调节,影响神经细胞兴奋性的cAMP,也能被PDE水解,芍药苷对PDE不同亚型的影响是否同时参与了cAMP含量的调节,cAMP与cGMP是否存在动态平衡,两条通路间是否存在共同的高效靶点,还需要进一步深入的研究。
参考文献
[1]高学敏,钟赣生. 临床中药学[M].石家庄:河北科学技术出版社, 2006:906.[2]李艳霞,张建军,王景霞,等. 芍药苷对血虚肝郁证大鼠下丘脑-垂体-肾上腺轴和单胺类神经递质的影响[J]. 中华中医药杂志,2014,29(8):2591-2595.
[3]王景霞,张建军,屈胜胜,等. 芍药苷对血虚肝郁证候模型大鼠海马CA3区组织形态及一氧化氮通路的影响[J]. 北京中医药大学学报,2015,38(2):85-88,145.
[4]朱映黎,张建军,王景霞,等. 芍药苷对血虚肝郁证模型大鼠海马cGMP含量及其合成与水解酶的影响[J]. 中华中医药杂志,2015,30(3):818-820.
[5]陈玲,徐英,潘建春. 磷酸二酯酶参与认知与情绪调节的研究进展[J]. 中国药理学与毒理学杂志,2012,26(3):357-362.
[6]杨菊. 磷酸二酯酶及其抑制剂的研究现状[J]. 中国厂矿医学,2009,22(2):216-218.
[7]张建军,李艳霞,王景霞,等. 辐照结合束缚应激致血虚肝郁大鼠证候模型的建立[J]. 中华中医药杂志,2014,29(7):2176-2179.
[8]赖永德,金红波. 探讨血虚肝郁与抑郁症的发生[J]. 四川中医,2009,(2):30-31.
[9]李峰,杨维益,梁嵘,等. 从中医学看肝脏调节应激反应的作用[J]. 北京中医药大学学报,1998,21(1):20-22,72.
[10]Reierson GW, Mastronardi XA, Licinio J, et al. Repeated antidepressant therapy increase cyclic GMP signaling in rat hippocampus[J]. Neurosci Lett, 2009, 466(3):149-153.
[11]Revelli A, Ghigo D,Moffa F, et al. Guanylate cyclase activity and sperm function[J]. Endocr Rev, 2002, 23(4):484-494.
[12]Schlossmann J, Feil R, Hofmann F. Insights into cGMP signalling derived from cGMP kinase knockout mice[J]. Front Biosci, 2005, 21(10):1279-1289.
[13]Bender AT, Beavo JA. Cyclic nucleotide phosphodiesterases: molecular regulation to clinical use[J]. Pharmacol Rev, 2006, 58(3):488-520.
[14]陈尧,黄东晖. GC/cGMP信号转导途径在雄性生殖作用的研究进展[J]. 生殖与避孕,2013,33(12):842-848.
[15]潘洁,钟方芳,王红艳,等. 可溶性鸟苷酸环化酶介导NO信号转导的结构基础及其分子机制研究[J]. 中国科学:化学,2014,44(4):572-585.
[16]王景霞,张建军,李伟,等. 芍药苷抗抑郁作用与NO/cGMP通路相关性研究[J]. 中药与临床,2012,3(1):27-28,37.
[17]陈昌亮,黄爽. 磷酸二酯酶及其抑制剂的研究进展[J]. 中国药理学通报,2014,30(2):283-286.
[18]Puzzo D, Staniszewski A, Deng SX, et al. Phosphodiesterase 5 inhibition improves synaptic function, memory, and amylaid-beta load in an Alzheimer’s disease mouse model[J]. J Neurosci, 2009, 29(25):8075-8086.
[19]李杰,陈浩,陈国良. 磷酸二酯酶9及其抑制剂的研究进展[J]. 沈阳药科大学学报,2009,26(5):409-414.
[20]陈玲,徐英,潘建春. 磷酸二酯酶参与认知与情绪调节的研究进展[J]. 中国药理学与毒理学杂志,2012,26(3):357-362.
[21]Boess FG, Hendrix M, Van derStaay FJ,et al.Inhibition of phosphodiesterase 2 increases neuronal cGMP synaptic plasticity and memory performance[J]. Nenuropharmacology, 2004,47(7):1081-1092.
(本文编辑: 韩虹娟)
Effects of paeoniflorin on the expression of SGCβ1, different subtypes of PDE in the hippocampus CA1 Zone of rats with blood deficiency and liver depression syndrome
WANGJing-xia,ZHOUTian-tian,ZHUYing-li,etal.
SchoolofBasicMedicalScience,BeijingUniversityofChineseMedicine,Beijing100029,ChinaCorrespondingauthor:ZHANGJian-jun,E-mail:zhangjianjun@bucm.edu.cn
【Abstract】ObjectiveTo observe the influence of paeoniflorin on the content of cGMP and the protein expressions of cGMP synthase namely SGCβ1 and hydrolases PDE1A, PDE2A, PDE5A, PDE9A, PDE10A in the hippocampus CA1 zone of rats with blood deficiency and liver depression syndrome. MethodsThe rat model was established by chronic restraint stress combined with irradiation. From the 1st day of modeling, the normal and model group was treated with same amount of distill water, the treatment group were given corresponding medicines. On the 21th day of modeling, the brain tissue and hippocampus were removed. The content of cGMP was detected by RIA. IHC was used to observe the protein expressions of sGCβ1, PDE1A, PDE2A, PDE5A, PDE9A and PDE10A. ResultsCompared with the model group, the content of cGMP in the dose of 40mg/kg Paeoniflorin was reduced (P<0.01) and the protein expressions of PDE1, PDE2A, PDE5A, PDE9A were reduced (P<0.05), and the protein expressions of PDE10A were increased significantly (P<0.05). ConclusionsPaeoniflorin could play a role of dual-directional regulation effects on the activities of different subtypes of hydrolases, which give play to synergistic effect with the inhibition of synthase, and comprehensively reduce the content of cGMP to relieve the brain damage of the blood deficiency and liver depression syndrome.
【Key words】Blood deficiency and liver depression syndrome;Paeoniflorin;Cyclic guanosinc monophosphate;Phosphodiesterase;Soluble guanylyl cyclase β1
基金项目:国家自然科学基金面上项目(81173569)
作者简介:王景霞(1976- ),女,博士,副教授,硕士生导师。研究方向:中药药性基本理论。E-mail: wjx117@sohu.com 通讯作者: 张建军(1965- ),博士,研究员,博士生导师。研究方向:基于中药基本理论的药效机理及物质基础研究。E-mail: zhangjianjun@bucm.edu.cn
【中图分类号】R285.5
【文献标识码】A
doi:10.3969/j.issn.1674-1749.2016.07.004
(收稿日期:2015-10-21)

