CD4/CD45双色单平台法检测HIV感染者CD4+T淋巴细胞研究进展
许亚宁,张 辉,肖 瑶
·专题综述·
CD4/CD45双色单平台法检测HIV感染者CD4+T淋巴细胞研究进展
许亚宁,张辉,肖瑶
[摘要]CD4+T淋巴细胞计数是评价AIDS疾病进展和抗病毒治疗效果的重要指标。本文介绍了流式细胞仪CD4+T淋巴细胞计数方法的发展历史。将CD4/CD45双色单平台法的准确性、可靠性和经济性与其他方法进行了比较。表明该法简便、廉价且实用性强。同时介绍了当前适用于CD4/CD45双色单平台法的几款流式细胞仪的机型特点。
[关键词]HIV;CD4+T淋巴细胞计数;抗原,CD45;流式细胞术
DOI∶ 10.3969/j.issn.1007-8134.2016.03.014
HIV感染引起的AIDS是世界性公共健康问题[1]。根据美国疾病预防控制中心(Centers for Disease Control and Prevention, CDC)2015年调查统计,世界约有3690万人携带HIV,累计约有7600万人感染HIV,3900万人死于AIDS,仅2014年死亡人数就超过120万人[2]。HIV感染的典型特征是CD4+T淋巴细胞数量减少,T淋巴细胞功能受损和机体免疫功能缺陷。2014年5月更新的《HIV-1感染的成年人和青少年的抗逆转录病毒药物使用指南》中将CD4+T淋巴细胞绝对计数作为AIDS检测的重要标准。一直以来,研究人员使用传统的双平台三色以上荧光抗体染色法进行CD4+T淋巴细胞绝对计数,但是这些方法检测费用昂贵,对实验室设备、人员和检测样本要求较高,不适宜进行高通量的HIV检测。随着科技的发展,新兴的CD4/CD45双色流式细胞仪单平台法检测CD4+T淋巴细胞不仅操作简单,价格低廉,而且准确性高,能够作为标准方法广泛推广。
1 CD4+T淋巴细胞计数的发展
CD4+T淋巴细胞计数始于20世纪90年代,采用双平台法,使用血液分析仪检测淋巴细胞总数,使用流式细胞仪CD3/CD4或CD3/CD4/CD45抗体检测CD4+T淋巴细胞所占淋巴细胞百分比,由此计算出CD4+T淋巴细胞数[3]。1996年O’Gorman和Gelman[4]提出使用流式细胞仪单平台法进行CD4+T淋巴细胞绝对计数。单平台法是指通过一台流式细胞仪直接检测淋巴细胞亚群绝对数量,计数原理包括直接体积计数、内参照微球计数、毛细管计数、阻抗法计数和推进器容积计数等,但由于技术手段问题,淋巴细胞绝对计数的准确性和重复性略显不足。鉴于各种方法的不统一性,1997年美国CDC更新CD4+T淋巴细胞计数指导方针,推荐用双平台法进行CD4+T淋巴细胞计数[5]。此法不足之处在于:①不同操作者和不同操作方式得出不同的淋巴细胞计数结果;②无法进行两台设备间的质控和室间质控;③血液分析仪中的淋巴细胞定义有异于流式细胞仪中的淋巴细胞,造成系统差异;④多种抗体和消耗品的使用导致成本偏高。2002年Glencross等[6]提出CD4/CD45双色法:使用CD45辅助白细胞设门法,基于白细胞而不是单纯的淋巴细胞进行设门,由血液分析仪的白细胞绝对计数和流式细胞仪的CD4+T淋巴细胞相对计数计算出CD4+T淋巴细胞数量。随后,加拿大CDC于2003年颁布了单平台CD45辅助白细胞设门法的CD4+T淋巴细胞绝对计数指导方针,对双色单平台法进行详述和推荐[7]。至此,CD4/CD45双色单平台法测定CD4+T淋巴细胞绝对计数趋于成熟稳定。
CD4/CD45双色单平台法通过设门的方法测定CD4+T淋巴细胞绝对计数和相对计数。首先,在CD45/SSC(side scatter,侧向角散射)散点图中调整SSC和CD45(图1),使所有白细胞群均可见,并圈定白细胞群(R3),其次,根据白细胞群(R3)设门再设定CD4/SSC散点图,通过设门将表达CD4的阳性淋巴细胞亚群(R1)和CD4阴性淋巴细胞亚群(R2)进行区分,CD4弱表达的单核细胞干扰可通过其在SSC坐标的位置进行区分,并通过修改SSC坐标进行调整。CD4+T淋巴细胞绝对计数由R1得出,CD4细胞相对计数为CD4+/CD45+比值,也叫做CD4+T淋巴细胞相对计数百分率[8]。
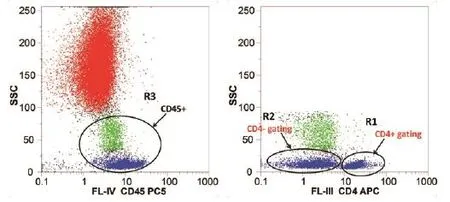
图1 CD4/CD45双色单平台法CD4+ T淋巴细胞计数Figure 1 CD4/CD45 two-color single-platform protocol for CD4+T lymphocyte enumeration
2 单平台双色和多色免疫分型的比较
许多指导手册提出,使用流式细胞仪对HIV感染者进行CD4+T淋巴细胞计数必须加强质量控制,增强数据可靠性[9]。策略包括增加CD3抗体的使用,同时具有CD4和CD3双阳性的淋巴细胞,才被认为是有指导意义的辅助性T淋巴细胞。美国国家过敏和传染病研究所AIDS分所建议使用多色抗体组合的方法,例如使用CD3/CD4确定T淋巴细胞/辅助性T淋巴细胞群;使用CD3/CD8确定T淋巴细胞/抑制性T淋巴细胞群。在多色抗体组合方案中对CD3阳性细胞的重复性有要求,重复结果差异应≤3%,如果>3%,说明样本的管间变异较大,建议重新检测此样本。一般来讲,成年人外周血中CD4+CD3+T淋巴细胞和CD8+CD3+T淋巴细胞百分比的总和应该等于CD3+T淋巴细胞的百分比,变化范围为5%~10%,如果超出此变化范围,须要考虑其他因素,例如样本中可能大量存在异常T淋巴细胞亚群。
CD4/CD45双色法建立之初,关于HIV感染者中CD4+T淋巴细胞绝对计数采用双色法或多色法分析具有争议,CD4/CD45法的准确性、重复性成为研究内容。Pattanapanyasat等[10]对611例HIV感染者样本使用CD4/CD45双色和CD3/CD4 /CD45三色法进行CD4+T淋巴细胞计数,2种方法的CD4+T淋巴细胞相对计数差异为0.03%。与三色法相比,双色法检测成本由12美元降低至2.5美元。Sippy-Chatrani 等[11]使用150例HIV感染者血液样本比较CD4/CD45双色法与CD3/CD4/CD8/CD45四色法CD4+T淋巴细胞绝对计数。结果表明,2种方法测量所得CD4+T淋巴细胞绝对计数和相对计数具有高度一致性(r2=0.95、0.98),无显著偏差,测试成本由25美元节约至8美元。由于操作简便,对研究人员技术要求低,结果准确,可重复性高以及成本低廉,CD4/CD45双色法不再局限于资源紧张或者疾病的高发地区,逐渐引起广泛的关注。2008年Denny等[12]使用不同品牌流式细胞仪对99 例HIV感染者样本进行CD4+T淋巴细胞绝对计数检测,用以评估CD4/CD45双色法与四色法的精确性。研究表明,CD4/CD45双色法数据一致性和精确性均高于传统的四色法。推荐所有临床和科研机构,特别是进行大批量样本处理的机构,使用此方法提高实验数据的可靠性和可重复性。与此同时,我国学者也对CD4/CD45法进行评估,旨在评价样本采集后不同放置时间是否影响检测结果的准确性和重复性。结果表明CD4/CD45法简便准确、重复性好、误差小,对于陈旧样本(采集后不超过6 d)的分析有独到的优势[13]。CD4/CD45双色法与多色法在CD4+T淋巴细胞绝对计数检测方面具有较高的一致性,而且大大降低测试成本,尤其适合我国国情。
3 CD4+T淋巴细胞计数单平台法与双平台法的比较
与传统的双平台CD4+T淋巴细胞计数法相比,CD4/CD45单平台法自创建起就备受争议。1999 年Barnett等[14]使用三种单平台系统(FlowCount/ Beckman Coulter、 TruCount/Becton Dickinson、CytoronAbsolute/Ortho Clinical Diagnostics)进行CD4+T淋巴细胞绝对计数检测,并与CD4/CD45双平台法进行比较。对于固定血液样本,单平台法的相关性优于双平台法(CV值分别为13.7%和23.4%),出于对实验重复性的考虑,作者建议使用单平台法。文章指出,使用计数微球进行体积测定的操作中,不同的操作手法会造成较大差异性,某些材质的计数微球也会由于形成多聚体造成结果偏差。2002年,Glencross等[15]使用CD4/CD45双色双平台和单平台法进行CD4+T淋巴细胞计数检测,结果发现,2种方法的CD4+T淋巴细胞计数具有良好的一致性(r=0.94),单平台体积法和微球法不仅具有高度准确性,而且可以进行内部控制和外部控制,能够作为标准的CD4+T淋巴细胞计数检测方法进行使用。同年,Janossy 等[16]使用单平台体积法和微球法对600例样本进行CD4+T淋巴细胞绝对计数。与双平台法比,2种单平台法均保证了结果的准确度,并可降低93%的试剂成本。2006年,Karcher等[17]使用两种单平台法[Cyto-Spheres /Beckman Coulter和 CyFlow Counter/Partec (CD4/CD45)]进行CD4+T淋巴细胞绝对计数检测,并与双平台双色法(FACScan/ Becton Dickinson)进行比较。结果证明,使用绝对体积真实计数的CyFlow Counter避免了CytoSpheres使用计数微球造成的误差,在准确度和相关性上,CyFlow Counter均比CytoSpheres效果好(r = 0.929、0.725)。此外,CyFlow Counter由于价格低廉(1.75~2.00欧元/样本),操作简单,结果快速(10样本/h),尤为推荐在经济不发达地区使用。随着科技发展,单平台法以其简便的操作,高度的准确性和一致性,已经逐渐替代双平台法成为主要的CD4+T淋巴细胞计数检测方法。
4 目前采用单平台法CD4+T淋巴细胞绝对计数常用机型
随着科技的发展,许多商业化的单平台技术被大力研发和广泛使用,表1例举了一些常见的可使用CD4/CD45法的流式细胞仪品牌机型。以下选取部分代表性机型进行讨论。 CyFlow Counter 和CyFlow miniPOC(Point of Care)是由德国Partec公司生产的桌面式流式细胞仪,配备有532 nm的绿色固态激光,3个光学信号通道,可使用CD4/ CD45双色法进行CD4+T淋巴细胞计数[18]。系统使用机械方法进行体积测量,省去微球的使用直接计算进样体积,减少任何与微球浓度变化相关的误差。由于系统精准性较高,对操作者技术要求较低,适用于偏远地区或者患者分散地区,每日最大检测量为400个样本。FACSCalibur是Becton Dickinson为常规免疫表型分析所研制的一款流式细胞仪,仪器最多可配备488 nm蓝色和635 nm红色气态激光,可使用CD4/CD45设门法和微球计数法对CD4+T淋巴细胞绝对计数[19]。样本制备至检测需要1 h左右,对实验技术要求低,适用于每日样本量小于50的实验室。Cytomics FC 500流式细胞仪是Beckman Coulter研制的产品,配备488 nm蓝色激光器,可检测5种荧光通道[20]。仪器可使用CD4/CD45设门法进行CD4+T淋巴细胞绝对计数,通过微球法进行体积定量。样本检测需100 μl全血,样本准备需1 h左右。EPICS XL流式细胞仪是Beckman Coulter的产品,最多检测四色荧光,配合使用计数微球和相关抗体可检测CD4+T淋巴细胞绝对计数。BriCyte E6系统是迈瑞公司研发的中国第一款流式细胞仪,其配备488 nm蓝色激光和638 nm红色激光,可检测6种荧光通道。使用计数微球和CD4/CD45设门法进行CD4+T淋巴细胞绝对计数检测。由于体积较大,不便于搬运携行,适合高通量样本检测的医疗科研机构,并须配备专业操作人员。
5 展 望
我国自1985年发现首例AIDS患者以来,HIV/ AIDS在我国已经历传入期和局部流行期,进入了快速增长期,并且正由高危人群向一般人群传播,HIV未能确诊及晚期诊断是目前我国存在的典型问题。诊断时,外周血CD4+T淋巴细胞计数是预测短期和长期病死率的一项强有力的指标,目前由于我国大部分病例处于农村和边远地区,离体24 h内的新鲜标本较难得到[21-22],为CD4+T淋巴细胞检测提出挑战。CD4/CD45法采用基于白细胞的设门方案,利用CD4、CD45 和侧向散射光3个参数对细胞进行细胞亚群免疫表型分析, 避免了传统方法中根据淋巴细胞绝对计数和CD4+T淋巴细胞相对计数确定CD4+T淋巴细胞数量时淋巴细胞这一关键因素不易质控的棘手问题,同时提高了长距离运输及长时间放置样本检测结果的可靠性。因此,CD4/CD45法对HIV感染人群, 尤其是农村和边远地区HIV感染人群,在疾病病程监控、治疗以及疗效评价等方面具有较高的应用价值。

表1 CD4/CD45单平台CD4+ T淋巴细胞计数不同系统Table 1 Different brands for flow cytometry using single-platform protocol for CD4+T lymphocyte enumeration
综上所述,CD4/CD45单平台法检测HIV感染者的CD4+T淋巴细胞计数方法简便、经济、适用性强[23],有助于了解机体的免疫状态以确定疾病分期、检测疾病进程、评估疾病预后以及评估抗病毒治疗疗程等,能够作为我国临床检测技术进行推广。
【参考文献】
[1] 黄磊,许文,卢祥婵,等. HIV感染者外周浅表淋巴结中CD4+T淋巴细胞计数与胶原沉积的关系研究[J]. 传染病信息,2014,27(6):337-341.
[2] Abdool Karim SS. Overcoming impediments to global implementation of early antiretroviral therapy[J]. N Engl J Med,2015, 373(9):875-876.
[3] Phillips AN, Lee CA, Elford J, et al. Serial CD4 lymphocyte counts and development of AIDS[J]. Lancet, 1991, 337(8738):389-392.
[4] O’Gorman MR, Gelman R. Inter- and intrainstitutional evaluation of automated volumetric capillary cytometry for the quantitation of CD4- and CD8-positive T lymphocytes in the peripheral blood of persons infected with human immunodeficiency virus. Site Investigators and the NIAID New CD4 Technologies Focus Group [J]. Clin Diagn Lab Immunol, 1997, 4(2):173-179.
[5] No authors listed. 1997 revised guidelines for performing CD4+T-cell determinations in persons infected with human immunodeficiency virus (HIV)[J]. MMWR Recomm Rep, 1997,46(RR-2):1-29.
[6] Glencross D, Scott LE, Jani IV, et al. CD45-assisted PanLeucogating for accurate, cost-effective dual-platform CD4+ T-cell enumeration[J]. Cytometry, 2002, 50(2):69-77.
[7] Mandy FF, Nicholson JK, McDougal JS, et al. Guidelines for performing single-platform absolute CD4+T-cell determinations with CD45 gating for persons infected with human immunodeficiency virus. Centers for Disease Control and Prevention[J]. MMWR Recomm Rep, 2003, 52(RR-2):1-13.
[8] Mbopi-Kéou FX, Mion S, Sagnia B, et al. Validation of a singleplatform, volumetric, CD45-assisted PanLeucogating Auto40 flow cytometer to determine the absolute number and percentages of CD4 T cells in resource-constrained settings using Cameroonian patients’ samples[J]. Clin Vaccine Immunol, 2012, 19(4):609-615.
[9] World Health Organization. Laboratory guidelines for enumerating CD4 T lymphocytes in the context of HIV/AIDS[EB/OL]. [2015-09-18]. http://www.who.int/hiv/amds/LaboratoryGuideE numeratingCD4TLymphocytes.pdf.
[10] Pattanapanyasat K, Shain H, Prasertsilpa V, et al. Low cost CD4 enumeration using generic monoclonal antibody reagents and a two-color user-defined MultiSET protocol[J]. Cytometry B Clin Cytom, 2006, 70(5):355-360.
[11] Sippy-Chatrani N, Marshall S, Branch S, et al. Performance of the Panleucogating protocol for CD4+T cell enumeration in an HIV dedicated laboratory facility in Barbados[J]. Cytometry B Clin Cytom, 2008, 74(Suppl 1):S65-S68.
[12] Denny TN, Gelman R, Bergeron M, et al. A North American multilaboratory study of CD4 counts using flow cytometric panLeukogating (PLG): a NIAID-DAIDS Immunology Quality Assessment Program Study[J]. Cytometry B Clin Cytom, 2008,74(Suppl 1):S52-S64.
[13] 洪坤学,陈 刚,彭 虹,等. 两种平台法测定HIV感染者CD4计数的比较[J]. 现代预防医学, 2007,34(5):801-803.
[14] Barnett D, Granger V, Whitby L, et al. Absolute CD4+T-lymphocyte and CD34+stem cell counts by single-platform flow cytometry: the way forward[J]. Br J Haematol,1999, 106(4):1059-1062.
[15] Glencross D, Scott LE, Jani IV, et al. CD45-assiste PanLeucogating for accurate, cost-effective dual-platform CD4+T-cell enumeration [J]. Cytometry, 2002, 50(2):69-77.
[16] Janossy G, Jani I, Göhde W. Affordable CD4+T-cell counts on ’singleplatform’ flow cytometers I. Primary CD4 gating[J]. Br J Haematol, 2000, 111(4):1198-1208.
[17] Karcher H, Böhning D, Downing R, et al. Comparison of two alternative methods for CD4+T-cell determination (Coultermanual CD4 count and CyFlow) against standard dual platform flow cytometry in Uganda[J]. Cytometry B Clin Cytom, 2006,70(3):163-169.
[18] Fryland M, Chaillet P, Zachariah R, et al. The Partec CyFlow Counter could provide an option for CD4+T-cell monitoring in the context of scaling-up antiretroviral treatment at the district level in Malawi[J]. Trans R Soc Trop Med Hyg, 2006, 100(10):980-985.
[19] Alvarez-Uria G, Reddy R, Reddy S, et al. Evaluation of a lowcost strategy for enumerating CD4 lymphocyte absolute count and percentage using the FACSCalibur flow cytometer in HIV-infected patients from a resource-limited setting[J]. ISRN AIDS, 2012,2012:494698.
[20] Zeigler BM, Boyle-Holmes Y, Falzone D, et al. Validation of an eight parameter immunophenotyping panel in adult canines for assessment of immunotoxicity[J]. Vet Immunol Immunopathol,2013, 154(1-2):75-81.
[21] 罗玲,李太生. AIDS抗病毒治疗的历史、现状与未来[J].传染病信息,2009,22(6):321-324,329.
[22] Hou LJ, Wang HW, Duan SP, et al. The prevalence and determinants of drug-resistance-associated mutations in the HIV-1-infected MSM population of Henan Province in China[J]. Arch Virol, 2015, 160(8):2051-2061.
[23] 苏雪丽,蒋岩. HIV实验室检测技术进展[J]. 传染病信息,2010,23(6):321-324,332.
(2015-10-14 收稿 2015-11-08 修回)
(责任编委 李 军 本文编辑 卢福昱)
[文献标志码][中国图书资料分类号] R392.12;R512.91 A
[文章编号]1007-8134(2016)03-0176-05
*Corresponding author, E-mail: xiaoyao@chinaaids.cn
[作者单位]730000 兰州,甘肃省疾病预防控制中心(许亚宁);102206 北京,中国疾病预防控制中心性病艾滋病预防控制中心(张辉、肖瑶)
[通讯作者]肖瑶, E-mail∶ xiaoyao@chinaaids.cn
Research advances in CD4+T lymphocyte enumeration using two-color CD4/CD45 single-platform protocol in HIV-infected patients
XU Ya-ning, ZHANG Hui, XIAO Yao*
Gansu Center for Disease Control and Prevention, Lanzhou, Gansu 730000, China
[Abstract]CD4+T lymphocyte count is regarded as a major marker for evaluating disease progression and antiretroviral therapy efficacy in HIV-infected individuals. In this review, the authors introduce the development of CD4+T lymphocyte enumeration using flow cytometry, and compare CD4/CD45 two-color single-platform protocol with other protocols in terms of accuracy, reliability and economics. CD4/CD45 two-color single-platform protocol is considered to be convenience, cheap and practical. In addition, the authors introduce specific characteristics and performance of various kinds of flow cytometers using CD4/CD45 two-color single-platform protocol for CD4+T lymphocyte enumeration.
[Key words]HIV; CD4 lymphocyte count; antigens, CD45; flow cytometry

