植被类型与坡位对喀斯特土壤氮转化速率的影响
刘 欣,黄运湘,袁 红,潘复静,何寻阳,张 伟,王克林,*
1 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室, 长沙 410125 2 中国科学院环江喀斯特生态系统观测研究站, 环江 547100 3 中国科学院大学, 北京 100049 4 湖南农业大学资源环境学院, 长沙 410125 5 广西师范大学生命科学学院, 桂林 541004
植被类型与坡位对喀斯特土壤氮转化速率的影响
刘欣1,2,3,黄运湘4,袁红4,潘复静1,2,3,何寻阳1,2,5,张伟1,2,王克林1,2,*
1 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室, 长沙410125 2 中国科学院环江喀斯特生态系统观测研究站, 环江547100 3 中国科学院大学, 北京100049 4 湖南农业大学资源环境学院, 长沙410125 5 广西师范大学生命科学学院, 桂林541004
摘要:土壤氮素转化对于植物氮素营养具有重要作用,尤其是对于受氮素限制的喀斯特退化生态系统。选取植被恢复过程中4种典型喀斯特植被类型(草丛、灌丛、次生林、原生林)和3个坡位(上、中、下坡位)表层土壤(0—15cm)为对象,利用室内培养的方法,研究不同植被类型和坡位下土壤氮素养分与氮转化速率(氮净矿化率、净硝化率和净氨化率)的特征及其影响因素。结果表明,植被类型对土壤硝态氮含量、无机氮含量、氮净矿化率、净硝化率和净氨化率均有显著影响(P<0.01),即随着植被的正向演替(草丛—灌丛—次生林—原生林),土壤硝态氮含量、无机氮含量、土壤氮净矿化速率和净硝化速率整体上呈增加趋势,而坡位以及坡位与植被类型的交互作用对上述土壤氮素指标无显著影响(P>0.05)。冗余分析结果表明凋落物氮含量、凋落物C∶N比和硝态氮含量对土壤氮转化速率有显著影响,其中凋落物氮含量是影响土壤氮转化速率的主要因子(F=35.634,P=0.002)。可见,尽管坡位影响喀斯特水土再分配过程,但植被类型决定的凋落物质量(如凋落物氮含量等)对喀斯特土壤氮素转化速率的作用更为重要。因此,在喀斯特退化生态系统植被恢复初期,应注重植被群落的优化配置(如引入豆科植物)和土壤质量的改善(如降低土壤C∶N),促进土壤氮素转化及氮素的有效供给。
关键词:氮素转化;氮净矿化率;净硝化率;喀斯特;植被恢复

土壤氮素矿化和硝化过程受许多因素控制,土壤理化性质、凋落物的输入和土壤微生物等生物因素[7- 9]都对土壤矿化作用具有重要影响。如有研究发现喜马拉雅地区两种常绿树种土壤氮矿化速率受土壤含水量的影响,并与土壤容重和土壤C∶N负相关[10]。由于土壤理化性质以及生物因素伴随植被组成的变化而改变,且地形因子(如坡位)对土壤理化性质的空间异质性具有显著影响[11- 13],因而氮矿化速率是生态系统各组分交互作用的结果[14]。生物结构、立地动态和位点因素会影响土壤氮素循环过程[15],这可能是地上部分输入到土壤中的养分的差异影响了土壤微生物对氮素矿化的作用[16- 17],故而植被类型和坡位的差异会使不同生态系统土壤氮矿化有其各自的特点。而国内土壤氮矿化研究主要集中在农业生态系统以及不同土地利用类型上[1- 3],对植被类型和地形(如坡位)对土壤氮循环的交互影响方面研究相对较少,尤其在喀斯特地区缺乏相关研究报道。
基于以往的研究进展,本研究假设喀斯特地区土壤氮素形态及其转化速率主要受地形和植被类型两个驱动因素控制。其中,地形通过二元结构的坡位分异导致水土再分配过程的空间变化,进而影响土壤氮循环;而植被演替通过群落组成的改变导致凋落物归还质量的变化,进而影响土壤微生物的代谢活性,控制着土壤氮循环。基于以上假设,本研究以喀斯特峰丛洼地植被恢复过程中4种典型植被类型( 草丛、灌丛、次生林、原生林)、3 种坡位(上、中和下坡位) 的表层土壤为研究对象,分析不同植被类型和坡位条件下土壤无机态氮含量的差异,及其对土壤氮素矿化和硝化过程的影响,探讨土壤氮素矿化过程对植被恢复和立地条件的响应规律,以期揭示土壤氮净矿化和净硝化速率的主要控制因子,为区域环境可持续发展和生态恢复措施的制订提供理论依据。
1研究区概况和研究方法
1.1研究区概况
研究区域位于广西区环江县古周移民迁出示范区(107°55′ E,24°50′ N)和木论国家级自然保护区( 107°53′—108°05′ E,25°06′—25°12′ N),均属典型喀斯特峰丛洼地,亚热带季风气候区。古周移民迁出示范区多年平均气温16.5—20.5 ℃,多年平均降雨量为1380 mm,主要集中在4—9月份,最低海拔376 m,最高海拔816 m;研究区的土壤主要为石灰岩风化形成的石灰土,虽已实行退耕还林,但仍有村民居住,由于受历史人为活动干扰和封育年限不同,目前区内草、灌、乔不同演替阶段植被群落均有分布,截止采样时(2009年)森林覆盖率仅为13%[17]。木论国家级喀斯特自然保护区位于环江毛南族自治县西北,多年年均气温15.0—18.7 ℃,多年平均降雨量1530—1820 mm,林内相对湿度一般在80%—90%,夏季可接近饱和;封育时间300 a左右,保护区森林面积9991 hm2,森林覆盖率93.4%,生长着中亚热带隐域性的喀斯特森林顶极植被群落,海拔最低405 m,最高823 m;研究区土壤类型与古周移民示范区一致,主要是由白云岩和石灰岩风化形成的石灰土[17- 18],土层相对较厚,一般在30 cm 以上,层次明显。样地的基本信息与优势种如表1。
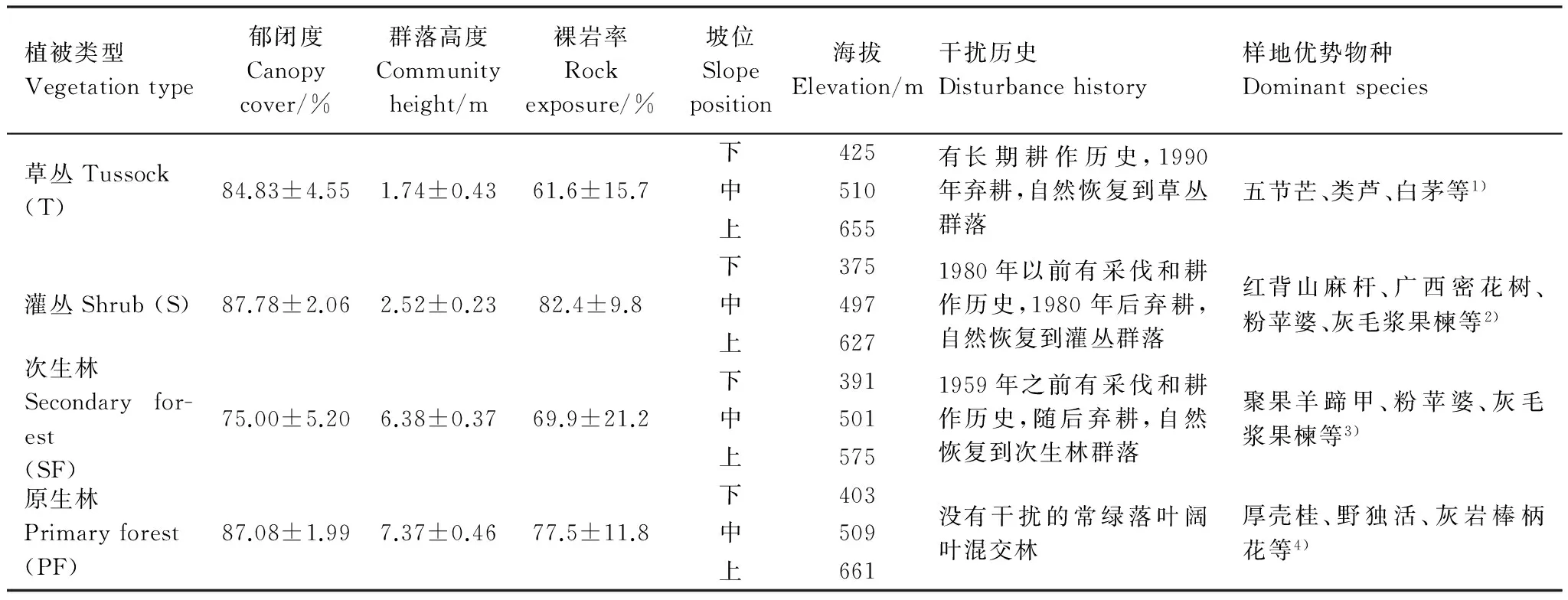
表1 样地基本信息及植物优势物种
1)Miscanthusfloridulus,Neyraudiareynaudiana,Imperatacylindrica, etc; 2)Alchorneatrewioides,Rapaneakwangsiensis,Sterculiaeuosma,Cipadessacinerascens,etc; 3)Bauhiniabrachycarpavar.cavaleriei,Sterculiaeuosma,CipadessacinerascensCryptocaryachingiiCheng, etc; 4)Cryptocaryachinensis,Miliusachunii,Cleidionbracteosum, etc
1.2土壤和凋落物样品采集与处理
在研究区选取典型的峰丛洼地单元,采用空间代替时间研究方法于2008年12月至2009年1月选取不同植被恢复阶段草丛(T)、灌木林(S)、次生林(SF)、原生林(PF)为研究对象。每种植被类型从山顶到山脚各选取3条样带(1条主样带和2条辅助样带),分别在上、中、下坡各设置3个典型样方(20 m×30 m),以保证样方的代表性,研究区4种植被类型共计36个样方。采样时用GPS记录每个样方(或样方中心)的经纬度、高程等地理信息,同时调查记录各样方的坡度、坡向、利用历史、裸岩率等环境信息。考虑到喀斯特土壤的高度异质性,为得到具有代表性的土壤样品,每个样方分成4个小区,在每个小区内沿“S”形采集5—8点表层0—15 cm 的土壤样品,将4个小区的土壤样品充分混匀成一个混合样(代表整个样方),共计36个土壤样品;同时在每个小区内按“S”形取8个地表凋落物样品,混和后代表该小区凋落物样品,共获凋落物样本144个。


表2 不同植被类型和坡位下的土壤基本理化性质及凋落物
U代表上坡位;M代表中坡位;D代表下坡位;大写字母(X1)代表同一坡位不同植被类型间差异显著;小写字母(x2)代表相同植被类型不同坡位间差异显著(P<0.05)
1.3室内培养法
称取过2 mm筛孔风干土壤样品10.00 g,置于250 mL塑料瓶中,调节土壤含水量至20%(质量含水量),用聚乙烯膜包扎瓶口,并在膜上扎2个小孔,置于25 ℃培养箱中培养2周,期间通过称重确定土壤水分变化情况,如有损失,则加以补充。培养结束后,加1 mol/L KCl 溶液100 mL,于温度为25 ℃的恒温振荡机内振荡1 h,过滤,滤液用AA3连续流动分析仪(Fiastar 5000)测定硝态氮和铵态氮含量。土壤氮素转化速率分别计算如下:



1.4数据处理和分析
用SPSS 21.0、Canoco 4.5和Excel 2013进行统计分析和制图。以演替阶段( 草丛、灌丛、次生林和原生林) 和坡位( 上、中、下坡位)作为处理因子分别对土壤氮矿化和硝化特性进行双因素方差分析,处理间的多重比较采用Duncan法(P< 0.05)。土壤理化性质和凋落物与无机氮以及氮素矿化、硝化速率的关系采用Pearson相关分析。利用冗余分析(RDA)探讨凋落物对土壤理化性质以及土壤理化性质对氮素转化率的影响。
2结果
2.1喀斯特不同植被类型和坡位下土壤氮素含量的分异
4种植被类型3个坡位土壤无机氮形态均以硝态氮为主,平均含量为135.55 mg/kg,变化范围为4.19—178.63 mg/kg,变异系数33.90%。铵态氮含量远低于硝态氮含量,平均7.29 mg/kg,变化范围为0.36—17.54 mg/kg,变异系数50.30%。
多重比较表明(表3),相同坡位不同植被类型下,土壤硝态氮、铵态氮和无机氮含量在上坡位分别表现为次生林/灌丛>原生林/灌丛>草丛、原生林/次生林>灌丛>草丛、次生林>原生林/灌丛>草丛;中坡位土壤硝态氮和无机氮均表现为原生林/次生林/灌丛>草丛,而铵态氮含量在中坡位差异不显著,下坡位土壤硝态氮、铵态氮和无机矿化氮分别表现为原生林/灌丛>次生林>草丛、原生林>灌丛/次生林/草丛、原生林/灌丛>次生林/灌丛>草丛。
由中国建筑材料检验认证中心、国家水泥质量监督检验中心编著的《水泥实验室工作手册》,已由中国建材工业出版社出版。该《手册》增补了近年来制定和修订的有关水泥产品和检验方法的新标准,同时增列了国家有关标准法和计量法的内容,对不符合国家计量法的一些表示方法进行了纠正。
相同植被类型不同坡位下,仅草丛氮素含量在坡位间差异显著,土壤硝态氮、无机氮含量均为下坡>上坡>中坡、铵态氮含量为中坡>下坡/上坡;而灌丛、次生林和原生林土壤硝态氮、铵态氮和无机氮含量差异均不显著。
双因素(植被类型和坡位)方差分析结果显示(表4):植被类型对土壤硝态氮和无机氮含量都有极显著影响(P<0.01),对铵态氮含量没有显著影响(P>0.05),而坡位以及植被类型与坡位的交互作用对上述氮素形态均没有显著影响(P>0.05)。

表3 不同植被类型和坡位间土壤硝态氮、铵态氮和无机氮含量的比较
U代表上坡位;M代表中坡位;D代表下坡位;大写字母(X1)代表同一坡位不同植被类型间差异显著;小写字母(x2)代表相同植被类型不同坡位间差异显著(P<0.05)
2.2喀斯特不同植被类型和坡位下土壤氮素转化速率的分异2.2.1植被类型对土壤氮净矿化率、净硝化率和净氨化率的影响
随植被正向演替(草丛-灌丛-次生林-原生林),土壤氮循环中的土壤氮净矿化率和净硝化率逐渐增加,以原生林土壤氮净矿化率最高,平均84.11 mg N kg-114d-1,草地土壤最低,平均13.04 mg N kg-114d-1,灌丛、次生林土壤平均分别为28.68 mg N kg-114d-1和53.66 mg N kg-114d-1。净硝化率以原生林土壤最高,平均61.06 mg N kg-114d-1,草地土壤最低,平均-2.23 mg N kg-114d-1。净氨化率以原生林土壤最高,平均23.1 mg N kg-114d-1,灌丛土壤最低,平均10.5 mg N kg-114d-1。
植被类型对土壤氮净矿化率、净硝化率和净氨化率都有极显著影响(P<0.01)(图1,表4)。相同坡位(上、中、下)不同植被类型下,土壤净硝化率分别为次生林 /原生林>灌丛/草丛、原生林/次生林/灌丛>草丛和原生林>次生林/灌丛>草丛,土壤净氨化率分别为次生林 /灌丛>原生林 /草丛、灌丛/草丛>次生林 /原生林、原生林/草丛>草丛/灌丛/次生林,土壤氮净矿化率分别为原生林/次生林>灌丛/草丛、原生林/次生林/灌丛>草丛和原生林>次生林/灌丛>灌丛/草丛(图1)。
2.2.2坡位对土壤氮净矿化率、净硝化率和净氨化率的影响
双因素方差分析结果表明,坡位以及植被类型与坡位的交互作用对氮净矿化率、净硝化率和净氨化率影响均不显著(P>0.05)(表4),但相同植被类型下,不同坡位间氮转化速率存在一定差异(图1)。草丛土壤净硝化率在坡位间差异不显著,而净氨化率和氮净矿化率均为中坡最高;灌丛土壤净硝化率和氮净矿化率均为中坡>下坡/上坡,净氨化率为上坡/中坡>下坡;次生林土壤净硝化率和氮净矿化率均为下坡最低;原生林土壤氮净矿化率在坡位间差异不显著,净硝化率为下坡最低,净氨化率为中坡最低。土壤氮净矿化率,除原生林外,草丛、灌丛和次生林均在不同坡位间差异显著。

图1 不同植被类型和坡位下土壤净硝化率、净氨化率和氮净矿化率的比较Fig.1 The comparison of soil net nitrification rate, net ammonification rate, net nitrogen mineralization rate on different vegetation types and slope positions大写字母(X1)代表同一坡位不同植被类型间差异显著;小写字母(x2)代表相同植被类型不同坡位间差异显著(P<0.05)
2.3土壤氮转化速率与影响因子之间的关系

表4 不同因素对土壤各指标影响的方差分析结果
**表示差异显著水平P<0.01
3讨论
3.1 植被类型及坡位对土壤氮素形态的影响
本研究中植被类型对土壤硝态氮和无机氮含量都有极显著影响,对铵态氮含量没有显著影响(表4),且土壤硝态氮和无机氮含量在草丛最低,在其它3种植被类型间含量差异不显著(表3)。这是由于硝态氮带负电荷,易于从土壤尤其是阴离子交换能力差的土壤淋溶流失,草丛植被构成相较灌丛、次生林和原生林简单,在高温多雨的条件下更易造成硝态氮的流失;同时由于本研究区域草丛受历史人为活动(开垦、翻耕、砍伐等)影响最大,导致土壤结构破坏,通气条件恶化,致使该环境不利于硝化作用的进行,从而影响了土壤硝态氮的含量,说明喀斯特地区实行退耕模式的生态恢复工程有利于土壤氮素养分的积累。
不同坡位间灌丛、次生林和原生林的土壤氮素含量差异不显著(表3),这是由于影响土壤氮素含量的土壤和凋落物因子等在坡位间差异不显著(表2),即这3种植被类型下坡位对喀斯特土壤氮素形态没有显著影响,这与方差分析结果(表4)相一致。而草丛土壤氮素含量在坡位间差异显著(表3),土壤硝态氮和无机氮含量均表现为中坡最低,铵态氮含量为中坡最高。这可能是因为草丛中坡受历史人为活动影响较下坡小,且植被覆盖度较上坡高,铵态氮易被有机胶体吸附,故其含量较其它坡位高,同时经土壤硝化产生的硝态氮被植物和土壤微生物吸收利用后仅有少量剩余,故而硝态氮含量又低于其它坡位。
另外,硝态氮和铵态氮是植物可吸收利用的无机态氮,在微生物的作用下,铵态氮经硝化作用生成硝态氮[21],而文中土壤硝态氮是4种植被类型无机氮的主要存在形式,硝态氮含量远高于铵态氮含量,说明喀斯特地区的土壤环境有利于土壤硝化作用。
3.2植被类型及坡位对喀斯特土壤氮转化速率的影响
植被类型对喀斯特土壤氮净矿化率、净硝化率和净氨化率均有极显著影响(表4)。土壤氮净矿化率和净硝化率随植被演替依次递增,而净氨化速率以原生林土壤最高,灌丛土壤最低。其中原生林为喀斯特峰丛洼地的顶级群落,氮转化速率最高,而草丛土壤氮净矿化率和净硝化率最低,且其净硝化率出现负值(图1)。说明随着植被恢复,物种多样性增加、植被结构趋于稳定,土壤微生物可利用底物以及土壤微生物活性随之增加,进而影响氮转化速率[21]。而草丛净硝化率出现负值可能是因为草丛土壤结构被破坏,通气状况较差,抑制了好气性硝化细菌的活性,增强了反硝化细菌的活性,进而有利于反硝化作用的进行,因此,反硝化作用引起的氮素损失可能是导致草丛净硝化率出现负值的重要原因。
不同坡位间,仅原生林上、中、下坡位氮净矿化率差异不显著,而草丛、灌丛和次生林氮净矿化率均表现为中坡最高,下坡最低,且草丛和灌丛上、下坡位差异不显著(图1)。这可能是因为原生林是自然保护区,几乎未受历史人为活动的扰动,3种坡位间物种组成达到稳定平衡状态,使影响氮转化的环境因子如土壤C∶N、微生物生物量碳氮和凋落物碳氮磷含量等变化不显著(表2);而草丛、灌丛和次生林氮净矿化率中坡位显著高于下坡位,主要与历史人为活动干扰有关,由于人类的砍伐,下坡位植被结构被破坏,不利于土壤养分的积累,且研究表明该区域受人为干扰的样地存在养分随海拔升高而增加的“养分倒置”现象[18,22],即随着坡位的升高土壤SOC和TN含量增加,而SOC和TN与氮净矿化率呈显著正相关关系,故而受人为干扰较小的中坡位氮净矿化率要高于下坡位。
3.3土壤理化性质和凋落物对喀斯特土壤氮转化速率的影响
土壤的养分状况关系到植物的生长和土壤微生物的活动等,高氮素转化速率取决于土壤中高的生物活性,而高的生物学活性可归因于土壤中较高的有机碳和全氮含量[23],因此土壤C∶N也是影响土壤矿化和硝化作用的重要因子[3]。相关分析表明,土壤养分含量、微生物生物量碳以及凋落物质量均与土壤氮净矿化率和净硝化速率之间有极显著的相关性(P<0.01),净氨化率与土壤理化性质以及凋落物间均无显著相关关系。。其中草丛凋落物C∶N和土壤C∶N最高,原生林最低(表2),而土壤氮净矿化和净硝化率草丛最低,原生林最高(图1),有研究表明凋落物低碳氮比(C∶N<25)基质与高碳氮比(C∶N>25)基质相比,氮矿化速率更高[24-25],说明低的凋落物C∶N和土壤C∶N预示着高的土壤氮净矿化和净硝化率[3,10,26- 28]。
利用冗余分析(RDA)探讨凋落物碳氮含量与土壤理化性质对氮素转化率的影响(图2),结果表明第一排序轴的解释量为67.7%,第二排序轴的解释量为5.3%,凋落物氮含量、凋落物C∶N比和硝态氮含量对氮转化速率有显著影响,其中凋落物氮含量能够显著解释氮转化速率(F=35.634,P=0.002),说明凋落物氮含量为影响氮净矿化率的主要因子。由于凋落物是生态系统土壤氮素的重要输入,通过淋溶、分解等过程向矿质土壤层提供有机质和养分,决定了土壤有机氮库的大小,影响微生物对土壤有机质的分解[21],进而影响土壤氮素矿化和硝化作用,说明凋落物通过影响土壤中有机质的质量而对净氮矿化和净硝化有很强的控制作用[29]。
综上所述,喀斯特地区氮素转化速率以及氮素可利用性与凋落物氮含量强烈相关,其中氮素可利用性是对群落物种组成有重要影响的环境因子之一,而植物群落又能引起环境条件的变化,反过来影响一个或更多的生态过程,从而导致演替中一些物种替代另一些物种,故而凋落物质量与土壤氮素转化间的反馈关系可能是植被演替的重要机制[30]。而大量研究表明,固氮类植物(如豆科物种)具有很强的肥力岛效应[31-32],其枯枝落叶和根系周转降低凋落物的C∶N比,凋落物矿化后可以有效地增加土壤氮素养分,而增加土壤氮素是固氮类植物改变植被演替轨迹的最主要途径[33-34]。研究表明,在生态恢复区域,人工配置或引入固氮植物,改善地上植被群落组成,能够达到促进植被演替的目的[34-36]。因而在喀斯特退化山地生态恢复过程中,可以通过人工配置地上植被群落组成(如引入豆科植物),增加凋落物氮含量,促进土壤氮转化速率,提升土壤氮素养分,从而促进喀斯特退化生态系统的快速恢复。

图2 土壤理化性质和凋落物与土壤氮转化速率间的RDA排序图Fig.2 The RDA order graph of soil basic physicochemical properties and litter with soil nitrogen transformation rates 实线代表自变量,虚线代表因变量;Axis1(67.7%)表明第一轴的解释量为67.7%,Axis2(5.3%)表明第二轴的解释量为5.3%;SMBC:微生物生物量碳;SMBN:微生物生物量氮;SMBC∶SMBN:微生物C∶N;
4结论
(1)植被类型与坡位都显著影响土壤硝态氮含量、无机氮含量、氮净矿化速率和净硝化速率,但双因素方差分析结果表明植被类型对土壤氮转化的影响较坡位更为重要。
(2)西南喀斯特地区草丛、灌丛、次生林和原生林土壤无机氮的主要存在形式是硝态氮,且土壤氮素转化过程以硝化过程为主,提示喀斯特山区更应该防治生态退化,因为硝态氮更易流失,造成水体环境污染与影响人类健康。
(3)喀斯特土壤氮净矿化和净硝化速率受多种因素共同影响,但地上植被群落组成以及凋落物氮含量是影响土壤氮素转化过程的最重要的因子。随着植被恢复年限的增加,人类活动逐渐减少,有利于喀斯特土壤氮循环朝良性方向发展。因而在喀斯特退化山地生态恢复过程中,可以通过人工配置地上植被群落组成(如引入豆科植物),改善土壤氮素养分含量,促进土壤氮素转化与有效供给,构建有利于植被恢复过程的土壤环境,这可能是喀斯特退化生态系统快速恢复的有效策略。
致谢: 感谢中国科学院亚热带农业生态研究所赵杰副研究员对本文写作的帮助。
参考文献(References):
[1]余泺, 高明, 慈恩, 王子芳, 魏朝富, 徐畅. 不同耕作方式下土壤氮素矿化和硝化特征研究.生态环境学报, 2010, 19(3): 733- 738.
[2]陈书信, 王国兵, 阮宏华, 岳臻, 徐长柏, 徐亚明. 苏北沿海不同土地利用方式土壤氮矿化季节变化特征. 生态学杂志, 2014, 33(2): 276- 282.
[3]李铭, 朱利川, 张全发, 程晓莉. 不同土地利用类型对丹江口库区土壤氮矿化的影响.植物生态学报, 2012, 36 (6): 530- 538.
[4]马文瀚. 贵州喀斯特脆弱生态环境的可持续发展. 贵州师范大学学报: 自然科学版, 2003, 21(2): 75- 79.
[5]刘淑娟, 张伟, 王克林, 舒世燕, 何寻阳, 杨珊, 潘复静. 桂西北喀斯特峰丛洼地不同植被演替阶段的土壤脲酶活性. 生态学报, 2011, 31(19): 5789- 5796.
[6]Wang S J, Liu Q M, Zhang D F. Karst rocky desertification in southwestern China: Geomorphology, landuse, impact and rehabilitation. Land Degradation & Development, 2004, 15(2): 115- 121.
[7]Binkley D, Hart S C. The components of nitrogen availability assessments in forest soils. Advances in Soil Science, 1989, 10: 57- 112.
[8]Knoepp J D, Swank W T. Using soil temperature and moisture to predict forest soil nitrogen mineralization. Biology and Fertility of Soils, 2002, 36(3): 177- 182.
[9]Templer P H, Groffman P M, Flecker A S, Power A G. Land use change and soil nutrient transformations in the Los Haitises region of the Dominican Republic. Soil Biology and Biochemistry, 2005, 37(2): 215- 225.
[10]Usman S, Singh S P, Rawat Y S. Nitrification mineralisation and inorganic-N uptakein evergreen forests of the central Himalayas. European Journal of Soil Biology, 2000, 36(2): 65- 71.
[11]Harris R F, Chesters G, Allen O N. Dynamics of soil aggregation. Advances in Agronomy, 1996, 18: 107- 169.
[12]高雪松, 邓良基, 张世熔. 不同利用方式与坡位土壤物理性质及养分特征分析. 水土保持学报, 2005, 19(2): 53- 56, 60- 60, 79- 79.
[13]龙海飞, 苏维词. 喀斯特石漠化地区不同坡位土壤养分变化分析. 贵州科学, 2013, 31(3): 30- 35.
[14]Brais S, ParéD, Camiré C, Rochon P,Vasseur C. Nitrogen net mineralization and dynamics following whole-tree harvesting and winter windrowing on clayey sites of northwestern Quebec. Forest Ecology and Management, 2002, 157(1/3): 119- 130.
[15]Pérez C A, Hedin L O, Armesto J J. Nitrogen mineralization in two unpolluted old-growth forests of contrasting biodiversity and dynamics. Ecosystems, 1998, 1(4): 361- 373.
[16]梁月明, 苏以荣, 张伟, 陈香碧, 刘淑娟, 黎蕾, 冯书珍, 何寻阳. 桂西北不同植被恢复阶段土壤氨氧化细菌遗传多样性研究. 土壤学报, 2013, 50(2): 364- 371.
[17]冯书珍, 苏以荣, 秦新民, 肖伟, 葛云辉, 何寻阳. 喀斯特峰丛洼地土壤剖面微生物特性对植被和坡位的响应. 生态学报, 2013, 33(10): 3148- 3157.
[18]刘淑娟, 张伟, 王克林, 陈洪松, 舒世燕, 谭卫宁. 桂西北喀斯特峰丛洼地表层土壤养分时空分异特征. 生态学报, 2011, 31(11): 3036- 3043.
[19]Wu J, Joergensen R G, Pommerening B, Chaussod R, Brookes P C.Measurement of soil microbial biomass C by fumigationextraction an automated procedure. Soil Biology and Biochemistry, 1990, 22(8): 1167- 1169.
[20]刘光崧, 蒋能慧, 张连第, 刘兆礼. 土壤理化分析与剖面描述. 北京: 中国标准出版社, 1996.
[21]李贵才, 韩兴国, 黄建辉, 唐建维. 森林生态系统土壤氮矿化影响因素研究进展. 生态学报, 2001, 21(7): 1187- 1195.
[22]张伟, 陈洪松, 王克林, 张继光, 侯娅. 典型喀斯特峰丛洼地坡面土壤养分空间变异性研究. 农业工程学报, 2008, 24(1): 68- 73.
[23]Sánchez L F, García-Miragaya J, Chacón N. Nitrogen mineralization in soils under grasses and under trees in a protected Venezuelan savanna. Acta Oecologica, 1997, 18(1): 27- 37.
[24]Aber J D, Magill A, Boone R, Melillo J M, Steudler P. Plant and soil responses to chronic nitrogen additions at the Harvard Forest, Massachusetts. Ecological Applications, 1993, 3(1): 156- 166.
[25]Arunachalam A, Maithani K, Pandey H N, Tripathi R S. Leaf litter decomposition and nutrient mineralization patterns in regrowing stands of a humid subtropical forest after tree cutting. Forest Ecology and Management, 1998, 109(1/3): 151- 161.
[26]Adams M A, Attiwill P M. Nutrient cycling and nitrogen mineralization in eucalypt forests of southeastern Australia II. Indices of nitrogen mineralization. Plant and Soil, 1986, 92(3): 341- 362.
[27]Knoepp J D, Swank W T. Rates of nitrogen mineralization across an elevation and vegetation gradient in the southern Appalachians. Plant and Soil, 1998, 204(2): 235- 241.
[28]Reich P B, Grigal D F, Aber J D, Gower S T. Nitrogen mineralization and productivity in 50 hardwood and conifer stands on diverse soils. Ecology, 1997, 78(2): 335- 347.
[29]Scott N A, Binkley D. Foliage litter quality and annual net N mineralization: comparison across North American forest sites. Oecologia, 1997, 111(2): 151- 159.
[30]Ferrari J B. Fine-scale patterns of leaf litterfall and nitrogen cycling in an old-growth forest. Canadian Journal of Forest Research, 1999, 29(3): 291- 302.
[31]Dakora F D, Keya S O. Contribution of legume nitrogen fixation to sustainable agriculture in Sub-Saharan Africa. Soil Biology and Biochemisty,1997(5/6), 29: 809-817.
[32]Rhoades C C, Eckert G E, Colem an D C. Effect of pasture trees on soil nitrogen and organic matter: Implications for tropical Montane forest restoration. Restoration Ecology, 1998, 6(3): 262-270.
[33]Maron J L, Jefferies R L. Bushlupine mortality, altered resource availability, and alternative vegetation states. Ecology, 1999, 80(20): 443-454.
[34]Adema E B, Vande Koppel J, Meijer H A J, Grootjans A P. Enhanced nitrogen loss may explain alternative stable states in dune slack succession. Oikos, 2005, 109(2): 374-386.
[35]Clarkson B R, Walker L R, Clarkson B D, Silvester W B. Effect ofCoriariaarboreaon seed banks during primary succession on Mt.Tarawera, New Zealand.. New Zealand Journal of Botany, 2002, 40(4): 629-638.
[36]Walker L R, Clarkson B D, Silvester W B, Clarkson B R. Colonization dynamics and facilitative impacts of a nitrogen-fixing shrub in primary succession. Journal of Vegetation Science, 2003, 14(2): 277-290.
Effects of vegetation type and slope position on soil nitrogen transformation rate in Karst regions
LIU Xin1,2,3, HUANG Yunxiang4, YUAN Hong4, PAN Fujing1,2,3, HE Xunyang1,2,5, ZHANG Wei1,2, WANG Kelin1,2,*
1KeyLaboratoryofSubtropicalAgricultureEcology,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,Changsha410125,China2HuanjiangObservationandResearchStationforKarstEcosystems,ChineseAcademyofSciences,Huanjiang547100,China3GraduateSchoolofChineseAcademyofSciences,Beijing100049,China4CollegeofResources&Environment,AgriculturalUniversityOfHunan,Changsha410125,China5CollegeofLifeScience,GuangxiNormalUniversity,Guilin541004,China
Abstract:Soil net nitrogen mineralization and nitrification are critical processes that provide nitrogen nutrients for plant growth in degraded Karst ecosystems with limited nitrogen. However, little is known about these processes. In this study, soil samples derived from topsoil (0—15 cm) were collected from the upper, middle, and lower slope positions of four Karst ecosystems—tussock (T),shrub (S),secondary forest (SF) and primary forest (PF), which are a typical vegetation succession series in Karst areas. A soil incubation experiment was conducted to measure the soil nitrogen transformation rates, including net nitrogen mineralization rate, net nitrification rate, and net ammonification rate. The results showed that vegetation types significantly (P<0.01) affected soil -N and inorganic nitrogen content, soil net nitrogen mineralization rate, net nitrification rate, and net ammonification rate. In particular, the content of soil -N and inorganic N, soil net nitrogen mineralization rate, and net nitrification rate gradually increased along the vegetation succession. The slope position and the interaction between vegetation type and slope position had no significant effect on the monitored variables (P>0.05). RDA analysis showed that the soil nitrogen transformation rate was primarily affected by the litter nitrogen content, litter C∶N, and the content of soil -N. However, the litter nitrogen was the main factor affecting the soil nitrogen transformation rate (F=35.634, P=0.002).Our results suggest that vegetation restoration has positive effects on Karst soil nitrogen transformation. The improvement of litter quality (e.g., litter nitrogen content) may be the key factor influencing the soil nitrogen transformation rates over Karst vegetation succession. Therefore, managing litter C: N (e.g., to introduce legumes) may be conducive to the restoration of degraded Karst ecosystems. These findings may serve as a scientific basis for further understanding of soil nitrogen cycling in Karst regions and help facilitate preservation and restoration activities in Karst regions.
Key Words:nitrogen transformation; net nitrogen mineralization rate; net nitrification rate; Karst; vegetation restoration
基金项目:国家自然科学基金项目(41471445,31270551和31270555)
收稿日期:2015- 06- 04;
修订日期:2015- 12- 28
*通讯作者
Corresponding author.E-mail: kelin@isa.ac.cn
DOI:10.5846/stxb201506041124
刘欣,黄运湘,袁红,潘复静,何寻阳,张伟,王克林.植被类型与坡位对喀斯特土壤氮转化速率的影响.生态学报,2016,36(9):2578- 2587.
Liu X, Huang Y X, Yuan H, Pan F J, He X Y, Zhang W, Wang K L.Effects of vegetation type and slope position on soil nitrogen transformation rate in Karst regions.Acta Ecologica Sinica,2016,36(9):2578- 2587.
————水溶蚀岩石的奇观

