青藏高原不同生境下湿生扁蕾(Gentianopsispaludosa)个体大小依赖的繁殖分配
侯勤正,叶广继,马小兵,苏 雪,张世虎,孙 坤,*
1 西北师范大学, 兰州 730070 2 青海省农林科学院, 西宁 810016
青藏高原不同生境下湿生扁蕾(Gentianopsispaludosa)个体大小依赖的繁殖分配
侯勤正1,叶广继2,马小兵1,苏雪1,张世虎1,孙坤1,*
1 西北师范大学, 兰州730070 2 青海省农林科学院, 西宁810016
摘要:植物对资源的投资和分配是生态学中的重要问题,它反映了植物应对环境变化时的生活史策略。选择青藏高原东缘同一海拔下的嵩草草甸(Kobresia sp. meadow)、金露梅灌丛(Potentilla fruticosa shrub meadow)以及草甸-灌丛交错带3种生境类型,并以3种生境下的湿生扁蕾(Gentianopsis paludosa)为对象,研究了其繁殖分配特征。结果发现:(1)在种群水平上,在生境从草甸经交错带到灌丛的变化中,湿生扁蕾个体大小和繁殖分配比例逐渐增加;3个种群湿生扁蕾的总花数目没有显著差异,但草甸生境湿生扁蕾的蕾期花数目显著高于灌丛生境,而果期花数目则显著低于灌丛生境;(2)在个体水平上,湿生扁蕾的繁殖绝对投入与个体大小显著正相关,且各种群植株都存在繁殖所需的个体大小阈值, 而繁殖阈值在生境从草甸经交错带到灌丛的过渡中逐渐减小;湿生扁蕾的繁殖相对投入与个体大小负相关,但相关系数随着生境从草甸经交错带到灌丛的过渡中逐渐减小;各种群花数目与湿生扁蕾植株个体大小显著正相关。研究表明,湿生扁蕾的繁殖投资存在大小依赖效应,但生境差异会对其繁殖投资和生活史策略造成显著影响,而这种影响主要是由不同生境下自然条件的不同造成的。同时,资源分配也与湿生扁蕾的遗传特性和延迟自交的繁育系统特征有关。湿生扁蕾这种不同生境下个体大小依赖的繁殖投资差异是湿生扁蕾与其生境长期适应和进化(生境选择)的结果。
关键词:湿生扁蕾;繁殖分配;生境变化;个体大小依赖;青藏高原
Size-dependent reproductive allocation ofGentianopsispaludosain different
植物表型的可塑性对植物生活史策略的建立具有重要作用,而植物各器官对于资源的获取和利用是决定其表型的最直接的因素[1]。在植物的整个生活史中,生长、繁殖以及防御等各功能对资源都存在竞争关系,而根据权衡理论,植物需要将有限的资源在各功能之间做到合理的分配以达到其最优适合度[2- 4],因此植物资源的合理分配问题或者权衡问题在某种程度上可以较好的反映植物生活史策略,进而引起了生态学界的高度重视[5]。
繁殖分配指用于繁殖的资源量占总资源或营养资源投入量的比例,它是决定植株繁殖输出和繁殖成功的关键因素。近30年来,对植物繁殖分配以及资源最优权衡已做了大量的理论和实验方面研究,多数研究结果表明植物的繁殖分配与植株个体大小存在依赖效应,即随着植株个体增大,繁殖绝对投入会相应增加,但繁殖分配比例(相对投入)减小[6- 8],但是也有学者认为繁殖分配与个体大小并不存在依赖效应[9]。另外,研究表明,植物繁殖阈值(即植物开花所需的最小植株个体大小)[10- 11]和植物开花数目[12- 14]也与植物个体大小存在依赖效应。不可否认,植株的个体大小和繁殖分配都会受到植物遗传特性和交配系统等内因影响[15],但植物营固着生活模式,因此环境因子变化对于其表型的可塑性以及生活史策略的影响显得尤为重要[16- 17]。以往研究主要集中在海拔梯度的变化对于个体大小和繁殖分配的影响上,这是因为环境因子随海拔梯度发生的剧烈变化为研究植物生长和繁殖的生态适应性提供了理想的条件[18]。然而,此类研究容易忽略植物所处生境的群落类型的差异,而这种差异显然对植物的繁殖分配和生活史策略会产生重要影响[17, 19],因此选择海拔相似但生境不同(不同群落类型)的种群作为研究对象才能更为准确的了解不同环境条件下植物的繁殖分配策略[20]。
青藏高原独特的地理条件和复杂的地形构造以及多变的气候特征为研究高山植物的生活史策略提供了理想条件。青藏高原植被结构组成较为简单,其中嵩草草甸和金露梅灌丛是高寒草甸两种主要的植被类型,而这两种植被类型提供的生境差异为研究不同环境条件下植物的繁殖分配策略提供了更为便利的条件[21]。湿生扁蕾(Gentianopsispaludosa)为龙胆科扁蕾属一年生草本植物,生于海拔1180—4900m的河滩,山坡草地和林下,分布范围较广,这为研究其对环境的繁殖适应策略提供了条件。目前的研究发现,湿生扁蕾的繁育系统特点为延迟自交(delayed selfing),但并未发现有效传粉者[22]。本研究在青藏高原东缘高寒草甸选择嵩草草甸(CD)(Kobresiasp. meadow)、金露梅灌丛(GC)(Potentillafruticosashrub meadow)以及草甸-灌丛交错带(JC)(junction area)3种生境下的湿生扁蕾进行比较研究,重点解决以下问题:1)湿生扁蕾的个体大小和繁殖分配(绝对投入和相对投入)是否会随生境变化(金露梅盖度变化)而变化?2)湿生扁蕾的繁殖分配(绝对投入和相对投入)是否与其植株个体大小存在依赖关系?如果存在依赖关系,那么3)这种关系在3个种群之间(种群水平)以及不同种群的个体之间(种群水平)是否存在差异?
1材料与方法
1.1研究区域概况
本试验在中国科学院海北高寒草甸生态系统定位观测站(以下简称海北站)(北纬37°29′—37°45′,东经101°12′—101°23′,海拔3200 m)的永久样地完成。海北站站区属于典型的高原大陆性气候,年均气温-1.7 ℃(最高27.6 ℃;最低-37.1 ℃),平均降水为426—860 mm,其中80%的降水量发生在5—9 月。海北站附近的植被类型为青藏高原典型的地带性植被:以金露梅(P.fruticosa)为建群种的高寒灌丛草甸和以嵩草属(Kobresiasp.)为建群种的高寒嵩草草甸,群落结构简单,组成种类较少[21]。
1.2研究材料
湿生扁蕾分布于海拔1180—4900 m 的范围内。在海北站地区7月中旬进入花期,盛花期在7月底8月初;茎单生,直立或斜升,近圆形,在基部分枝或不分枝;花单生茎或分枝顶端;花梗直立,花冠筒状漏斗形,具4个花冠檐;雄蕊4个,着生于花冠基部,雌蕊1 个。湿生扁蕾在海北站地区8月下旬种子成熟。
1.3实验方法
湿生扁蕾植株样本收集于2013年8月1—3日在海北站进行。根据金露梅覆盖率的差异,本试验选择嵩草草甸(CD)、交错带(JC)和金露梅灌丛(GC)3种典型生境作为实验区(表1),在每个实验区随机选取25—30个1 m×1 m样方(3生境选取样方数分别为25、25、30),每一样方各随机选取3—5株完整个体(3生境选取植株个体数分别为95、104、108),统计各植株蕾期花数目、开花期花数目以及结果期花数目,并计算总花数目。测量地上部分高度后挖取整株并,根部用清水洗净后晾干,分株装于信封袋后带回实验室。
称重前先将植株再次清理,去除杂草及杂质等,把植株分为繁殖器官(花部结构)和营养器官(根、茎和叶)两部分,将此两部分分装并置于80 ℃烘箱中烘24 h后用电子天平(0.0001 g)称重。
样地特征检测于2014年7月26—30日在海北站进行,检测点位于2013年湿生扁蕾样本收集地点。植被平均高度测量方法为在金露梅灌丛和嵩草草甸生境随即选取10个典型样地,分别用卷尺和直尺测量金露梅植株高度和嵩草草甸高度;土壤温度和湿度测量采用便携土壤测试仪(AMT-300),土壤深度为0—20 cm,空气温度测量采用数字式温湿度计(321S-CEM),测量高度为垂直地面100 cm,数据收集时间为每天12:00,每次测量选取样本数为5,并在晴朗日测量5日作为重复。
1.4数据分析
首先用Excel软件对数据进行预处理,包括繁殖器官生物量(R)和个体大小(总生物量,V)的对数(lg)转换,以及繁殖分配比例(RA=R/V)的计算等,然后用SPSS 19.0 for Windows软件对数据进行统计分析。首先用非参数检验(Nonparametric Test ) 中的1-Sample K-S 检验数据是否符合正态分布, 对于正态分布的数据用Indepentent-Sample T test 检验两组数据间的差异, 用One-way ANOVA 和Pos hoc-LSD 比较多组数据之间的差异, 对不服从正态分布的用K Independent Samples ( Kruskal-Wallis H) 进行比较; 通过Correlate 的Bivariate Correlations 分析两个变量之间的相关关系, 用Regression 中的Linear 进行线性回归分析, 统计数据用平均值±标准误表示。
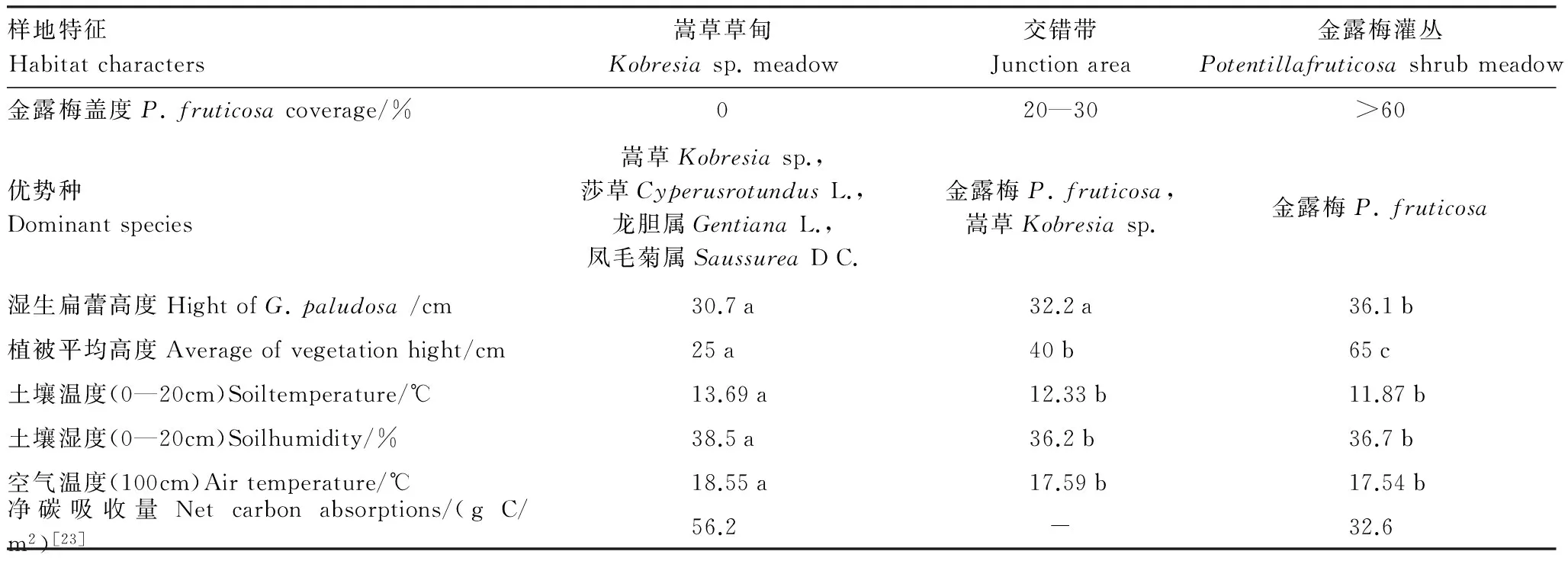
表1 湿生扁蕾观测样地特征
同一行不同字母表示具有显著性差异(P<0.05)
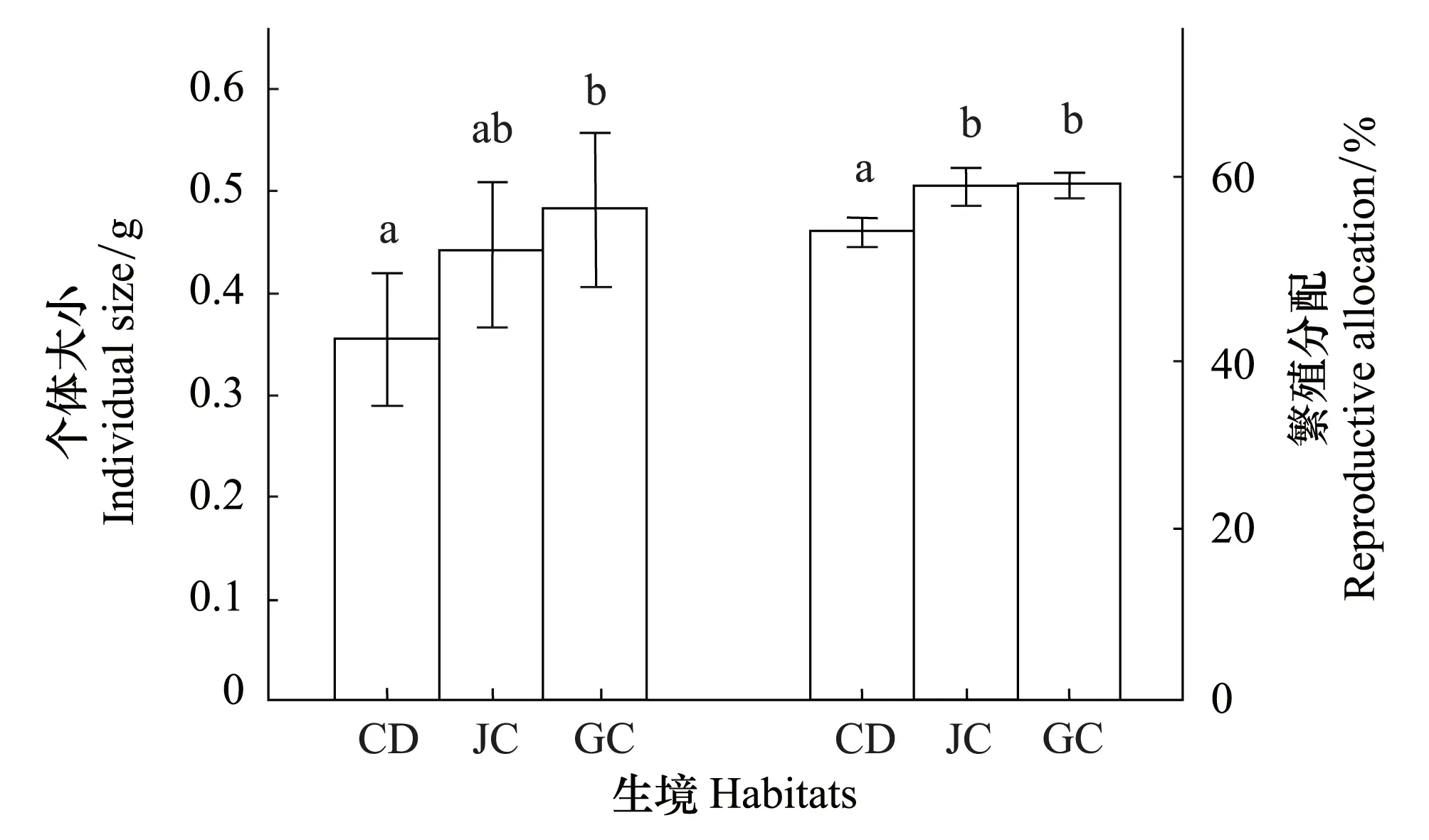
图1 不同生境湿生扁蕾个体大小和繁殖分配 Fig.1 Individual size and reproductive allocation of Gentianopsis paludosa in different habitatsCD: 嵩草草甸 Kobresia sp. Meadow; JC: 交错带 Junction area; GC: 金露梅灌丛 P. fruticosa shrub meadow; 不同小写字母表示湿生扁蕾的个体大小/繁殖分配在不同生境下具有显著差异(P<0.05)
2结果与分析
2.1不同生境环境因子
3种生境下植被平均高度存在显著差异,金露梅灌丛植被平均高度显著高于嵩草草甸(P<0.05),而3种生境下湿生扁蕾植株高度也存在显著差异,其中金露梅灌丛下湿生扁蕾植株高度要高于嵩草草甸(P<0.05)(表1)。从所统计的环境因子来看,嵩草草甸生境的土壤温度、湿度、空气温度以及净碳吸收量都显著高于金露梅灌丛(表1),此结果与前人所统计的结果相一致[23]。
2.2不同生境下的个体大小
3种不同生境下湿生扁蕾个体大小(即总生物量,g)存在差异(图1)(P<0.05),其中金露梅灌丛生境下湿生扁蕾的个体大小((0.48±0.037)g)显著高于嵩草草甸生境((0.36±0.032)g),而交错带生境下湿生扁蕾的个体大小((0.44±0.035)g)与前两者不存在显著差异,在生境从嵩草草甸经交错带到金露梅灌丛的变化中,湿生扁蕾的个体大小呈现出递增趋势。
2.3不同生境下大小依赖的繁殖器官绝对投入量
由于繁殖器官生物量(R)与个体大小(V)存在异速增长效应[8.24],因此对R-V关系分析均采用对数(lg)转换后的线性关系分析。结果表明湿生扁蕾的繁殖器官绝对投入量(lgR)在3种生境下均随着个体大小(lgV)的增大而增大,且呈现出显著正相关关系(图2),而且3种生境下湿生扁蕾的繁殖都需要一个最小植株个体大小值(繁殖阈值)(图2黑圈所示)。从x轴的截距(个体大小值)可以看出,在生境从嵩草草甸经交错带到金露梅灌丛的变化中,繁殖阈值呈现出逐渐减小趋势(繁殖阈值分别为5.272 g, 4.083 g和3.606 g)。
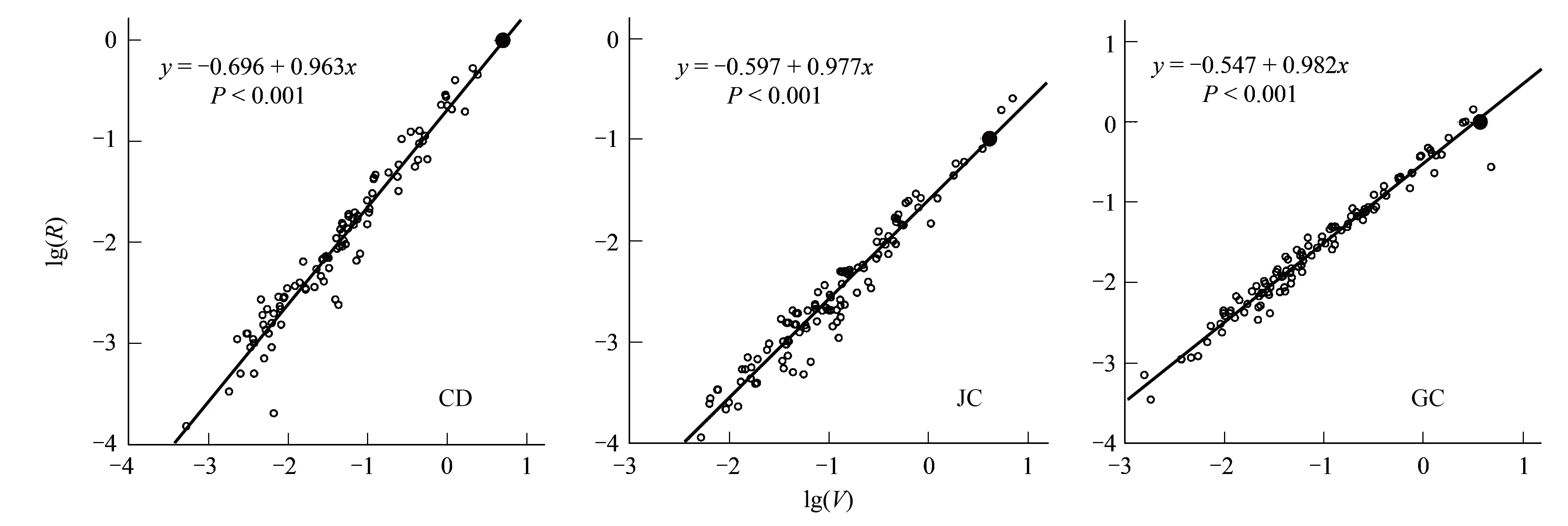
图2 不同生境湿生扁蕾繁殖器官生物量(lg R)与个体大小(lg V)的相关性分析,实心黑圈代表繁殖阈值Fig.2 Correlation analysis between Individual size (lg V) and reproductive biomass (lg R) of G. paludosa in different habitats, the solid black circles represent the thresholds for reproduction in different populations
2.4不同生境下大小依赖的繁殖分配
在种群水平上,3种生境下湿生扁蕾的繁殖分配比例表现出差异性,其中嵩草草甸生境下湿生扁蕾的繁殖分配(0.53±0.01)显著低于交错带(0.57±0.009)和金露梅灌丛生境(0.59±0.007),而后两者不存在显著差异(图1)。
在个体水平上,3种生境下湿生扁蕾的繁殖分配与个体大小负相关(图3),但是这种负相关关系只在嵩草草甸生境下表现出显著性,而在交错带和金露梅灌丛生境下负相关关系不显著。另外,在从嵩草草甸经交错带到金露梅灌丛的生境变化中,湿生扁蕾的繁殖分配与个体大小的相关系数(r)表现为依次降低趋势(分别为0.234、0.135和0.005),表明其相关程度依次降低。
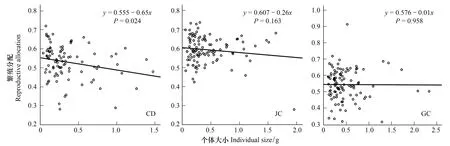
图3 不同生境下湿生扁蕾植株个体大小与繁殖分配的相关分析Fig.3 Correlation analysis between Individual size and reproductive allocation of G. paludosa in different habitats
2.5不同生境个体依赖的花数目
在种群水平上,3种生境下湿生扁蕾的总花数目和开花期花数目不存在显著差异(P>0.05),但是嵩草草甸生境下湿生扁蕾的蕾期花数目要显著高于交错带和金露梅灌丛(P<0.05),而结果期花数目则显著低于交错带和金露梅灌丛(P<0.05)(图4)。
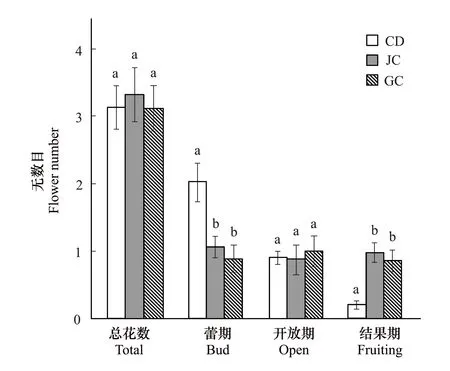
图4 不同生境下湿生扁蕾花数目Fig.4 Flower numbers of G. paludosa in different habitats 不同小写字母表示湿生扁蕾的花数目在不同生境下具有显著差异(P<0.05)
在个体水平上,3种生境下湿生扁蕾的花数目(总数目)都随着植株个体的增大而增加,并且都达到极显著水平的正相关(P<0.001)(图5),说明湿生扁蕾的花数目存在大小依赖效应。
3讨论
3.1湿生扁蕾在不同生境下的个体大小
除植物自身的遗传特性外,环境(包括生物和非生物)是影响植物个体大小的最主要的外界因素[25- 26],植物生活史理论也强调,生物量分配的改变可以在形态上允许植物个体更快的适应新环境[27]。本文研究结果表明,湿生扁蕾在嵩草草甸生境下的个体大小(总生物量)比金露梅灌丛生境下的小,而草甸灌丛交错带生境下的个体大小则介于两者之间(图1)。这可能是因为金露梅灌丛相对嵩草草甸而言具有更高的植株高度(表1),进而光资源成为了该生境下的限制因子,湿生扁蕾为了光竞争就需要增加其生物量(尤其是茎叶)来应对这种压力[28- 29],灌丛生境下较高的湿生扁蕾株高也证实了此观点(表1);而在嵩草草甸生境,光资源不再是湿生扁蕾生长的限制因子,较高的植株密度引起的土壤资源竞争是限制湿生扁蕾生存的关键因子(表1)[21,30],因此必然导致湿生扁蕾个体大小的降低以补偿生长[25]。

图5 不同生境下湿生扁蕾植株个体大小与花数目的相关分析Fig.5 Correlation analysis between Individual size and flower numbers of G. paludosa in different habitats
3.2湿生扁蕾不同生境下大小依赖的繁殖器官绝对投入量
分析个体大小依赖的繁殖策略是理解植物繁殖资源分配的关键[8]。繁殖资源的绝对投入量通常随植物个体的增大而增加,而且进行繁殖的植株个体大小存在一个阈值,即植株必须生长到一定大小才会开始繁殖[10,11]。在个体水平上,3个生境下的湿生扁蕾的繁殖器官的绝对投入都随着个体大小的增加而增加,并且呈现出显著正相关关系(图2),这是对以上观点的证实,说明该物种能同时增加对营养生长和繁殖的资源投入,生境的影响主要作用于湿生扁蕾的个体大小,而不是直接作用于繁殖器官的大小。另外,进行繁殖所需的植株个体大小阈值也会随环境变化而发生变化,例如生长于西藏林芝地区的岩白菜在林线以下会随海拔升高而增加,而在林线以上则变化不大,推测阈值的变化与土壤有机质含量有关,即植株可获得的资源增加,则阈值也会变大[11]。在生境从嵩草草甸经交错带到金露梅灌丛的过渡中,湿生扁蕾所获得的有效资源是逐步减少的[30],而研究结果显示,湿生扁蕾繁殖所需的个体大小的阈值也呈现出递减趋势(图2),这似乎也表明植物繁殖所需的个体大小阈值会随其生境可获取的有效资源量的增加而变大[11]。当然,物种的开花时间也可能受气候因子、植株在特定环境中的存活率,以及植物本身的遗传发育限制影响[31],而要系统揭示不同生境下湿生扁蕾繁殖阈值的变异机制则需要开展进一步实验和理论研究。
3.3不同生境下大小依赖的繁殖分配
从种群角度考虑,一般意义上来说,生长在开阔地带的植物会投资更多的资源给繁殖器官,这是因为有性繁殖利于遗传多样性增加,同时也更利于种子的传播、扩散和抗干扰[32]。例如生长在开阔地带的金叶马兰(Kalimerisintergrifolia)比林下的具有更高的繁殖投资比例[17];同样,生长在裸露的盐碱地带的三角叶滨藜的繁殖投资比例比非裸露环境下的要高[33]。但是刘左军等证实,生长在裸地和非裸地的黄帚橐吾(Ligulariavirgaurea)的繁殖分配没有显著差别,推测此结果可能是与其遗传特性有关[16]。而本文研究结果发现,相对金露梅灌丛,嵩草草甸具有更为开阔的环境(表1),但是其繁殖分配却显著低于金露梅灌丛和交错带(图1),这显然不同于以往研究结果。其原因可能与湿生扁蕾的遗传特性与繁殖策略有关。湿生扁蕾依赖种子繁殖,但其繁殖模式为延迟自交,虽然这种繁殖模式也为异交带来可能,但在海北站地区并不存在其传粉昆虫[22],这就意味着湿生扁蕾的种子皆为只含有一套母本基因序列的自交后代。尽管由于近交衰退的存在,自交物种不利于其遗传多样性的扩大,但是根据“局部适应性假说” (个体在起源区有较好表现,而移栽个体的适合度随移栽距离的增加而降低)[34],自交的繁殖策略使其明显有利于其后代快速适应当地适宜其生长的小生境,从而降低种子扩散风险。另外,对于嵩草草甸生境而言,湿生扁蕾具有更好的生存条件(表1),而根据经典r-K生活史策略理论,湿生扁蕾必将更多的资源投资到营养器官以保证其较高的竞争力。
从个体角度考虑,多数研究表明繁殖分配与个体大小呈负相关性, 即个体越大投入到繁殖部分的资源相对就越小[8,35]。Reekie认为, 这种负相关可能与繁殖代价与个体大小成正比有关, 繁殖代价的增大能在一定程度上解释资源对繁殖支持结构(即营养器官) 分配的增加[36]。由于高山环境中较大个体的植物较易受到更大程度的环境干扰(动物取食、踩踏以及强风、冰雹等袭击等),其繁殖代价通常较高,相应的其繁殖支持结构会获得更多资源来补偿这种干扰,进而使繁殖分配降低[11]。青藏高原地区属典型的高山环境,因此生长于该地区的湿生扁蕾所承受的环境干扰也较大,本研究发现湿生扁蕾的繁殖分配与个体大小负相关(图3),恰好证实了以上观点。同时,各种生境下湿生扁蕾繁殖分配与个体大小的负相关程度表现出差异性(草甸>交错带>金露梅灌丛),这可能与各种群受干扰程度不同有关。草甸生境较为开阔,湿生扁蕾的平均高度高于嵩草,因而其受到强风、冰雹等恶劣气候的影响较大,同时嵩草草甸是牛羊的主要牧草资源,因此湿生扁蕾所受到的牛羊践踏等干扰也会较大。而在交错带和金露梅灌丛下,湿生扁蕾的平均高度要低于金露梅,因此避免了恶劣天气的直接冲击,并且也在一定程度上阻隔了牛羊的践踏。因此,在较大环境干扰的嵩草草甸生境下,湿生扁蕾通过这种繁殖分配与个体大小的适应性调整(负相关)来保障其最大程度的繁殖成效,而在对环境干扰具有一定屏蔽作用的交错带和金露梅灌丛生境下,这种调整表现不够明显,甚至繁殖分配和个体大小的负相关关系没有达到显著性水平(图3)。
3.4不同生境个体依赖的花数目
在花期,花数目基本上可以代表繁殖适合度,尤其是对于自花授粉物种来说,每朵花在未进行传粉结实前都代表产生后代的可能,花数目越多,产生后代的可能性越大,繁殖适合度就越高。多数研究表明植物在一个生长季中生产的花数通常也随植物个体增大而增加[12- 14],表明个体较大的植株在繁殖上也具有较高的适合度。但同时Worley也强调了植物的遗传特性在上述变化中的关键作用[12]。本文结果显示,在个体水平上,3个生境下的湿生扁蕾的花数目与个体大小存在显著正相关(图5),此结果也证实了个体较大的植株在繁殖上也具有较高的适合度这一观点。但是从种群角度来看,尽管3个生境下植株大小存在差异,但是花期的总花数目并没有表现出显著性差异(图1,图4),这似乎表明湿生扁蕾的自身遗传特征在花数目决定上起到重要作用。值得注意的是,虽然花总数在不同种群之间具有恒定性,但是在同一时间各种群湿生扁蕾花的发育程度却不尽相同:嵩草草甸生境下具有更多的花蕾数;而金露梅灌丛生境下具有更多的结果数(图5)。在具有相同花发育时间前提下,这说明在金露梅灌丛生境下,湿生扁蕾的花期较短。根据Molau理论,传粉者缺少引起的花粉胁迫(pollen risk)会使植物花期延长,而资源竞争引起的种子胁迫(seed risk)会使花期缩短[37]。对于依赖自交来完成繁殖的湿生扁蕾而言,资源竞争(非传粉者竞争)在其花期长短上应该起到决定作用。在金露梅灌丛生境下的草本植物显然具有比嵩草草甸生境更大的资源竞争压力(表1)[23,30],因此必然造成花期的缩短以尽快完成其生命史。
4结论
本文的研究结果表明,不同群落类型提供的生境差异对湿生扁蕾的个体大小以及繁殖分配都造成影响。在种群水平上:湿生扁蕾的个体大小随着生境类型从草甸经交错带到灌丛的变化而增大,而灌丛和交错带生境下湿生扁蕾的繁殖投资比例(繁殖相对投入)也显著高于草甸生境;湿生扁蕾的花数目在3个生境下尽管不存在差异,但同一时期下嵩草草甸生境下的湿生扁蕾具有更多的花蕾数,金露梅灌丛生境下则具有更多的结果数。在个体水平上,湿生扁蕾的繁殖绝对投入与个体大小显著正相关,且各种群植株都存在繁殖阈值, 而繁殖阈值随生境类型CD-JC-GC的变化逐渐减小;湿生扁蕾的繁殖投资比例(繁殖相对投入)与个体大小负相关,但相关系数随生境类型CD-JC-GC的变化逐渐减小;湿生扁蕾花数目与植株个体大小在3种生境下都呈显著正相关关系。
湿生扁蕾的繁殖分配存在个体大小依赖效应,但个体大小以及繁殖分配水平无论在种群水平和个体水平上都会随不同群落类型提供的生境变化而变化,造成这种变化的原因可能由两方面造成:一方面主要是由不同生境下自然条件的不同造成的;另一方面,这种变化也与湿生扁蕾的遗传特性和延迟自交的繁育系统特征有关。无论是哪个方面起到主导作用,湿生扁蕾这种不同生境下个体大小依赖的繁殖投资差异都是其与相关生境长期适应和进化(生境选择)的结果。
参考文献(References):
[1]Gadgil M, Bossert W H. Life historical consequences of natural selection. The American Naturalist, 1970, 104(935): 1- 24.
[2]Silvertown J, Charlesworth D. Introduction to Plant Population Biology.US: John Wiley & Sons, 2001.
[3]Cheplick G P. Life history trade-offs in Amphibromus scabrivalvis (Poaceae): allocation to clonal growth, storage, and cleistogamous reproduction. American Journal of Botany, 1995, 82(5): 621- 629.
[4]Zhang D Y. Plant Life-History Evolution and Reproductive Ecology. Beijing: Science Press, 2004, 110: 303.
[5]Weiner J. Allocation, plasticity and allometry in plants. Perspectives in Plant Ecology, Evolution and Systematics, 2004, 6(4): 207- 215.
[6]Weiner J. The influence of competition on plant reproduction. Plant reproductive Ecology: Patterns and Strategies, 1988: 228- 245.
[7]Bonser S P, Aarssen L W. Interpreting reproductive allometry: individual strategies of allocation explain size-dependent reproduction in plant populations. Perspectives in Plant Ecology, Evolution and Systematics, 2009, 11(1): 31- 40.
[8]Weiner J, Campbell L G, Pino J, Echarte L. The allometry of reproduction within plant populations. Journal of Ecology, 2009, 97(6): 1220- 1233.
[9]孟丽华, 王政昆, 刘春燕, 朱万龙. 高山植物圆穗蓼的繁殖资源分配. 西北植物学报, 2011, 31(6): 1157- 1163.
[10]Jongejans E, De Kroon H, Berendse F. The interplay between shifts in biomass allocation and costs of reproduction in four grassland perennials under simulated successional change. Oecologia, 2006, 147(2): 369- 378.
[11]王赟, 胡莉娟, 段元文, 杨永平. 岩白菜(虎耳草科)不同海拔居群的繁殖分配. 云南植物研究, 2010, 32(3): 270- 280.
[12]Worley A C, Barrett S C H. Evolution of floral display inEichhorniapaniculata(Pontederiaceae): direct and correlated responses to selection on flower size and number. Evolution, 2000, 54(5): 1533- 1545.
[13]Worley A C, Baker A M, Thompson J D, Barrett S C H. Floral display in Narcissus: variation in flower size and number at the species, population, and individual levels. International Journal of Plant Sciences, 2000, 161(1): 69- 79.
[14]Sato H, Yahara T. Trade-offs between flower number and investment to a flower in selfing and outcrossing varieties of Impatiens hypophylla (Balsaminaceae). American Journal of Botany, 1999, 86(12): 1699- 1707.
[15]张大勇, 姜新华. 植物交配系统的进化、资源分配对策与遗传多样性. 植物生态学报, 2001, 25(2): 130- 143.
[16]刘左军, 杜国祯, 陈家宽. 不同生境下黄帚橐吾(Ligulariavirgaurea)个体大小依赖的繁殖分配. 植物生态学报, 2002, 26(1): 44- 50.
[17]Yuan Z N, Lu J M, Chen J Y, Jiang S Z. Patterns of resource allocation in different habitats of Kalimeris intergrifolia in Northeast China. Spanish Journal of Agricultural Research, 2011, 9(4): 1224- 1232.
[18]王一峰, 刘启茜, 裴泽宇, 李海燕. 青藏高原3种风毛菊属植物的繁殖分配与海拔高度的相关性. 植物生态学报, 2012, 36(1): 39- 46.
[19]Hartgerink A P, Bazzaz F A. Seedling-scale environmental heterogeneity influences individual fitness and population structure. Ecology, 1984, 65(1): 198- 206.
[20]范邓妹, 杨永平. 不同生境下珠芽蓼(蓼科)的繁殖策略比较. 云南植物研究, 2009, 31(2): 153- 157.
[21]李英年, 王勤学, 古松, 伏玉玲, 杜明远, 赵亮, 赵新全, 于贵瑞. 高寒植被类型及其植物生产力的监测. 地理学报, 2004, 59(1): 40- 48.
[22]Duan Y W, Dafni A, Hou Q Z, He Y P, Liu J Q. Delayed selfing in an alpine biennialGentianopsispaludosa(Gentianaceae) in the Qinghai-Tibetan Plateau. Journal of Integrative Plant Biology, 2010, 52(6): 593- 599.
[23]赵亮, 徐世晓, 李英年, 唐艳鸿, 赵新全, 古松, 杜明远, 于贵瑞. 青藏高原矮嵩草草甸和金露梅灌丛草甸CO2通量变化与环境因子的关系. 西北植物学报, 2006, 26(1): 133- 142.
[24]Sugiyama S, Bazzaz F A. Size dependence of reproductive allocation: the influence of resource availability, competition and genetic identity. Functional Ecology, 1998, 12(2): 280- 288.
[25]Tilman D. Plant Strategies and the Dynamics and Structure of Plant Communities. USA: Princeton University Press, 1988.
[26]Schenk H J, Jackson R B. Mapping the global distribution of deep roots in relation to climate and soil characteristics. Geoderma, 2005, 126(1/2): 129- 140.
[27]Bazzaz F A. Plants in Changing Environments: Linking Physiological, Population, and Community Ecology. Cambridge: Cambridge University Press, 1996.
[28]Abrahamson W G, Gadgil M. Growth form and reproductive effort in goldenrods (Solidago, Compositae).The American Naturalist, 1973, 107(957): 651- 661.
[29]Niu K C, Luo Y J, Choler P, Du G Z. The role of biomass allocation strategy in diversity loss due to fertilization. Basic and Applied Ecology, 2008, 9(5): 485- 493.
[30]苏爱玲, 徐广平, 段吉闯, 汪诗平, 张振华. 祁连山金露梅灌丛草甸群落结构及主要种群的点格局分析. 西北植物学报, 2010, 30(6): 1231- 1239.
[31]Worley A C, Harder L D. Size-dependent resource allocation and costs of reproduction in Pinguicula vulgaris (Lentibulariaceae). Journal of Ecology, 1996, 84(2): 195- 206.
[32]Fischer M, Van Kleunen M. On the evolution of clonal plant life histories. Evolutionary Ecology, 2001, 15(4/6): 565- 582.
[33]Wertis B A, Ungar I A. Seed demography and seedling survival in a population of Atriplex triangularis Willd. American Midland Naturalist, 1986, 116(1): 152- 162.
[34]Antonovics J. Evolution in closely adjacent plant populations V. Evolution of self-fertility. Heredity, 1968, 23(2): 219- 238.
[35]Kawano S, Masuda J. The productive and reproductive biology of flowering plants. Oecologia, 1980, 45(3): 307- 317.
[36]Reekie E G. An explanation for size-dependent reproductive allocation inPlantagomajor. Canadian Journal of Botany, 1998, 76(1): 43- 50.
[37]Molau U. Relationships between flowering phenology and life history strategies in tundra plants. Arctic and Alpine Research, 1993, 25(4): 391- 402.
habitats of the Qinghai-Tibetan Plateau
HOU Qinzheng1, YE Guangji2, MA Xiaobing1, SU Xue1, ZHANG Shihu1, SUN Kun1,*
1NorthwestNormalUniversity,Lanzhou730070,China2QinghaiAcademyofAgricultureandForestrySciences,Xi′ning810016,China
Abstract:Understanding plant resource investment and allocation is an important issue in ecology, since this can reflect the plant life-history strategies as a response to the changing environment. Many studies in the last decades have focused on plant resource allocation at different elevations, and most of them have determined that the plant resource allocation is strongly correlated with the plant size, representing a positive correlation between reproductive investment and plant size but a negative correlation between reproductive allocation and plant size. However, research has also shown that the reproductive allocation had no correlation with plant size. Significant elevation variation in the Qinghai-Tibetan Plateau provides the ecologists an ideal platform to reveal the plant resource allocations, since elevation variation can bring strong environment variances. However, previous studies did not address the variation in plant habitats, which could have directly affected the plant′s resource allocation. In this study, we tested the reproductive allocation characters of Gentianopsis paludosa at three habitats located on the same elevation, on the east Qinghai-Tibetan Plateau: Kobresia sp. meadow (CD), Potentilla fruticosa shrub meadow (GC), and their junction area (JC). Centering the study on two levels, population and individual, we aimed to test the resource allocation characters of G. paludosa and reveal the relationship between the plant resource allocation and the plant habitats. Our results revealed the following: (1) The abiotic conditions were different among the three habitats, among which habitat CD displayed relatively better abiotic conditions compared with the others since the soil temperature and humidity, air temperature, and the net carbon absorptions were higher and optimal for plant growth. (2) At the population level, the individual size and reproductive allocation increased following the habitat variation of CD-JC-GC; the total flower numbers of G. paludosa did not differ significantly among the three habitats, whereas the bud numbers in the meadow were greater than those in the shrub meadow, and fruiting flower numbers in the meadow habitat were lower than those in the shrub meadow. (3) At the individual level, the reproductive biomass was positively correlated with individual size; a size threshold existed in G. paludosa and it declined with the habitat variation of CD-JC-GC; the reproductive allocation of G. paludosa had a negative correlation with the individual size, whereas the correlation coefficient declined following the habitat variation of CD-JC-GC; the flower number was positively correlated with individual size in all three habitats. These results suggest that reproductive allocation of G. paludosa is size-dependent, and that habitat variation can influence reproductive allocation and life-history strategies. The plant size and reproductive allocation characters were strongly related with their habitats, and reproductive allocation varied at both the population level and individual level. These variations were caused, primarily, in two ways: (1) the different natural conditions of the three habits could play an important role in determining the reproductive allocation characters; and (2) the genetic characters and the delayed-selfing breeding system were also correlated with the reproductive allocation. Although it was difficult to determine which of the two was dominant, the size-dependent reproductive allocation of G. paludosa in different habitats was undoubtedly a result of co-evolution between a plant and its habitat.
Key Words:Gentianopsis paludosa; reproductive allocation; habitat variation; size-dependent; Qinghai-Tibetan Plateau
基金项目:国家自然科学基金资助项目(31360064)
收稿日期:2014- 03- 13; 网络出版日期:2015- 08- 26
*通讯作者
Corresponding author.E-mail: kunsun@163.com
DOI:10.5846/stxb201403130437
侯勤正,叶广继,马小兵,苏雪,张世虎,孙坤.青藏高原不同生境下湿生扁蕾(Gentianopsispaludosa)个体大小依赖的繁殖分配.生态学报,2016,36(9):2686- 2694.
Hou Q Z, Ye G J, Ma X B, Su X, Zhang S H, Sun K.Size-dependent reproductive allocation ofGentianopsispaludosain different habitats of the Qinghai-Tibetan Plateau.Acta Ecologica Sinica,2016,36(9):2686- 2694.

