基于Ebb&Flow灌溉系统的不同浓度营养液对蝴蝶兰生长
摘要:采用循环潮水式Ebb & Flow灌溉营养液法栽培蝴蝶兰“Taisuco Hatarot”,设置4组不同浓度的营养液,标号分别为1/2S、S、3/2S、2S,研究其对蝴蝶兰生物量、营养元素分配规律、开花特性等生长发育相关指标的影响。结果表明,经浓度为1S的营养液处理后,植株的根数、叶片面积、植物体干质量、花梗产生至开花所需时间、花期、花数等指标均优于其他处理组;营养液处理植株6、9个月后,植株体内K元素的含量从营养生长到生殖生长过程中不断增高,Ca、Mg元素的含量则在营养生长时期较高。由此表明,营养液浓度S最适合基于Ebb & Flow灌溉系统的蝴蝶兰无土栽培。
关键词:蝴蝶兰;生长发育;营养液;潮水式循环栽培系统
中图分类号: S682.310.7文献标志码: A文章编号:1002-1302(2016)05-0249-04
蝴蝶兰别称蝶兰,为兰科蝴蝶兰属多年生常绿附生草本植物,原产于马来西亚等热带地区,我国台湾地区、菲律宾、爪哇等地也有分布,是兰科植物中栽培最广泛、普及率最高的种类之一,约有50种。蝴蝶兰一般于早春开花,其枝叶繁茂、花朵硕大、颜色艳丽、形态独特、花期长久、结构精巧奇特,深受广大栽培者欢迎和喜爱,是目前室内绿化、美化的新型观赏花卉[1]。近年来,关于蝴蝶兰人工栽培的研究主要集中于设施栽培、催花调控关键技术等方面[2-4]。目前,我国用于花卉的肥料仍以速溶性复合肥为主,施肥不当、用肥过量常导致蝴蝶兰烂根甚至全株死亡[5]。由于蝴蝶兰叶片宽大,传统浇灌方式会造成叶片积水,不仅浪费水资源,还易引起软腐病的发生;传统的管理方式使劳动力成本增加。
目前,蝴蝶兰的无土栽培基质主要有水苔、树皮、椰壳、泥炭藓等[6],这些基质在一定程度上能够影响其生长发育,但矿质营养是影响其成花数量和质量的关键[7-8]。Wang指出,不同氮、磷、钾肥料配比对叶片数具有显著影响[9]。赵九州等研究发现,蕾期施肥和基质类型是影响蝴蝶兰生长发育的2个关键因子[7]。杨少辉等验证了蝴蝶兰水培的可行性,探讨5种营养液配方对蝴蝶兰水培生长的影响,并筛选出最佳配方[10]。然而,目前还没有一套科学完整的蝴蝶兰营养液栽培生产模式。
潮水式循环灌溉系统(recirculating ebb&flow subirrigation systems)起源于设施栽培发达的荷兰,由潮汐灌溉栽培床、营养液循环系统、控制系统、栽培容器四大部分组成,是利用落差原理实现对容器苗底部定时给水与施肥的灌溉方式。国内外较多研究表明,采用该系统栽培作物不仅可提高移栽成活率、减少劳动力成本、改变逆境条件下的生存环境,而且比传统的喷灌、滴灌、漫灌方法节水40%~70%,并能减少环境污染,是一种非常符合现代需要的先进园艺、林业生产方式[11-14]。发达国家已大规模推广使用潮水式底面灌溉营养液栽培系统,此方法不仅可大幅提高盆花品质,还可成批量生产用于出口创汇,大大节约了生产成本[15]。无土基质的配制、营养液的浓度及配方是以全自动潮水式灌施营养液法进行的容器栽培最重要的2个因素,而目前国内关于营养液浓度的研究较少。
在国内外相关研究的基础上,采用潮水式循环灌溉系统对蝴蝶兰“Taisuco Hatarot”进行栽培试验。通过分析不同营养液浓度条件下蝴蝶兰各项生长指标的变化,筛选出最适合蝴蝶兰“Taisuco Hatarot”盆花栽培的营养液浓度,探讨采用循环潮水式灌溉系统工业化生产蝴蝶兰的可行性,以期为蝴蝶兰最优营养液栽培模式的探索提供依据。
1材料与方法
试验于2013年4月至2014年2月在浙江农林大学智能温室、亚热带森林培育国家重点实验室培育基地进行。
1.1材料
供试材料为20个月的蝴蝶兰“Taisuco Hatarot”植株(鲜质量约为80 g),采用韩国园艺研究所兰花栽培用营养液配方,栽培基质为水苔。
1.2方法
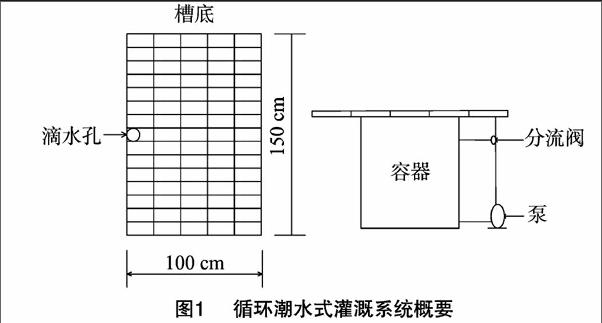
1.2.1灌溉方法及营养液pH值控制采用潮水式底面渗灌法,以定时器控制每次灌施时间(水泵运转时间为5 min),每隔3~4 d自动灌施1次(图1)。当盛水托盘内注满营养液时,花盆利用盆内基质的毛细管作用将渗入盆底的营养液运输至植株根部,营养液在盆中持续一段时间,使每盆植株充分吸收。采用H2SO4、NaOH调节营养液的酸碱度,当pH值上升时采用H2SO4中和,当pH值下降时采用NaOH中和,将pH值控制在5.5左右。
1.2.2试验设计每个处理以40株作为重复,花盆口径 15 cm、高12 cm,栽培基质为水苔。试验以韩国园艺研究所兰花栽培用营养液配方为基本配方,设4个处理,分别为1/2S(EC,0.9 mS/cm)、S(EC,1.4 mS/cm)、3/2S(EC,1.9 mS/cm)、2S(EC,2.4 mS/cm)。栽培期间,每隔3~4 d 测定营养液的pH值、EC值,每月更换1次桶内营养液。采用5%水平的邓肯氏新复极差方差分析法对试验数据进行差异性分析。
1.2.3样品的采集与处理选取相同叶龄的植株测定其生理和形态指标,于每日相同时间取样。采样时先将试验材料洗净,用吸水纸吸干表面水分,称其鲜质量;将样品置于 100 ℃ 恒温箱中杀青0.5 h,然后降温至75 ℃,烘干后用粉碎机将植物粉碎,混合均匀,以备测定矿质元素含量。
1.2.4指标测定观察并记录最大叶面积、叶片数、开花特性、鲜质量、干质量、根系长度、根质量等生物量指标。分别采用HM-20E型pH值测定仪、CM-20E型EC值测定仪测定营养液和供试基质的酸碱度、电导度。采用紫外吸收法测定全氮含量,采用钼酸铵比色法测定P含量,采用Z-6100型原子分光光度计以原子吸收法测定K、Ca、Mg含量[16]。
2结果与分析
2.1营养液pH值及EC值的变化
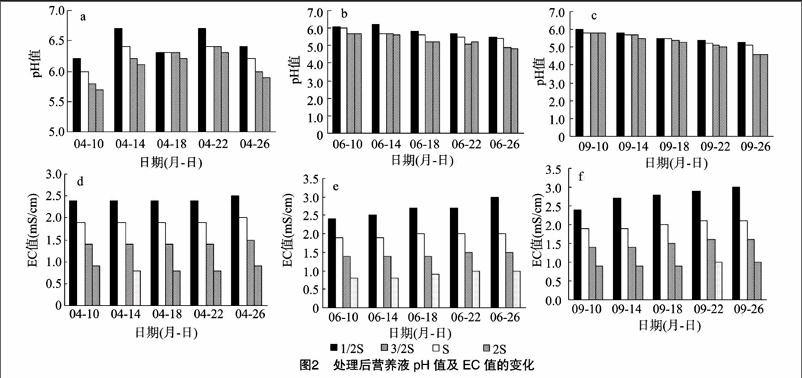
由不同浓度营养液pH值、EC值的变化(图2)可知,6月、9月各浓度营养液的pH值均呈下降趋势。可能的原因为植株根系吸收阳离子多于阴离子,根分泌出的H+多于HCO-3以维持电荷平衡,使根际pH值下降。营养液pH值于4月出现时高时低的现象,这可能与营养生长时期根系对NO-3等阴离子吸收较多有关。此外还观察到,营养液浓度越高,则pH值变化越大,且下降幅度越大。营养液EC值的变化不明显,这是由于每次灌注后营养液本身被植株吸收,余下部分循环收回,植株吸收营养元素的量占营养液中总含量的比例较小,对营养液浓度影响不大,仅在后期高浓度营养液上有所增高,这与高浓度营养液灌施下基质中盐分的积累增加有关。
2.2营养液浓度对生物量的影响
由表1可知,采用S、3/2S处理后,新叶数和根长均无显著性差异。植物根系是吸收营养元素的主要途径之一,根系越茂盛,对营养元素的吸收能力越强。采用S处理后,植株的根数高达18.3条,明显高于其他处理;1/2S处理略低,为 13.7条;3/2S、2S处理的根数仅为11.3、7.3条,S处理的根数是2S处理的2倍多。由图3可知,采用1/2S浓度营养液处理后的根最长,达到31.1 cm。由于浓度过低,植株充分伸长,根系才能获得更多营养物质。采用2S浓度营养液处理后,浓度过高从而抑制根的正常生长,根数、根长均明显低于其他处理。采用S浓度营养液处理后,地上部分、地下部分的生长指标均较好。
叶面积的大小直接反映营养液浓度是否适于植株生长,浓度过高会对植株产生胁迫作用,抑制植株对营养元素的吸收,令植株长势不好;浓度过低则不能保证植物正常生长所需的营养元素含量,导致植株生长发育不完全,造成植株矮小、观赏品质不佳。由图3可知,采用S浓度营养液处理的蝴蝶兰叶面积最大,其次为3/2S、1/2S处理,2S处理的叶面积最小。
2.3营养液浓度对营养元素含量的影响
营养液处理6个月后,叶片中Ca、Mg含量在S、3/2S、2S处理中不存在显著性差异,N、P、K含量则在不同浓度处理中表现出显著性差异。3/2S处理中N、P、K含量分别为2.12、0.33、3.47,是4个处理中含量最高的。随着营养液浓度的上升,K、Ca含量也呈上升趋势。根部各元素的含量均低于叶片,采用3/2S处理时,除Mg外其他元素的含量均随浓度的上升而升高。叶片中N、P含量及根部N、P、K含量较高,是由于高浓度营养液中阳离子含量大;高浓度营养液2S处理后,元素含量下降,可能是由于高浓度无机盐对蝴蝶兰产生盐胁迫,造成植株根系死亡(表1),从而无法吸收营养(表2)。
营养液处理9个月后,叶片中N、K、Mg含量均随营养液浓度的升高而上升。N、P含量在不同处理下呈显著性差异,N含量随浓度的升高而升高,P含量在3/2S处理时最高。根部各元素的含量均低于叶片,N、P含量均随营养液浓度的上升而升高(表3)。
将表2与表3比较可知,以4种不同浓度营养液处理蝴蝶兰6、9个月后,植株内部的营养元素含量发生变化。随着植株的生长,K含量在植株体内呈上升趋势,可见植株从营养生长到生殖生长的转变过程中对K的吸收增多。K在植株生殖生长期需求量较大,Ca、Mg含量则随着植物生长而降低,可见从营养生长到生殖生长的过渡过程中,蝴蝶兰对Ca、Mg的需求量逐渐减少。
2.4不同浓度营养液对开花特性的影响
由表4可知,营养液处理10个月后,开花所需时间、花朵数/花梗数、花梗分枝数量等几项指标均随营养液浓度的升高而升高;花期、花的大小则随营养液浓度的升高而降低。其中,采用S、3/2S浓度的营养液处理后,开花所需时间、花期(d)、花的大小、花朵数/花梗数均未呈现显著性差异。
由表4可知,低浓度营养液处理后,出花梗率表现出明显优势,1/2S处理时出花梗率高达98.5%,S处理达到 95.2%,2S处理最低,仅为40.0%。S处理后,花梗出现时间主要集中于9月、10月,而3/2S、2S处理后则在11月出现少量花梗。在花梗的长度、直径指标中,较高浓度的营养液处理略占优势,3/2S处理后花梗长度最大,达到87.4 mm;2S处理后花梗直径最大,达到0.62 cm。
3结论与讨论
合理的营养元素配比对蝴蝶兰的生长发育及成花至关重要,同时也能提高其观赏价值。
采用循环潮水式Ebb & Flow灌溉系统,以不同浓度营养液(1/2S、S、3/2S、2S)处理蝴蝶兰“Taisuco Hatarot”,测定相关的生长及生理指标。结果表明,在营养生长阶段,采用S浓度营养液处理后的植株根数明显高于其他处理组,而采用2S浓度营养液处理后的植株根数、根长均明显低于其他处理组,可能是由于基质中积累了较多无机盐,对植物生长产生盐胁迫作用。1/2S、S营养液处理下的死亡率最低,采用S营养液处理后,蝴蝶兰地上部分及地下部分的生长指标均较好。
用S、3/2S浓度营养液处理后,植株叶数、根长、鲜质量等指标均未表现出显著性差异。由死亡率可知,高浓度营养液对蝴蝶兰的生长具有胁迫作用。植物根系所吸收的水分是含有一定溶质的溶液,对于固体基质和非固体基质的栽培,营养液浓度都是影响根系吸收的因素之一。营养液浓度越高,则阳离子含量越高,而营养液浓度过高会使离子被载体吸收运转达到饱和状态,影响植物对水分和养分的吸收。如果介质溶液的水势比根系细胞的水势低,反而会使植物体内原有水分通过质膜反渗透到介质中,使植物出现生理失水,导致萎焉和死亡[11,17]。在生殖生长阶段采用S、3/2S营养液处理后,蝴蝶兰开花所需时间、花期、花的大小、花朵数/花梗数等指标均无显著性差异。采用1/2S、S营养液处理后花梗出现率最高,且花梗出现时间较早;采用3/2S、2S处理后花梗出现率较低,且花梗出现时间较晚,表明浓度过高抑制了花梗产生并延长了出花梗时间。
由不同生长阶段蝴蝶兰叶和根中大量元素的含量分析可知,N元素被称为植物的生命元素,在蝴蝶兰营养生长期的需求量较大,与植物的光合速率密切相关[18]。兰花对N素缺乏较敏感,缺N时叶片发黄,下部叶片开始逐渐向上发展[19]。Kubota等认为,过量铵盐使蝴蝶兰的叶片数量减少并抑制根的生长[20]。本试验结果表明,S、3/2S营养液中N元素的供应能满足蝴蝶兰对N元素的吸收。生殖生长阶段对N元素的需求有所下降,而K元素在生殖生长阶段作用显著。Wang提出,蝴蝶兰缺K时叶片会出现由下向上的黄变现象和紫色斑点,甚至在抽出花梗和开花后坏死[21]。在蝴蝶兰开花期增施K肥可增加花枝数、开花数、花葶直径、花朵直径,高K可增加蝴蝶兰的单枝开花数[22],本试验中蝴蝶兰在生长后期的开花情况也验证了K元素在生殖生长阶段的作用。
采用循环潮水式Ebb & Flow灌溉系统,营养液浓度为S、3/2S时栽植蝴蝶兰的生理指标测试结果相差不明显,但考虑实用性和降低生产成本,营养液浓度S更适合基于循环潮水式Ebb & Flow灌溉系统的蝴蝶兰盆栽。
参考文献:
[1]董必慧. 蝴蝶兰的生物学特性及科学栽培方法[J]. 生物学通报,2002,37(12):52.
[2]廖福琴. 闽西地区蝴蝶兰高山催花技术研究[J]. 福建农业学报,2011,26(3):405-408.
[3]Li J Y,Su M H,Lin L X. Floral in duction conditions for Phalaenopsis[J]. Fujian Agric Sci,2008,23(4):466-468.
[4]Liao F Q. Technique of forcing in alpine flowering for phalaenopsis in western Fujian[J]. Fujian Agric Sci,2011,26(3):405-408.
[5]蒋瑞萍,李苹,徐培智,等. 花卉缓/控释复合肥对盆栽蝴蝶兰生长发育及其观赏性的影响[J]. 中国农学通报,2012,28(19):184-188.
[6]Blanchard M G,Runkle E S. Container opacity and media components influence rooting of potted Phalaenopsis and Doritaenopsis orchids[J]. Acta Hort,2008,788:115-120.
[7]赵九洲,陈洁敏,陈松笔,等. 基质与氮磷钾比例对蝴蝶兰(Phalaenopsis hybridium)生长发育的影响[J]. 园艺学报,2000,27(5):383-384.
[8]Wang Y T. Impact of salinity and media on growth and flowering of a hybrid Phalaenopsis orchid[J]. HortScience,1998,33(2):247-250.
[9]Wang Y T. Phalaenopsis mineral nutrition[J]. Acta Hort,2010,878:321-334.
[10]杨少辉,季静,王罡. 不同营养液对蝴蝶兰水培生长的影响[J]. 河北农业大学学报,2008,31(6):30-33.
[11]Yu S J,Wang T,Jin Z Y,et al. Container culture experiments of Betula platyphylla(Ⅱ)—Selection of the optimum formula for substrate[J]. Beijing For Univ,2001,23(2):90-92.
[12]Kahlown M A,Kemper W D. Factors affecting success and failure of trickle irrigation systems in Balochistan,Pakistan[J]. Irrigation Science,2007,26(1):71-79.
[13]Arabi A S,Raimi J,Dewu B M. Delineation of the subsurface for determination of suitable borehole sites for irrigation work at Kan kurmi,North central basement complex,Nigeria[J]. Int J Appl Environ Sci,2011(6):301-308.
[14]Savvas D. Automated replenishment of recycled greenhouse effluents with individual nutrients in hydroponics by means of two alternative models[J]. Biosyst,Eng,2002,83:225-236.
[15]郁书君,李贞植,俞牵植,等. 杜鹃无土栽培基质配方的研究[J]. 园艺学报,2004,31(2):210-214.
[16]中国土壤学会农业化学专业委员会.土壤农业化学常规分析方法[M]. 北京:科学出版社,1983.
[17]郭世荣. 无土栽培学[M]. 北京:中国农业出版社,2003:39.
[18]Dejong I M,Day K R,Johnson R S. Pxrtitioning of leaf nitrogen with respect to within canopy light exposure and nitorgen availability in peach[J]. Trees,1989(3):89-95.
[19]赵令妹. 中国养兰集成[M]. 北京:中国林业出版社,2006:373-374.
[20]Kubota,Satoshi Y,Kazuo S,et al. Effects of ammonium to nitrate ratio in culture medium on growth and nutrition absorption of Phalacnopsis scedings in vitro[J]. Environmcnt Control in Biology,2000,38(4):281-284.
[21]Wang Y T. Potassium nutrition affects Phalaenopsis growth and flowering[J]. HortScience,2007,42(7):1563-1567.
[22]陈尚平,汤久顺,苏家乐,等. 不同氮、磷、钾水平对蝴蝶兰养分吸收及生长发育的影响[J]. 江苏农业学报,2007,23(6):630-633.郑云珽,斯金辉,刘珠琴. 不同授粉品种对清香梨果实品质的影响[J]. 江苏农业科学,2016,44(5):253-255.

