体积功的计算与热力学第一定律
李 楠 张立忠 赵秀峰
(昌吉学院化学与应用化学系 新疆 昌吉 831100)
体积功的计算与热力学第一定律
李楠张立忠赵秀峰
(昌吉学院化学与应用化学系新疆昌吉831100)
摘要:体积功是由于系统膨胀或者压缩,系统与环境之间传递的能量。在不可逆过程中,系统的压力和环境的压力不相等,但是热力学中规定体积功要根据环境的压力来计算。根据系统内部动能向热力学能转化,阐明了根据环境的压力计算体积功与热力学第一定律的一致性。
关键词:体积功;不可逆过程;热力学第一定律
热力学第一定律是能量守恒定律在热力学中的应用,表示为△U=Q+W[1-2]。其中,功W分为体积功和其他功两类。体积功可以理解为一种特殊形式的机械功。根据机械功等于力乘以在力的方向上的位移,体积功被定义为,其中psurr为环境施加于系统的压力。从定义可以看出,体积功实际就是环境压力psurr所做功的负值。取负值是因为dV是以系统为参照的。若环境对系统做功,系统被压缩(dV<0),做功为正值,对系统的热力学能U有正贡献;反之,若系统对环境做功,系统膨胀(dV>0),做功为负值,对系统的热力学能U有负贡献。这样计算出的体积功与热力学第一定律表达式△U=Q+W对应。早期的物理化学教材也有把热力学第一定律写作△U=Q-W,这时,体积功计算公式前没有负号[3]。
我们知道,对于不可逆过程,环境的压力psurr和系统的压力psys不相等。为什么计算过程体积功的时候,要用环境压力psurr,而不是系统压力psys,或者系统与环境之间的压力差呢?对这个问题一直存在争议[4-10]。在教学实践中,学生对这个问题也普遍感到困惑。本文就这一问题做深入讨论。
1 一个令人困惑的问题

图1 绝热可逆过程的体积功
董玉林等[11]曾用如下例子,说明热力学中定义的体积功计算方法存在问题。如图1,在一个无限大刚性绝热的容器中,有一个无质量无摩擦的理想活塞将容器分隔成A、B两个部分。假设A内气体的压力为500 kPa,B内气体的压力为100 kPa。假设活塞在压力差的作用下向B气体一侧移动了一段距离,体积变量的绝对值为|△V|。由于容器无限大,由此造成A、B气体的压力变化忽略不计,无论以A或者以B作为系统,该过程都可以视为恒外压过程。若以A为系统,环境压力恒定为100 kPa,体积功WA=-100|△V|;若以B为系统,环境压力恒定为500 kPa,体积功WB=500|△V|。
根据体积功计算公式,对于同一个过程可以计算出两个不相等的体积功,笔者认为这是不合
另外,上述计算结果矛盾,也会导致与热力学第一定律的矛盾。对于上述绝热过程,不论设定A或者B为系统,系统的热力学能的变量可表示为△U=W。也就是说,若以A为系统,则有△UA=WA=-100|△V|;若以B为系统,则有△UB=WB=500|△V|。将A和B合起来视为一个孤立系统,应该有△U=△UA+△UB=0,但计算的结果显然不满足这一点。
2 体积功、热力学能和动能
为方便讨论,我们假设图1中活塞质量为m,没有摩擦。初始状态时活塞被固定在a点,速度为0。去掉固定装置,活塞在两侧压差的作用下向右侧运动,到达终点b时的运动速度为v。在这个过程中,气体A对活塞做功
WA=500|△V|,
则A气体热力学能减少了500|△V|,即
△UA=-500|△V|。
这个过程导致活塞动能的增加和B热力学能的增加。根据能量守恒,A热力学能的减少等于活塞动能的增量与B热力学能增量的和。由于活塞在a点的速度为0,在b点的速度为v,根据动能定理,合外力所做的功等于物体(活塞)动能的增量,则活塞动能增量为
1/2mv2=400|△V|
B气体对活塞做负功
WB=-100|△V| 则B气体热力学能增加了100|△V|,即
△UB=100|△V|
可以看出B气体增加的热力学能(100|△V|)小于A气体损失的热力学能(500|△V|),二者的差额就是活塞的动能400|△V|。由于热力学中通常不考虑动能,所以产生了上述看似违背能量守恒的结果。
3 动能转化为系统的热力学能
在热力学中,总是假设始态和终态都处于平衡态,也就是说始、终态的动能为0。因此在本例当中,有一个不言而喻的前提,即活塞到达b点时,将其动能400|△V|以某种方式转化成B或者A的热力学能,并停止在b点。
若以B为系统(A为环境),并假设活塞的动能在b点全部转化为系统的热力学能U(可以认为活塞是系统B的一部分),这时psurr=500 kPa,△V为负值。按照热力学对体积功的定义,
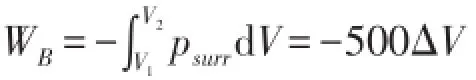
B的热力学能的实际变量应该包括两个部分,一是因系统压力所做负功导致的热力学能增加100|△V|;二是活塞动能转化导致内能增加400|△V|,因此,ΔUB=100||ΔV+400||ΔV=500||ΔV=-500ΔV,
显然有△UB=WB成立。
若以A为系统(B为环境),并假设活塞的动能在b点全部转化为了系统的热力学能(这时可以认为活塞是系统A的一部分)。这时psurr=100 kPa,△V为正值。按照热力学对体积功的定义,
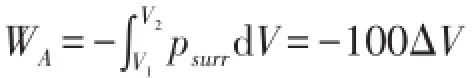
A的热力学能的实际变量也包括两个部分,一是因系统压力所做功导致的热力学能减少500|△V|;二是活塞动能转化导致系统内能增加400|△V|,因此,
ΔUA=-500|ΔV|+400|ΔV|=-100|ΔV|=-100ΔV
显然有△UA=WA成立。
如果我们假设活塞质量为0,可以把这部分动能理解为系统和环境边界处分子定向运动的动能,对上述结论的成立没有影响。
那么,活塞的动能是如何转化为A或者B的热力学能呢?答案应该不是唯一的。如前所述,不论我们是以A还是以B作为系统,活塞都被视为系统的一个部分,活塞的动能转化为系统的热力学能,其实是系统内不同形式能量的转化。可以想象,如果在b处有钉销,并将钉销也视为系统的一个部分。当活塞运动到b点时,与钉销发生碰撞后停止。这时,活塞的动能就转化为了活塞和钉销(即系统)的热力学能。
4 结论
做功的主体是力。不同的力在同一过程中所做的功不同是正常的。热力学中把环境压力所做功的负值定义为体积功,其实带入了一个不言而喻的假设:在终态的瞬间,系统与环境边界的动能全部转化为系统的热力学能。所谓系统,就是我们的研究对象,它可以不是一成不变的,但是只要假设边界动能全部转化为系统的热力学能,总能保证热力学第一定律的数学表达△U=Q+W成立,没有必要把体积功按照膨胀或者压缩分别定义不同的计算方法。
参考文献:
[1]傅献彩,沈文霞,姚天扬.物理化学(第五版)[M].北京:高等教育出版社,2005.
[2]印永嘉,奚正楷,张树永,等.物理化学简明教程(第四版)[M].北京:高等教育出版社,2007.
[3]傅献彩,沈文霞,姚天扬.物理化学(第四版)[M].北京:高等教育出版社,1990.
[4][11]董玉林,张联盟.非准静态过程体积功的定义及计算问题[J].武汉理工大学学报,2007,29(6):140-142.
[5]陈益山.物理化学辅导课教学改革实例:热力学第一定律的适用条件[J].曲靖师范学院学报,2013,32(6):22-24.
[6]李锦瑜,曾道刚,王国彦.关于体积功计算公式的讨论[J].云南教育学院学报,1994,10(5):99-100.
[7]Craig N C.Cislason E A Pressure Volume Integral Expression for Work in Irreversible Process[J].J Chen Educ. 2007,84:503-799.
[8]Kivelson D,Oppenheim I.Work in Irreversible Expansions[J].J Chem Educ,1966,43:233-235.
[9]Cislason E A,Craig N C.Cementing the Foundations of Thermodynamics:Comparison of System-based and Surround⁃ing-based Definition of Work and Heat[J].J Chem Thermodynamics,2005,37:954-966.
[10]Cislason E A,Craig N C.General Definition of Work and Heat in Thermodynamic Processes[J].J Chem Educ,1987,64:660-668.
中图分类号:O642.1
文献标识码:A
文章编号:1671-6469(2016)03-0106-03
收稿日期:2016-04-28
第一作者简介:李楠(1985—),女,回族,山东菏泽人,昌吉学院化学与应用化学系讲师,研究方向:催化剂的制备及应用。理的,并由此指出,当系统膨胀时,体积功计算应代入环境的压力,即;当系统被压缩时,体积功计算应代入系统的压力,即

