灰绿青霉阿魏酸酯酶的分离纯化和酶学性质研究
徐大伟,高兆建*,张铁柱,杨 杰,王东星,杜永凯
(1.徐州工程学院食品(生物)工程学院,江苏徐州 221000;2.江苏天种牧业股份有限公司,江苏徐州 221100;3.徐州鸿宇农业科技有限公司,江苏睢宁 221100)
灰绿青霉阿魏酸酯酶的分离纯化和酶学性质研究
徐大伟1,高兆建1*,张铁柱2,杨 杰3,王东星1,杜永凯1
(1.徐州工程学院食品(生物)工程学院,江苏徐州 221000;2.江苏天种牧业股份有限公司,江苏徐州 221100;3.徐州鸿宇农业科技有限公司,江苏睢宁 221100)
摘要[目的]研究青霉(Penicillium glaucum)XGY36胞外产阿魏酸酯酶的纯化和酶学性质。[方法]菌株胞外产酶发酵液经硫酸铵沉淀、DEAE-cellulose DE52离子交换柱层析、Sephadex-G75分子筛层析进行纯化,得到纯度较高的酶蛋白,并对其酶学性质进行研究。[结果]从菌株发酵液中分离纯化到电泳纯的阿魏酸酯酶,纯化倍数6.54,酶活性回收59.7%。阿魏酸酯酶经SDS-PAGE获得1个条带,其表观分子量为36.5 ku。催化底物阿魏酸乙酯的最适反应温度为50 ℃,最适pH为5.0。阿魏酸酯酶在60 ℃以下和pH 3.0~7.0范围内稳定。金属离子Zn2+、Mg2+、Ca2+对酶有明显的激活作用,而Pb2+、Hg2+和Ag+对阿魏酸酯酶有强烈的抑制作用,Na+、K+、Mn2+、Cu2+和Fe2+对酶活的影响不大。[结论]青霉阿魏酸酯酶具有潜在的应用价值,适合应用于食品、医药及生物等领域。
关键词灰绿青霉;阿魏酸酯酶;纯化;酶学性质
阿魏酸酯酶(Feruloyl esterase,FAE)[1],属于羧酸酯水解酶的一个亚类,是一种典型的肉桂酸酯酶。阿魏酸酯酶主要用于破坏阿魏酸与多糖相连的酯键[2],释放植物细胞壁中的阿魏酸[1],使剩余的多糖主链易被降解,有效提高了含有大量木质纤维素和阿魏酸的副产品的营养价值[3],在食品、饲料和造纸等工业中具有较好的应用前景[4]。目前,几种微生物已被证实能分泌阿魏酸酯酶,主要包括黑曲霉(Aspergillusniger)[5-6]、链霉菌(Streptomycesavermitilis)、泡盛曲霉(Aspergillusawamori)[7]、黄曲霉(Aspergillusflavus)[8]、构巢曲霉(Aspergillusnidulans)[9]、宇佐美曲霉(Aspergillususamii)[10]等。大多数的阿魏酸酯酶是从真菌中分离得到的。不同微生物分泌的阿魏酸酯酶在氨基酸序列、理化性质和催化功能上有所不同[11]。目前,关于高温稳定的阿魏酸酯酶的纯化和性质的研究则鲜见报道。笔者所在实验室前期从土壤样品中筛选到1株能够产耐热阿魏酸酯酶的青霉菌株XGY36。笔者对青霉发酵液中的阿魏酸酯酶进行分离与纯化,对其部分酶学性质进行了研究,旨在为阿魏酸酯酶在食品、饲料及造纸工业中的进一步应用提供理论基础。
1材料与方法
1.1材料
1.1.1菌种。菌株是从采集于徐州云龙山、托龙山和云龙湖公园等富含腐烂植物茎叶组织的土壤中筛选获得的,经鉴定确定为灰绿青霉(Penicilliumglaucum),命名为菌株XGY36。
1.1.2培养基。①斜面培养基(g/L):马铃薯葡萄糖琼脂(PDA)培养基,121 ℃灭菌20 min。②种子培养基:玉米粉20 g/L、豆饼粉30 g/L、KH2PO45 g/L、CaCl20.5 g/L,MgSO40.5 g/L,pH 6.5,121 ℃下蒸气灭菌15 min。③摇瓶发酵培养基:玉米粉20 g/L、豆饼粉30 g/L、麦麸15 g/L (粒径<0.05 mm)、葡萄糖10 g/L、酵母粉8 g/L、NH4NO33 g/L、Na2HPO4·7H2O20.5 g/L、CaCl22 g/L、MgSO4·7H2O 1 g/L、NaCl 1 g/L,pH 6.2,121 ℃下灭菌20 min。
1.2试剂与仪器
1.2.1试剂。DEAE-Cellulose DE52、Sephadex G-75,均为Amersham pharmacia公司产品;蛋白质低分子量Marker,购自TaKaRa公司;阿魏酸乙酯等其他常规试剂均为国产或进口分析纯。
1.2.2仪器。KTA Explorer 100/Explorer 10型蛋白质纯化系统为美国GE公司产品;Hoefer 2-D Electrophoresis电泳系统为美国HOEFER公司产品;SIGMA3K30型台式冷冻离心机德国Sigma公司产品;Agilent1100 series高效液相色谱仪为美国Agilent公司产品;CascadaTMAN型超纯水系统为美国PALL公司产品;Labscale TFF小型切向流超滤系统为美国Millipore公司产品;UV-2450紫外可见光分光光度计为日本岛津公司产品。
1.3方法
1.3.1阿魏酸酯酶粗酶液的制备。种子液培养温度28 ℃,摇床转速200 r/min,培养72 h后将培养好的菌液按10%的接种量接种于装有发酵培养基的摇瓶中,摇瓶容量500 mL,装量120 mL,培养温度30 ℃,摇床转速200 r/min,培养时间96 h。发酵结束后。发酵培养物在4 ℃下10 000 r/min离心20 min,取上清液作为粗酶液。
1.3.2酶的分离与纯化。将发酵液于6 000 r/min,离心20 min,收集上清液,添加硫酸铵至75%饱和度,4 ℃静置过夜,于8 000 r/min离心20 min,弃去上清,将沉淀溶解于0.01 mol/L PBS缓冲液(pH 6.5)中,继续对其彻底透析。透析脱盐后的粗酶液用 10 mmol/L的 Tris-HCl缓冲液调节pH至7.5后,上样于DEAE-Cellulose DE52 阴离子交换柱(2.5 cm× 20 cm)层析,上样后继续用10 mmol/L的Tris-HCl缓冲液(pH 7.5)洗脱未吸附的蛋白,再用含有0~1.0 mol/L的NaCl的Tris-HCl 缓冲液进行线性梯度洗脱,洗脱速度为0.5 mL/min,每管收集3 mL。测定收集管中溶液的酶活力。将有活性的部分合并,超滤浓缩后,样品上样于20 mmol/L Tris-HCl 缓冲液(pH7.5)平衡的Sephadex G-75 (1.6 cm × 90 cm)分子筛凝胶柱并洗脱,控制流速为0.5 mL/min。洗脱液经紫外检测并分部收集(3 mL/管),分别测定各收集管的酶活力,将有活性的部分合并,用于检测酶纯度及研究其酶学性质。
1.3.3酶活性检测。参照陈锦等[12]的方法测定阿魏酸酯酶活力。取0.1 mL经适当稀释的酶液,加入500 μL pH 5.0的Na2HPO4-柠檬酸缓冲溶液配制的阿魏酸乙酯溶液,在50 ℃水浴保温15 min后加入500 μL 10%冰乙酸(V/V)终止酶促反应。先在酶溶液中加入1 mL冰乙酸溶液,再加入底物溶液,将其作为空白对照。采用HPLC法测定其阿魏酸含量。在50 ℃、pH 5.0条件下,每分钟水解阿魏酸乙酯,生成1 μmol阿魏酸所需酶量定义为1个酶活力单位。高效液相色谱条件如下:C18色谱柱(150 mm×4.6 mm,5 μm),流动相为1%醋酸水溶液/甲醇(72∶28),柱温40 ℃,检测波长320 nm,进样量10 μL,流速1 mL/min。按上述色谱条件,每个样品连续测定3次,取峰面积平均值,计算阿魏酸含量。
1.3.4蛋白浓度测定。蛋白浓度测定采用考马斯亮蓝G-250染色法(Bradford法),用牛血清白蛋白制作标准曲线,对蛋白浓度进行定量。
1.3.5SDS-PAGE测定蛋白质分子量。参照Laemmli[13]的方法进行SDS-PAGE,分离胶浓度12%,浓缩胶浓度5%。将样品和标准蛋白[兔磷酸化酶B (97 400 u)、牛血清白蛋白(66 200 u)、兔肌动蛋白(45 000 u)、牛碳酸酐酶(31 000 u)、胰蛋白酶抑制剂(21 500 u)、鸡蛋清溶菌酶(14 400 u)]进行SDS-PAGE,然后以相对迁移率对分子量绘图,计算出该蛋白酶的分子量。
1.3.6阿魏酸酯酶性质研究。
1.3.6.1酶反应的最适温度和热稳定性。在0.02 mol/L的Na2HPO4-柠檬酸缓冲溶液(pH 5.0)中,不同温度(30~80 ℃)下进行酶促反应,确定酶反应的最适温度。热稳定性测定是将酶分别置于不同温度(40~80 ℃)下保温4 h,每隔1 h检测1次酶活,以未经过热保温的酶液为空白对照(100%),检测酶的热稳定性。
1.3.6.2酶反应的最适pH和酸碱稳定性。阿魏酸酯酶在不同pH(3.0~8.0)下进行酶促反应,测定其最适pH。测定pH稳定性是将酶液加入到20 mmol/L的不同pH缓冲液中,再在40 ℃下保温1 h,测定剩余阿魏酸酯酶的活性。所用缓冲液为pH 3.0~6.0,磷酸氢二钠-柠檬酸缓冲液、pH 6.0~7.5的磷酸氢二钠-磷酸二氢钠缓冲液和pH 8.0~8.5的Tris-HCl缓冲液。
1.3.6.3金属离子对酶活性的影响。取经适当稀释的酶液,向其中分别加入用蒸馏水配制的金属盐溶液(Na+、K+、Mg2+、Fe2+、Ca2+、Zn2+、Cu2+、Hg2+、Pb2+),使金属离子终浓度达到5 mmol/L,40 ℃下保温1 h后,按照标准方法测定残余酶活。以上均以不添加金属离子的酶液为空白对照(100%)。
2结果与分析
2.1离子交换柱层析纯化将经过硫酸铵盐析、透析脱盐后初步纯化的蛋白样品过DEAE-Cellulose DE52柱进一步分离纯化。条件优化后,当pH为7.5时,采用阴离子交换层析柱对目标蛋白实现了较好分离。从图1可以看出,样品经过阴离子交换层析,随着洗脱NaCl浓度的逐渐增加,洗脱出多个蛋白峰。经酶活测定发现,酶活主要集中在55~70号收集管,但与对照蛋白洗脱峰相比,酶活集中区域与蛋白洗脱峰不完全重合,说明酶活收集管中还有杂蛋白。合并有活性的收集管,采用小型切向流超滤系统超滤浓缩进一步纯化。

图1 DEAE-Cellulose DE52阴离子交换层析洗脱曲线Fig.1 Chromatography of protein by DEAE-Cellulose DE52
2.2分子筛凝胶过滤层析采用分子筛层析方法对合并的活性收集管蛋白进一步纯化。选择Sephadex G-75色谱柱,经条件优化后得到较为理想的分离效果。从图2可以看出,经分离得到3个完全独立的洗脱峰,经蛋白浓度测定,洗脱后蛋白集中在峰1和峰3,峰2为非蛋白峰。对峰1和峰3进行酶活测定,结果表明峰3(42~48号管)表现出强的阿魏酸酯酶活性,活性峰同蛋白峰完全对应。
从表1可以看出,经过硫酸铵沉淀、超滤、离子交换柱层析、分子筛凝胶过滤层析,酶的比活力从最初的11.22 mU/mg提高到466.42 mU/mg,纯化了41.57倍,活性回收率为32.18%。将纯化的酶冻干脱水后在-4 ℃下保存下,储存6个月活性无明显变化。
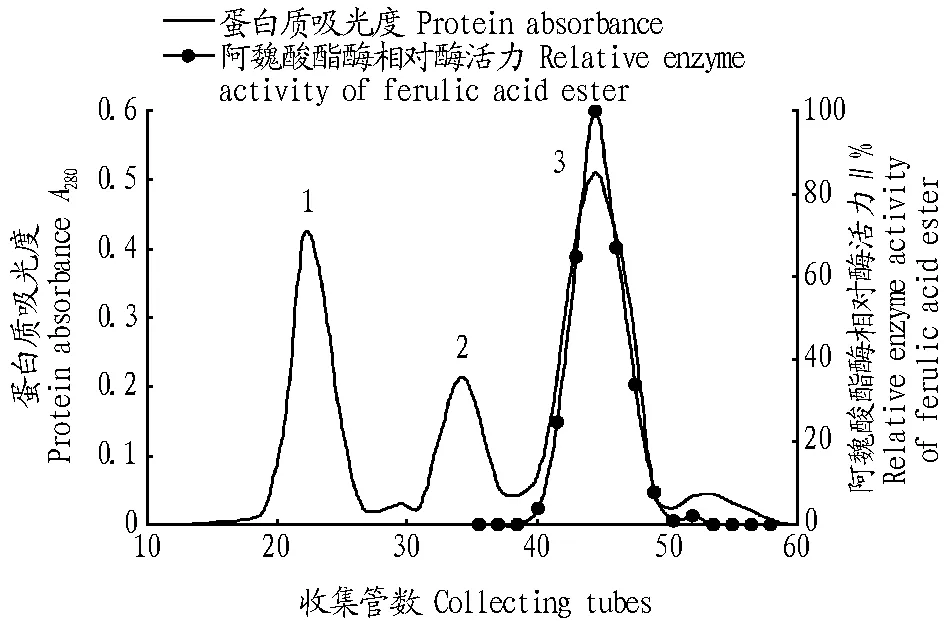
图2 Sephadex G-75凝胶柱洗脱曲线Fig.2 Chromatography of protein by Sephadex G-75
2.3阿魏酸酯酶纯度和分子量测定采用SDS-PAGE分别测定硫酸铵盐析、DEAE-Cellulose DE52阴离子交换层析、Sephadex G-75分子筛凝胶层析法纯化后的粗酶纯度和分子量。从图3可以看出,仅经过硫酸铵盐析和透析纯化的粗酶液含有大量的蛋白条带,经DEAE-Cellulose DE52分离后去除了大量杂蛋白,获得约8条组分带,进一步经Sephadex G-75色谱柱分离后的酶液仅有1条蛋白条带,说明发酵液经过以上一系列纯化后已获得纯度较高的阿魏酸酯酶。经计算,阿魏酸酯酶的分子质量约为36.5 ku。该酶的分子质量偏小,这可能与不同菌株所产的阿魏酸酯酶在分子结构和组成方面存在差异有关。

表1 灰绿青霉XGY36阿魏酸酯酶的分离与纯化

注:1.低分子量标准蛋白;2.经硫酸铵盐析后的粗酶液;3.经硫酸铵盐析、DEAE-Cellulose DE52阴离子交换层析后的粗酶液;4.经硫酸铵盐析、DEAE-Cellulose DE52阴离子交换层析、Sephadex G-75分子筛凝胶过滤层析后的酶液。 Note:1.Low molecular weight standard protein; 2.The crude enzyme liquid after a mmonium sulfate precipitation; 3.The crude enzyme liquid after a mmonium sulfate precipitation,DEAE-Cellulose DE52 anion exchange chromatography; 4.The crude enzyme liquid after a mmonium sulfate precipitation,DEAE-Cellulose DE52 anion exchange chromatography,Sephadex G-75 molecular sieve gel filtration.图3 阿魏酸酯酶纯化过程的SDS-PAGE图谱Fig.3 SDS-PAGE results of proteins during the purification of ferulic acid esterase
2.4阿魏酸酯酶的酶学性质研究
2.4.1最佳反应温度。从图4可以看出,在30~50 ℃范围内,阿魏酸含量随着反应温度的升高而增加,说明随着温度的升高,阿魏酸酯酶酶活力增加,降解阿魏酸乙酯产生的阿魏酸含量也增加。当反应温度为50 ℃时,阿魏酸含量达到最大值。此后,温度进一步升高,由于阿魏酸酯酶分子开始变性失活,所以阿魏酸含量降低,随着温度的升高而下降。因此,确定该酶降解反应的最佳温度为50 ℃。

图4 阿魏酸酯酶的最适反应温度Fig.4 The optimal temperature of ferulic acid esterase

图5 温度对阿魏酸酯酶稳定性的影响Fig.5 Effects of temperature on stability of ferulic acid esterase
2.4.2不同温度对阿魏酸酯酶稳定性的影响。从图5可以看出,40 ℃下保温4 h后酶活力几乎没有变化;50 ℃下保温2 h后剩余酶活在90%以上;60和70 ℃下保温2 h后剩余酶活约为80%;在70和80 ℃下保温2 h相对酶活仍保持70%以上;80 ℃下保温3 h,酶活保持50%以上。该试验结果表明该阿魏酸酯酶在60 ℃以下具有良好的热稳定性。2.4.3pH对阿魏酸酯酶活性的影响。
2.4.3.1最佳反应pH。从图6可以看出,当反应液的pH为3.0~5.0时,阿魏酸含量随着pH的升高而逐渐增加。当pH为5.0,阿魏酸含量达到最大值。当反应液的pH超过5.0时,阿魏酸酯酶的活力逐渐降低;当pH超过6.5时,阿魏酸酯酶酶活力大幅降低。这也说明碱性条件不利于催化降解反应。阿魏酸酯酶催化阿魏酸乙酯制备阿魏酸的最适反应pH为5.0。
2.4.3.2阿魏酸酯酶的酸碱稳定性。将纯化后的酶液用不同pH的缓冲液配制,于室温下处理4 h,测定其剩余酶活力。从图6可以看出,在pH 3.0~3.5范围内酶活呈上升趋势,当pH为3.5~6.5,酶活性几乎没有变化;当pH超过6.5时,酶活力呈逐渐下降趋势。整体来看,在pH3.5~6.5范围内酶活力比较稳定,保温4 h后阿魏酸酯酶的剩余活力仍在90%以上,表明该酶在酸性环境下有较强的耐受力。
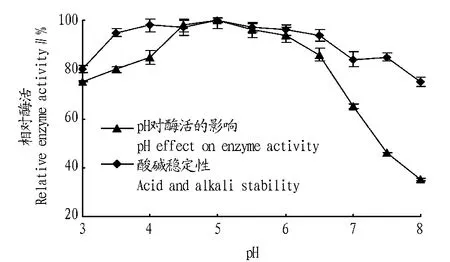
图6 阿魏酸酯酶的最适反应pH及其pH稳定性Fig.6 Optimal pH and pH stability of ferulic acid esterase
2.4.3.3常见金属离子对阿魏酸酯酶活性的影响。在阿魏酸酯酶中加入各种金属离子并保持离子浓度为5 mmol/L,同时以不添加金属离子的酶液为对照,测定阿魏酸酯酶活性。由表2可知,Zn2+、Mg2+、Ca2+对阿魏酸酯酶具有一定的激活作用,Pb2+、Hg2+和Ag+对阿魏酸酯酶有强烈的抑制作用,其他一些金属离子(如Na+、K+、Mn2+、Cu2+、Fe2+等)对阿魏酸酯酶活性没有显著影响,说明阿魏酸酯酶与大部分金属离子都有良好的配伍性能。
表2各种金属离子对阿魏酸酯酶活性的影响
Table 2Effect of various metal ions on the ferulic acid esterase activity

试剂Reagent浓度Concentrationmmol/L相对酶活Relativeenzymeactivity∥%--100.0±3.1Na+5102.0±1.5K+5100.0±2.6Mg2+5128.0±6.4Ca2+5135.0±2.4Mn2+578.0±3.8Fe2+591.0±2.9Cu2+580.0±3.6Zn2+5114.0±4.8Hg2+534.0±1.6Pb2+527.0±4.4Ag+544.0±1.5
3结论
该研究建立了从灰绿青霉(Penicilliumglaucum)发酵液中获取阿魏酸酯酶的纯化方法。该试验结果表明,发酵液经过硫酸铵沉淀预处理、阴离子交换层析以及分子筛层析纯化等,最终获得了纯度较高的阿魏酸酯酶。该酶分子量36.5 ku,最终纯化41.57倍。该研究提纯的GOD的最适pH为5.0,酶在pH3.0~7.0范围内较稳定,其pH稳定范围较宽,主要在酸性环境下,由此可见该阿魏酸酯酶特别适合在饲料中使用,在动物胃的酸性环境下一直保持高活性,可以有效将富纤维饲料充分降解。此外,酶的最适温度为50 ℃,在80 ℃下保温2 h仍保存有70%以上的酶活力,说明此酶的热稳定性很好,可高温应用。在饲料、食品等工业上应用阿魏酸酯酶时,其热稳定性相当重要,特别是在食品灭菌消毒以及饲料的高温造粒中该酶可以保持高稳定性。因此,阿魏酸酯酶在工业中有潜在的应用价值。
参考文献
[1] YANG S,TANG L,YAN Q,et al.Biochemical characteristics and gene cloning of a novel thermostable feruloyl esterase fromChaetomiumsp.[J].Journal of molecular catalysis B:Enzymatic,2013,97:328-336.
[2] 方园,欧仕益,张宁.阿魏酸酯酶的制备及其酶学性质[J].暨南大学学报(自然科学与医学版),2012(5):481-485.
[3] GOPALAN N,RODRGUEZ-DURAN LV,SAUCEDO-CASTANEDA G,et al.Review on technological and scientific aspects of feruloyl esterases:A versatile enzyme for biorefining of biomass[J].Bioresource technology,2015,193:534-544.
[4] LIU Q,ZHOU D Y,CHEN L,et al.Effects of feruloyl esterase,non-starch polysaccharide degrading enzymes,phytase,and their combinations on in vitro degradation of rice bran and nutrient digestibility of rice bran based diets in adult cockerels[J].Livestock science,2015,178:255-262.
[5] ZENG W,CHEN H Z.Air pressure pulsation solid state fermentation of feruloyl esterase byAspergillusniger[J].Bioresource technology,2009,100(3):1371-1375.
[6] 徐腾洋,方若思,董亚晨,等.黑曲霉XTY液体深层发酵产阿魏酸酯酶的培养基优化研究[J].中国食品学报,2013(6):111-116.
[7] FAZARY A E,ISMADJI S,JU Y.Stability and solubility studies of native and activatedAspergillusawamoriferuloyl esterase[J].Journal of molecular catalysis B:Enzymatic,2009,59(1/2/3):190-196.
[8] ZHANG S,ZHAI H,WANG L,et al.Expression,purification and characterization of a feruloyl esterase A fromAspergillusflavus[J].Protein expression and purification,2013,92(1):36-40.
[9] DEBEIRE P,KHOUNE P,JELTSCH J,et al.Product patterns of a feruloyl esterase fromAspergillusnidulanson large feruloyl-arabino-xylo-oligosaccharides from wheat bran[J].Bioresource technology,2012,119:425-428.
[10] 龚燕燕,殷欣,邬敏辰,等.宇佐美曲霉阿魏酸酯酶A基因的克隆表达及酶学性质研究[J].食品与生物技术学报,2013(7):706-712.
[11] 李夏兰,范韵敏,方柏山.来自桔青霉的阿魏酸酯酶的分离纯化、理化性质[J].微生物学报,2010(8):1058-1064.
[12] 陈锦,胡茂丰,吴章华,等.高产阿魏酸酯酶菌株的筛选及其产酶条件优化[J].食品工业科技,2015(8):218-221.
[13] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:68012-68015.
基金项目大学生创新创业基金项目(201311998053Y);徐州市科技计划项目(XF13C011,XF13C027)。
作者简介徐大伟(1989- ),男,江苏连云港人,本科生,专业:生物工程。*通讯作者,副教授,博士,从事食品生物技术。
收稿日期2016-04-13
中图分类号Q 81
文献标识码A
文章编号0517-6611(2016)15-024-04
Study on Separation,Purification and Enzymatic Properties of Ferulic Acid Esterase fromPenicilliumglaucum
XU Da-wei1,GAO Zhao-jian1*,ZHANG Tie-zhu2et al
(1.College of Food (Biological) Engineering,Xuzhou Institute of Technology,Xuzhou,Jiangsu 221000; 2.Jiangsu Tianzhong Pasture Farming Co.Ltd.,Xuzhou,Jiangsu 221000)
Abstract[Objective] The aim was to study purification and enzymatic properties of feruloyl esterase in the culture solution of Penicillium glaucum XGY36.[Method] The feruloyl esterase was obtained in the culture solution of Penicillium glaucum XGY36 and was purified to be homogeneous by the steps of ammonium sulfate precipitation,DEAE-cellulose DE52 chromatographies,and Sephadex G-75 chromatography.The enzyme protein with high purity was obtained,enzymatic properties were studied.[Result] Purification of about 6.54 fold was achieved with an overall yield of 59.7%.The molecular weight of purified feruloyl esterase was estimated to be about 36.5 ku by SDS-PAGE.The optimum temperature and pH of the enzyme activity were 50 ℃ and 5.0,respectively in catalytic reaction of ethyl ferulate.The enzyme activity was stable under 60 ℃,and with pH range of 3.0-7.0.The activity of feruloyl esterase was highly enhanced by Zn2+,Mg2+and Ca2+,whereas it was strongly inhibited by the metal ions Pb2+,Hg2+and Ag+,while Na+,K+,Mn2+,Cu2+and Fe2+had no strong effect on feruloyl esterase activity.[Conclusion] Feruloyl esterase has potential applied value and fit to apply in the fields of food,medicine and biology etc..
Key wordsPenicillium glaucum; Ferulic acid esterase; Purification; Enzymatic properties

