PLT- F计数低值血小板的准确性评价
陈娟,董晶,彭赛辉,吴志成
(北京大学深圳医院检验科,广东 深圳518036)
·综述·
PLT- F计数低值血小板的准确性评价
陈娟,董晶,彭赛辉,吴志成
(北京大学深圳医院检验科,广东深圳518036)
摘要:目的探讨Sysmex XN-9000全自动血细胞分析仪PLT-F通道在低值血小板测定中的临床意义。方法采用Sysmex XN-9000全自动血细胞分析仪的3种方法电阻抗法(PLT-I)、光学法(PLT-O)、荧光核酸染色法(PLT-F)进行血小板计数,从精密度、低值血小板及红细胞碎片干扰评价,并与使用抗CD61抗体的流式细胞术检测结果进行比较。结果与电阻抗法(PLT-I)、光学法(PLT-O)相比,荧光核酸染色法(PLT-F)的重复性最好,精确度较高;在红细胞碎片干扰实验中,PLT-F具有较强的抗干扰能力(高、低浓度组P>0.05),PLT-O次之(高浓度组P<0.01,低浓度组P>0.05);低值血小板相关分析结果显示3种方法都得到良好的相关性,PLT-F法的准确性较高,尤其在低值血小板计数中。结论临床常规标本可以使用Sysmex XN-9000全自动血液分析仪的PLT-I法检测,当标本血小板数目异常或溶血时,建议使用PLT-O法或PLT-F法复查,必要时采用镜检法或流式细胞术。
关键词:血小板计数;荧光核酸染色法;流式细胞术;低值血小板
血小板(platelet,PLT)是由骨髓造血组织中的巨核细胞产生,呈两面微凸的圆盘状或椭圆形小体,直径只有1.5~3μm,具有维持血管内皮完整性以及黏附、聚集、释放、促凝和血块收缩等功能,而血小板计数(platelet count)是测定单位容积的血液中血小板的数量[1]。临床上血小板计数常使用血液分析仪、显微镜或流式细胞仪进行检测,但血小板由于体积小,容易发生黏附、聚集和变性破坏,而且不易与其它非血小板小颗粒区别,所以手工计数方法常难以准确计数。在日常检测工作中主要使用血液分析仪进行血小板计数,常利用电阻抗法对血小板进行定量检测,其优点是重复性好、检测速度快、成本低,但易受小红细胞、碎片红细胞、大血小板等影响,使结果偏高或偏低,所以当仪器检测报告显示血小板数量、图形异常或报警提示时,应使用显微镜或流式细胞仪法对血小板计数结果进行复核[2],而国际血液学标准化委员会(ICSH)推荐的参考方法是应用流式细胞术检测血小板计数[3]。为评价临床血小板计数准确性,我们使用SYSMEX XN全自动血细胞分析仪的电阻抗法(PLT-I)、光学法(PLT-O)、荧光核酸染色法(PLTF)分别对正常对照组、大血小板组、小红细胞干扰组以及红细胞碎片干扰组的临床标本进行计数,并以流式细胞仪为参考标准,对检测结果进行统计学处理。
1 材料与方法
1.1标本来源收集北京大学深圳医院2015年1月至3月血小板计数≤50×109/L的EDTA抗凝全血标本26例,其中男性11例,女性14例,平均年龄36.3±22.5岁,显微镜下观察无血小板聚集,无碎片红细胞增多(<1.0%)。正常对照组按照中华人民共和国卫生行业标准WS/T405-2012《血细胞参考区间》参考个体选择,两组年龄和性别差异无统计学意义。
1.2仪器与试剂仪器为日本SysmexXN-9000全自动血液分析仪。美国贝克曼Navios AV40310流式细胞仪。美国Beckman-Coulter公司Z2细胞计数仪(简称Z2)。SysmexXN-9000仪器使用的质控品、试剂均为日本Sysmex公司生产的原装配套试剂。美国Beckman-Coulter公司生产的抗CD61单抗(Phycoerythrin PE)。
1.3检测方法
1.3.1收集全血标本分别在XN-9000血液分析仪上CDC检测通道/WPC检测通道检测血小板,同时在美国Beckman-Coulter公司Z2细胞计数仪计数RBC数,贝克曼Navios流式细胞仪检测血小板表面糖蛋白CD61。
1.3.2PLT计数用ICSH推荐的PLT/RBC比值法[3]作为血小板计数的参考方法。取混匀的新鲜血5μl,加荧光素标记物抗CD61单抗5μl,混匀并静置15min,再加人4.99mlPBS(pH7.2的磷酸盐缓冲液),混匀,以贝克曼Navios流式细胞仪检测RBC/ PLT比率,将结果乘以Z2检测所得RBC数,即得PLT数。
1.4统计学方法采用SPSS 19.0统计软件及Microsoft Office Excel2007进行数据处理分析。
2 结果
2.1低值血小板批内精密度检测用XN-9000血液分析仪PLT-I,PLT-O,PLT-F通道分别检测3例低值血小板及正常血小板3例,按常规检测方法分别各检测11次,计数后10次检测结果平均值、标准差及变异系数。见表1。
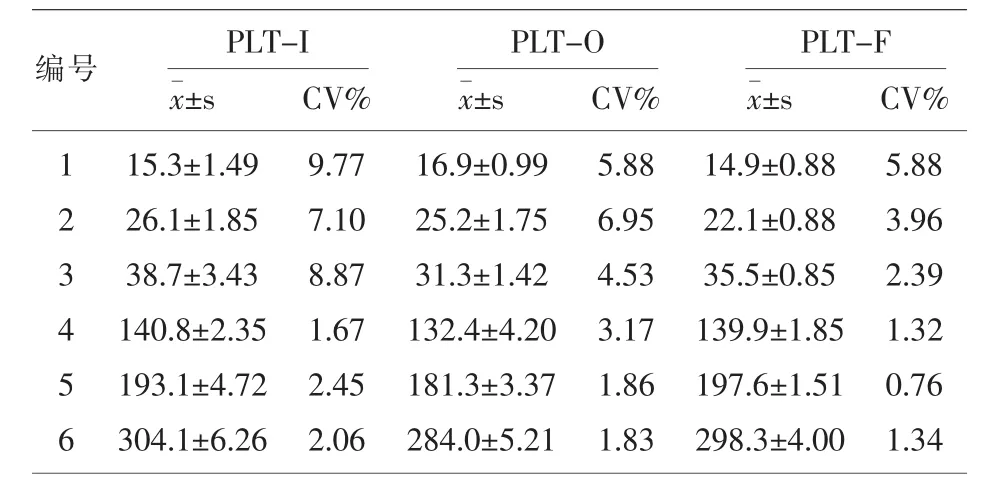
表1 血小板批内精密度比较(×109/L n=10)
从表1可以看出PLT-I通道平均变异系数为5.32%,PLT-O通道平均变异系数为4.04%,PLT-F通道平均变异系数为2.61%,其中低值血小板的变异系数分别为:8.58%(PLT-I),5.79%(PLT-O),4.08%(PLT-F)。
2.2低值血小板检测收集血小板计数(PLT-F)≤50×109/L的EDTA抗凝全血标本26例,分别用PLT-I、PLT-0、PLT-F方法对其血小板测定,采用FCM PLT/RBC比值法检测结果作为参照,与上述三种方法进行比较,见图1~图3。
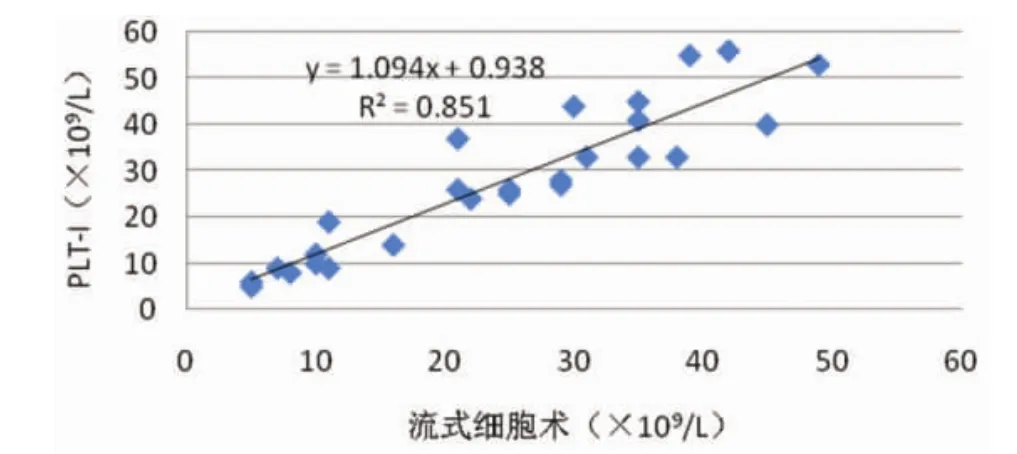
图1 PLT-I与流式细胞术比较
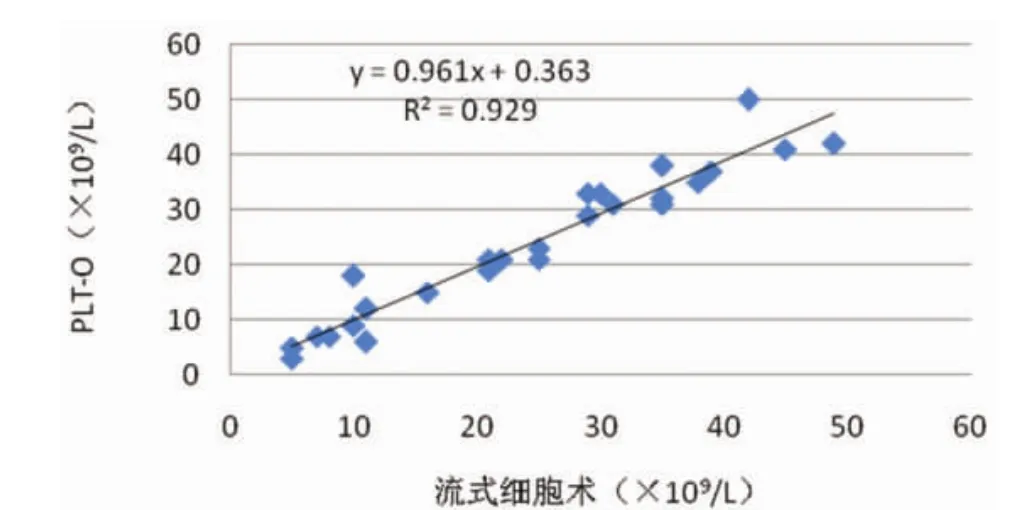
图2 PLT-0与流式细胞术比较
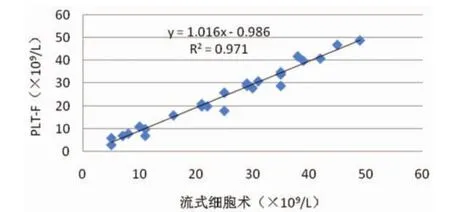
图3 PLT-F与流式细胞术比较
2.3碎片红细胞干扰试验[4,5]取1份正常人EDTA抗凝血样分装4管(每管800μl),将第1管3600r/ min离心5min后,取压积红细胞层100μl,加入蒸馏水振荡摇匀后,3600r/min离心5min,留取底层红细胞碎片,用生理盐水洗涤3次后稀释至200μl,取上述红细胞碎片悬液80μl,加入第2管血样中,作为高碎片浓度干扰组,再将剩下红细胞碎片悬液120μl加生理盐水至1ml,取80μl加入第3管中,作为低碎片干扰组。将第4管加入80μl生理盐水作为对照组。用PLT-I、PLT-0、PLT-F方法对上述第2、3、4管PLT进行检测(检测2次),以第2、3 管PLT测定值与第4管PLT测定值作配对t检验(n=10)。见表2。
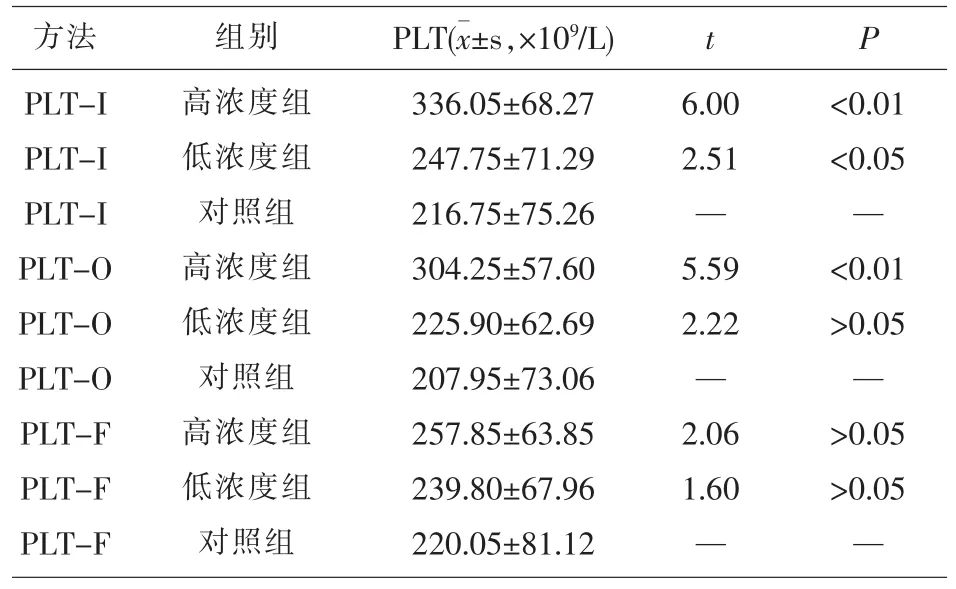
表2 红细胞碎片干扰试验结果(n=10)
从表2可以看出使用SYSMEX XN全自动血细胞分析仪测定血小板的结果分别与自身对照组作配对t检验。由表4可以看出电阻抗法(PLT-I)易受到红细胞碎片的干扰(高浓度组P<0.01,低浓度组P<0.05),而光学法(PLT-O)有一定的抗红细胞碎片的干扰能力(高浓度组P<0.01,低浓度组P> 0.05),荧光核酸染色法(PLT-F)则有较强的抗红细胞碎片干扰能力,不易受到血液中非血小板小颗粒影响[6]。
3 讨论
血小板疾病是由于血小板数量减少或功能减退导致止血栓形成不良和出血而引起的。血小板减少症可能源于血小板产生不足,脾脏对血小板的阻留,血小板破坏或利用增加以及被稀释,无论何种原因所致的严重血小板减少,都可引起典型的出血。因此血小板计数是临床常用的检验项目之一,其结果的准确性对于血栓性疾病和出血性疾病的诊断与治疗起着决定性作用,特别低值血小板计数准确性一直是医学检验和临床关注的问题,当血小板<50×109/L患者出血风险大大增加,临床症状可表现为出血,如鼻、齿龈、黏膜自发性出血等,应引起临床医生高度重视[7],当血小板计数< 20×109/L,一般认为应进行预防性血小板输血[8,9]。
目前血小板计数多使用各类血液分析仪完成,其计数原理多为经典的电阻抗法,但此方法受到的影响因素较多,目前认为影响因素主要为大血小板及小红细胞、小血小板、血小板体积差异过大等[10-12]。为了保证血小板计数结果的准确性,Sysmex XN血液细胞分析仪可以采用电阻抗法,光学法和荧光核酸染色法三种方法对血小板进行检测。阻抗法根据颗粒体积大小通过小孔时产生的脉冲信号不同来区别和计数血小板,而光学法和荧光核酸染色法采用了流式细胞术原理,根据对血小板核酸成份的荧光染色,测定荧光强度来计数血小板,消除了小红细胞或红细胞碎片的干扰[13],其中光学血小板法使用聚甲烯次甲基荧光染料对血小板的核酸成份进行荧光染色,通过网织红通道RET进行测量,利用表达细胞大小的前向散射光FSC和表达核酸浓度的侧向荧光SFL来识别血小板。因血小板体积较红细胞小,分布在红细胞下方,血小板内含极少量的核酸,侧向荧光的强度较成熟红细胞稍大,因此能有效区分红细胞和血小板。而荧光核酸染色法(PLT-F)较光学法(PLTO)多增加3倍PLT计数量,并针对血小板内内质网、线粒体进行嗪染料荧光染色,使血小板和碎片红细胞间荧光强度差异变得更大,提高仪器辨别能力,减少非血小板颗粒干扰,通过血小板碎片干扰试验可知荧光核酸染色法(PLT-F)有较强的抗红细胞碎片干扰能力,不易受到血液中非血小板小颗粒影响,能准确检测血小板计数。
血液分析仪一般采用浮动界标技术等来保证血小板计数的准确性,在一般情况下仪器可以区分血小板和红细胞。但当血小板形态异常时,由于其形态不典型,直方图易与红细胞直方图重叠,仪器不能进行准确计数[14],此时应使用显微镜或流式细胞仪法对血小板计数结果进行复核[15]。但实际应用中由于光学法及荧光核酸染色法(PLT-F)成本较高,常规检测工作中习惯使用阻抗法,当出现血小板计数<80×109/L、血小板直方图异常、碎片红细胞、小红细胞及血小板聚集时,可使用光学法(PLT-O)或荧光核酸染色法(PLT-F)对血小板计数行进复检,必要时涂片进行镜检。而国际血液学标准化委员会(ICSH)推荐的流式细胞术检测血小板计数因费时成本高,标本保留时间短,且需要专业技术人员操作,常规血小板检测工作中较少使用,一般应用于有条件临床实验室建立PLT参考方法并用于评价其它PLT计数方法[16]。
参考文献
[1]刘成玉,罗春丽.临床检验基础[M].第5版.北京:人民卫生出版社,2014:67-70.
[2]尚红,王毓三,申子瑜.全国临床检验操作规程[M].第4版.北京:人民卫生出版社,2015:14-16.
[3]ICSH,ISLH. Platelet counting by the RBC/PLT ratio method -A reference method[J]. Am J Clin Pathol,2001,115(3):460-464.
[4]刘纹,郑圻,刘晓敏. SYSMEX XE-5000血细胞分析仪血小板计数性能评价分析[J].检验医学与临床,2011,20(8):2492-2493.
[5]张琴,廖扬,石玉玲. Sysmex XN-3000全自动血细胞分析仪血小板计数性能评价分析[J].生物技术通讯,2014,25(4):550-553.
[6]陈言伟,王朝鑫.光学法检测大血小板的临床应用价值分析[J].实验与检验医学,2014,32(5):643-644.
[7]刘秋莲,陈尚龙,刘海云,等. 561例血小板减少患者骨髓象分析[J].实验与检验医学,2015,33(5):630-631.
[8]王建中,屈晨雪.三种流式细胞术计数血小板方法的比较研究[J].中华检验医学杂志,2003,26(1):8-12.
[9]农荣欣.假性血小板危急值报告分析[J].实验与检验医学,2013,31(4):349-350.
[10]林顺宝,郑德柱,刘文星,等.血小板检测及临床意义探讨[J].临床检验杂志,2003,21(1):17-18.
[11]佟爱华,赵利,李康,等.血液细胞分析仪与流式参考方法测定低值血小板样本的比较研究[J].军医进修学院学报,2011,32 (10):995-997.
[12]刘非,高秀蓉,曾兰兰,等.大血小板影响光学法与电阻抗法血小板计数差异的比较分析[J].国际检验医学杂志,2014,35 (13):1766-1769.
[13]熊仲波,金孝燕,陆波,等.Sysmex XN-9000全自动血细胞分析仪性能评价[J].国际检验医学杂志,2015,36(10):1373-1375.
[14]郭玉娥,赵洪泉,赵志明.血细胞分析仪计数血小板的影响因素[J].中国误诊学杂志,2006,5(1):152-154.
[15]丛玉隆,乐家新.现代血细胞分析技术与临床[M].北京:人民军医出版社,2005:102-115.
[16]聂李平,彭黎明,蒋能刚.血小板计数参考方法的建立及应用研究[J].中国实验诊断学,2007,11(8):1087-1090.
·实验研究·
中图分类号:R446.11+1
文献标识码:A
文章编号:1674-1129(2016)03-0288-03
DOI:10.3969/j.issn.1674-1129.2016.03.010
基金项目:北京大学深圳医院种子基金项目(编号:2015021)
作者简介:陈娟,女,1980年5月生,医学学士,主管技师,主要从事临床医学检验工作,wwwwzch@sohu.com。
(收稿日期2016-04-25;修回日期2016-05-16)
Accuracy evaluation of PLT - F method on low concentration of platelet counting
CHEN Juan,DONG Jing,PENG Saihui,WU Zhicheng. Department of Clinical Laboratory,Peking University Shenzhen Hospital,Guangdong Shenzhen 518036,China.
Abstract:Objective To evaluate the accuracy of PLT-F channel on low platelet counting in the SysmexXN-9000 automated hematology analyzer. Methods Blood samples with low platelet concentration or those mixed with erythrocyte fragments were detected with SysmexXN-9000 automated hematology analyzer using three platelet count methods:PLT-F,PLT-I,and PLT-O. As comparison,the samples were labeled with CD61 antibody,and analyzed using flow cytometry. Results PLT-F method showed higher reproducibility and accuracy in comparison with PLT-I method and PLT-O method. Platelet count by PLT-F method were less affected by erythrocyte fragments than that by PLT-O method. There was a better correlation between the PLT-F system and the immunological reference method,despite of samples with low platelet concentration. Conclusions This study revealed that PLT-I method can accurately count platelets in the clinical routine blood samples. However,blood samples with low platelet concentration or those containing erythrocyte fragment should be reviewed by PLT-O or PLT-F methods,even by microscopy or flow cytometry if necessary.
Key words:Platelet counting;PLT-F;Flow cytometry;Low platelet

