冻存复苏对脐带间充质干细胞生物学特性的影响
韩 华,赵 静,赵红伟,李 洁,闫 萍
(河北省人民医院,河北 石家庄 050051)
冻存复苏对脐带间充质干细胞生物学特性的影响
韩华,赵静,赵红伟,李洁,闫萍
(河北省人民医院,河北 石家庄 050051)

[摘要]目的观察脐带间充质干细胞经冻存复苏后的生物学特性,并鉴定其是否具有间充质干细胞的特征。方法采用组织块贴壁法从人脐带组织中分离培养间充质干细胞,将传至第3代的细胞进行冻存6个月后复苏,观察冻存前和冻存复苏后细胞的形态学变化,比较冻存前后细胞的存活率,测定细胞生长曲线,并用流式细胞仪检测冻存后细胞表面抗原的表达情况。结果组织块贴壁法可以成功地分离培养脐带间充质干细胞;经低温冻存复苏后细胞仍保持贴壁生长的特性,形态未发生明显变化;复苏后细胞存活率与未冻存细胞相比差异无统计学意义;冻存前后细胞的生长曲线相似;流式细胞仪分析冻存后细胞表面高表达间充质干细胞抗原CD29、CD90、CD44、CD105,低表达或不表达造血干细胞抗原CD34、CD45和白细胞相关抗原HLA-DR。结论冻存复苏对脐带间充质干细胞的生物学特性无明显影响,冻存后细胞符合间充质干细胞的基本要求。
[关键词]间充质干细胞;脐带;冻存;生物学特性
间充质干细胞(mesenchymal stem cells, MSCs)是一种重要的种子细胞,具有高度自我更新和多向分化潜能,能够支持造血和调节免疫功能[1-2],并且在特定的条件下,可以诱导分化成骨、软骨、脂肪、心肌、骨骼肌等多种组织细胞[3-4],能广泛应用于组织工程研究以及临床各种疾病的治疗[5]。间充质干细胞的来源广泛,最早是从骨髓中发现,后经研究证实在脂肪、肌肉、外周血、脐血、脐带等组织中均存在间充质干细胞[6]。对于间充质干细胞的获得,以前应用较多的是从骨髓组织中提取,但长期研究证明骨髓间充质干细胞的数量和其分化扩增能力随年龄的增长而逐渐减少和减弱,而且骨髓的获取是一种有创操作,不易采集,在细胞培养的过程中又容易感染,因而其应用受到限制。近年来,许多研究者逐渐尝试从人脐带组织中提取间充质干细胞,被称为脐带间充质干细胞(UC-MSCs)。由于脐带是来源于妊娠分娩时的废弃物,来源广泛,取材方便,不会引起伦理学方面的问题,并且脐带间充质干细胞容易提取,增殖能力强,免疫原性低,成为目前细胞组织工程研究的热点[7]。因而,如何高效、稳定地从脐带组织中获取间充质干细胞并将细胞进行储存是研究中需要关注的方向[8-9]。本实验中运用组织块贴壁法从脐带中分离培养间充质干细胞,并对获取的细胞进行低温冻存,观察冻存复苏后细胞的生物学特性和细胞活力,旨在为间充质干细胞的保存提供实验依据。
1实验资料
1.1标本采集采集2015年3—5月在河北省人民医院妇产科正常足月妊娠剖宫产健康胎儿的脐带,母体检查乙肝五项+丙抗、人类免疫缺陷病毒、梅毒等传染性指标均为阴性,排除母体家族遗传病及胎儿先天性疾病,征得产妇和家属的知情同意,实验过程符合医学伦理学标准并经医院伦理委员会批准。
1.2实验所用试剂及仪器DMEM/F12培养液(美国Hyclone公司),胎牛血清(FBS)(美国Hyclone公司),胰蛋白酶(美国Hyclone公司),小鼠抗人抗体藻红蛋白(PE)标记的CD29、CD44、CD90、CD105、CD34,异硫氰酸荧光素(FITC)标记的CD45,人类白细胞抗原(HLA)-DR(美国BD公司),二甲基亚砜(美国Sigma公司),多功能酶标仪(美国Molecular Devices公司),XDZ-2型倒置显微镜(重庆精密仪器厂),EPICS-XL4流式细胞仪(美国Beckman Coulter公司),3K15台式冷冻离心机(美国Sigma公司),CO2培养箱(美国Thermo Forma公司),Leica凝胶成像系统(德国Leica公司),超净工作台,无菌培养瓶,乙醇等。
1.3脐带间充质干细胞的分离、培养于无菌条件下取剖宫产新鲜脐带,长约10 cm,用生理盐水冲洗掉脐带中残留血液,将其剪成长2~3 cm的多个小段,然后再次漂洗,在超净工作台上纵向剖开脐带,用组织镊剔除2条脐动脉、1条脐静脉,采集血管与血管之间、血管与外膜之间的凝胶状物即华通胶组织,将其撕成细条状。用眼科剪将剥离的华通胶组织剪碎成1~2 mm3的小组织块,平铺至细胞培养瓶中,然后加入含有体积分数10%的胎牛血清、100 IU/mL青霉素和100 mg/L链霉素的DMEM/F12培养液,放入5%CO2、37 ℃的培养箱中静置培养,利用新生细胞的贴壁生长特性进行分离培养。倒置显微镜每天观察贴壁组织周围细胞的生长情况,根据细胞生长情况3~4 d换液1次。当细胞从组织块中爬出,并且细胞生长至80%~90%融合时,以吸管吹打贴壁细胞,用胰蛋白酶/EDTA消化液进行消化,并在显微镜下控制消化时间,PBS冲洗,离心,以1∶3进行传代培养。
1.4脐带间充质干细胞的冻存及复苏细胞冻存:取培养的第3代细胞,待生长至80%~90%融合时,常规胰酶消化细胞,PBS缓冲液洗涤3次,离心去除上清,缓慢加入冻存保护剂(体积分数为20%胎牛血清+70%DMEM/F12培养液+10%二甲基亚砜)重悬细胞,进行梯度冻存,先置入4 ℃冰箱20~30 min,-20 ℃冰箱1 h,然后置入-80 ℃冰箱过夜,第2天转入-196 ℃液氮罐中保存。细胞复苏:冻存6个月后从液氮中取出冻存管,立即投入37 ℃水浴箱中快速融化解冻,PBS洗涤,离心,向其加入含10%胎牛血清的DMEM/F12培养液,混悬后置入培养瓶中,在37 ℃、5% CO2培养箱中培养。待细胞达80%~90%融合后,常规胰酶消化,1∶3传代进一步细胞扩增。
1.5冻存前后细胞的形态学观察在倒置显微镜下连续观察冻存前细胞以及冻存复苏后细胞的形态学变化,并随机选取视野照相,记录观察结果。
1.6冻存前后细胞存活率的计算对未冻存的第3代细胞和冻存复苏后的细胞悬液分别用台盼蓝染色,滴至细胞计数板,静置2 min,在显微镜下于计数板上计数着色细胞和未着色细胞(着色细胞为死细胞,未着色细胞为活细胞),至少计数200个细胞,细胞存活率(%)=未着色细胞/(着色细胞+未着色细胞)×100%。
1.7冻存前后细胞生长曲线测定分别取未冻存的第3代细胞和冻存复苏后的细胞,胰蛋白酶/EDTA消化,按每孔1×104个细胞接种于24孔培养板上,在5%CO2、37 ℃的培养箱中培养,每天固定时间观察细胞生长情况,台盼蓝染色,当活细胞达到95%以上时进行细胞计数,以培养时间为横轴、细胞数量为纵轴,绘制未冻存细胞和冻存复苏细胞的生长曲线。
1.8冻存前后细胞的免疫表型鉴定取未冻存的第3代细胞和冻存复苏后培养的第3代细胞,达80%~90%融合时,胰蛋白酶/EDTA消化液消化,离心,PBS制成浓度为1×106/mL的单细胞悬液,分别加入鼠抗人PE标记的CD29、CD44、CD90、CD105、CD34及FITC标记的CD45、HLA-DR单克隆抗体,4 ℃避光孵育30 min,离心后弃去上清液,PBS洗涤2遍,重新制成细胞悬液,用流式细胞仪检测表面抗原的表达水平,鉴定冻存前后培养的细胞是否都含有脐带间充质干细胞的生物学标记。
1.9统计学方法数据运用SPSS 13.0软件进行统计学处理,计数资料的比较采用2检验,以P<0.05为差异有统计学意义。
2结果
2.1冻存前后脐带间充质干细胞的形态学比较用组织块贴壁法进行培养,在接种后1~2 d组织块开始贴壁,7~8 d后可以看到少量细胞从组织块中爬出,呈梭形或纺锤形,之后细胞增长速度较快,培养14d左右细胞似成纤维细胞形态,呈漩涡状生长,且平行排列,可形成片状融合,达80%~90%,见图1。此后可进行传代,传代后细胞的形态未见明显改变,细胞生长速度加快,形成典型的漩涡状排列生长 ,见图2。将培养的第3代细胞冻存6个月后再复苏,可见复苏细胞在24 h内贴壁生长,呈纺锤形或多角形,细胞形态饱满,生长状态良好,待7~8 d细胞长满瓶壁,排列有序,达到80%~90%融合,见图3;进行1∶3传代后的细胞生长速度加快,形态均一,生长良好,与未冻存的细胞形态基本一致。
2.2冻存前后细胞存活率比较经倒置显微镜观察,未冻存的第3代细胞平均存活率为94.1%,冻存复苏后的细胞平均存活率为92.7%,两者平均存活率比较差异无统计学意义(P>0.05)。
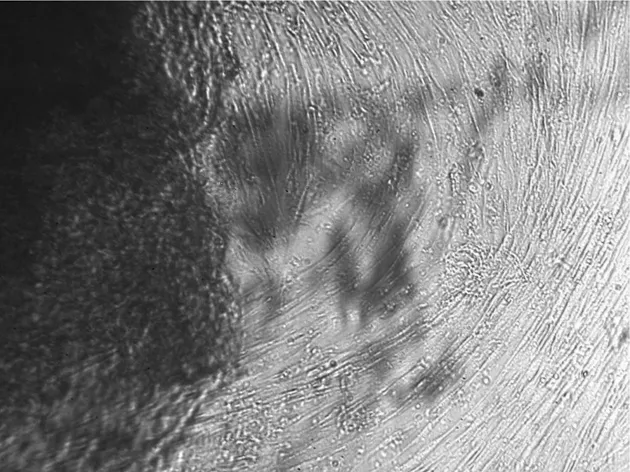
图1 原代细胞培养第14天的细胞形态(×100)
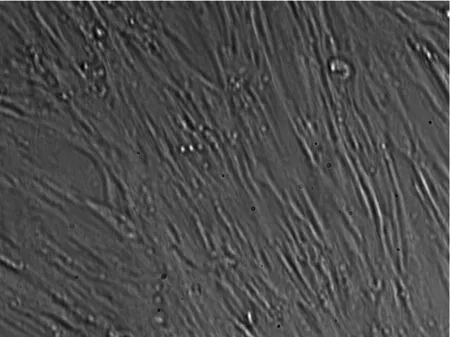
图2 第3代细胞培养第5天的细胞形态(×100)
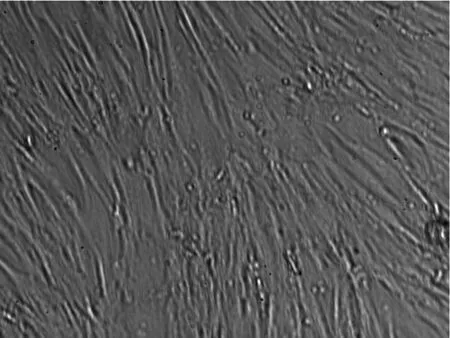
图3 冻存复苏后细胞培养至第5天的细胞形态(×100)
2.3冻存前后细胞生长曲线比较未冻存第3代细胞和冻存复苏后细胞的生长曲线相似,均呈S型,其中前1~2 d为潜伏期,细胞无明显增殖,自接种后第3天开始细胞生长速度增快,数量明显增多,进入对数生长期,第7—8天细胞可达80%~90%融合,之后细胞生长停滞,进入平台期。见图4。
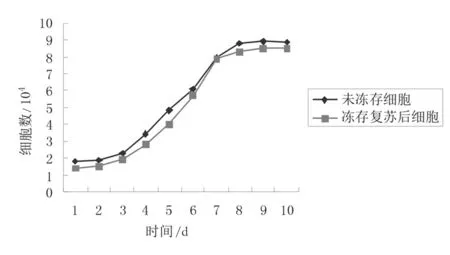
图4 未冻存细胞和冻存复苏后细胞的生长曲线
2.4冻存前后细胞免疫表型分析未冻存细胞与冻存复苏后细胞均高表达基质细胞抗原CD29、CD90、CD44、CD105,低表达或不表达造血干细胞抗原CD34、CD45和白细胞相关抗原HLA-DR,说明冻存复苏后的细胞免疫表型符合间充质干细胞的表型特征。
3讨论
间充质干细胞是目前组织工程研究的热点,其已经在心血管疾病、神经系统疾病、糖尿病、肝脏疾病、脊髓损伤等多个学科领域得到广泛应用,对于治疗一些自身免疫性疾病以及退行性病变等有很好的临床价值,具有非常广阔的前景。既往研究已经从骨髓、外周血、脐带血及脐带组织中通过不同的培养方法分离获得了间充质干细胞,与其他来源的间充质干细胞相比,脐带源性间充质干细胞具有如下优点:来源广泛,采集容易,对产妇和胎儿均无任何危害,不存在法律和伦理学方面的争议;细胞培养方法简便,扩增能力强[10];受病毒污染的概率低;脐带免疫原性低,不易引起移植物抗宿主病[11]。这些优点使得脐带间充质干细胞在组织工程领域应用日益广泛[12]。
运用组织块贴壁法从人脐带华通胶中分离培养间充质干细胞,避免了酶消化法繁琐的操作过程以及酶对细胞的毒性作用,可保持细胞良好的生物学特性,提高培养的成功率[13]。本研究结果显示,在标准培养条件下,从脐带华通胶提取的间充质干细胞沿培养瓶贴壁生长,呈梭形或纺锤形,漩涡状生长,并可稳定传代,传代后细胞生长能力强,形态未见明显改变;通过流式细胞仪检测细胞的免疫表型显示,细胞高表达间充质干细胞的表面特异抗原,几乎不表达造血干细胞的标志性抗原,说明提取的细胞符合间充质干细胞的鉴定标准。
在细胞培养过程中,笔者也遇到一些问题,比如脐带间充质干细胞长期培养会造成细胞衰老、分化和过剩,以及培养条件变化、培养箱故障等致使细胞污染,这些都会导致细胞、试剂和材料的浪费。既往研究已经证实骨髓源性的间充质干细胞能够进行低温冻存,并且冻存复苏后仍能保持细胞的生物学特性[14-15],因此,笔者尝试用同样的方法对脐带间充质干细胞进行冻存,用来储备细胞以备移植时使用。本研究将培养的第3代细胞放入液氮中冻存6个月,经复苏后观察细胞仍贴壁生长,形态未见明显改变,同样可以扩增、传代培养,细胞存活率与冻存前细胞比较差异无统计学意义,均达到90%以上,而且冻存前后细胞的生长曲线相似,说明冻存复苏后细胞增殖活性未受影响,低温冻存没有改变脐带间充质干细胞的生物学特性。进一步用流式细胞仪检测冻存复苏后细胞的免疫表型,结果显示冻存后细胞仍保留间充质干细胞表面抗原的特性。
综上所述,低温冻存可以作为长期保存脐带间充质干细胞的一种有效方法,经冻存复苏后的细胞保持了原有细胞的生物学特性,符合间充质干细胞的基本要求,满足了人们对种子细胞的需求,使得脐带间充质干细胞在组织工程研究及临床应用中更加方便和广泛。
[参考文献]
[1]Perez-Campo FM,Riancho JA. Epigenetic mechanisms regulating mesenchymal stem cell differentiation[J]. Curr Genomics,2015,16(6):368-383
[2]高广周,孙涛. 间充质干细胞免疫学特性的研究进展[J]. 河北医科大学学报,2010,31(9):1143-1145
[3]Doorn J,Moll G,Le Blanc K,et al. Therapeutic applications of mesenchymal stromal cells: paracrine effects and potential improvements[J]. Tissue Eng Part B Rev,2012,18(2):101-115
[4]Mueller MB,Blunk T,Appel B,et al. Insulin is essential for in vitro chondrogenesis of mesenchymal progenitor cells and influences chondrogenesis in a dose-dependent manner[J]. Int Orthop,2013,37(1):153-158
[5]李红敏,黄平平. 间充质干细胞移植治疗糖尿病研究进展[J]. 山东医药,2015,55(46):96-97
[6]Heo JS,Choi Y,Kim HS,et al. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue[J]. Int J Mol Med,2016,37(1):115-125
[7]雷鑫,陈彦,张建林,等. 评价脐带间充质干细胞移植前细胞活性的指标[J]. 中国组织工程研究,2013,17(32):5847-5854
[8]李素萍,王震,吕蓉,等. 人脐带间充质干细胞低温冻存后生物学鉴定[J]. 临床输血与检验,2012,14(4):289-294
[9]李洁,傅勇辉,吴琼,等. 冻存前后脐带间充质干细胞生物学特性的比较[J]. 实验与检验医学,2014,32(1):8-10
[10] 韩华,薛改,张俊勤,等. 人脐带间充质干细胞的分离、培养及鉴定[J]. 河北医科大学学报,2015,36(1):21-23
[11] Latorre E,Carelli S,Caremoli F,et al. Human antigen R binding and regulation of SOX2 mRNA in human mesenchymal stem cells[J]. Mol Pharmacol,2016,89(2):243-252
[12] Romanov YA,Balashova EE,Volqina NE,et al. Optimized protocol for isolation of multipotent mesenchymal stromal cells from human umbilical cord[J]. Bull Exp Biol Med,2015,160(1):148-154
[13] 李艳琪,王洪一,姚尧,等. 人脐带源间充质干细胞分离培养方法的改进[J]. 中国组织工程研究,2014,18(10):1609-1614
[14] 武成聪,李强,陈佳滨,等. 短期冻存兔骨髓间充质干细胞对其生物特性的影响[J]. 重庆医学,2014,43(4):459-464
[15] 王振玲,王金焕,郭青,等. 多发性骨髓瘤患者骨髓间充质干细胞冻存前后的生物学特性[J]. 中国组织工程研究,2013,17(45):7898-7903
[作者简介]韩华,女,主治医师,硕士,主要从事妇产科干细胞移植修复方面的研究。
[基金项目]河北省卫生厅青年科技课题(20150122)
doi:10.3969/j.issn.1008-8849.2016.23.002
[中图分类号]R-33
[文献标识码]A
[文章编号]1008-8849(2016)23-2512-04
[收稿日期]2016-04-30
Effects of cryopreservation and resuscitation on the biological characteristics of umbilical cord mesenchymal stem cells
HAN Hua, ZHAO Jing, ZHAO Hongwei, LI Jie, YAN Ping
(Hebei General Hospital, Shijiazhuang 050051, Hebei, China)
Abstract:Objective It is to observe the biological characteristics of umbilical cord mesenchymal stem cells after cryopreservation, and identify whether it has the characteristic of mesenchymal stem cells. Methods By tissue explants adherent method, the MSCs were isolated and cultured from umbilical cord. And the third passage cells were frozen and thawed after six month. Then the morphological changes before freezing and frozen thawed cells were observed, the survival rate was compared, the cell growth curve was determined, and the expression of cell surface antigen was detected by flow cytometry. Results MSCs were successfully obtained from Wharton’s jelly of human umbilical cord via the proposed approach of tissue adherence. After cryopreservation, the cells still maintained the characteristics of adherent growth, and the morphology did not change significantly. The survival rate of frozen thawed cells had no significant difference compared with that of the non frozen cells. Cell growth curve was similar before and after cryopreservation. The flow cytometry analysis showed that frozen thawed cells highly expressed CD29, CD90, CD44, CD105 of stromal cell antigen, but low expression of hematopoietic stem cell associated antigens CD34, CD45 and leukocyte antigen HLA-DR. Conclusion The biological characteristics of human umbilical cord mesenchymal stem cells were not significantly changed after cryopreservation, and the cells were in accordance with the basic requirements of mesenchymal stem cells after cryopreservation.
Key words:mesenchyma stem cells; umbilical cord; cryopreservation; biological characteristics

