越冬期间库尔勒香梨不同器官抗寒指标随气温的变化
艾克来木·艾合买提,阿不来提·买买提,巴特尔·巴克*,阿丽腾·吐尔孙哈力,萨吉旦·阿卜杜克日木,祖力克艳·麻那甫
越冬期间库尔勒香梨不同器官抗寒指标随气温的变化
艾克来木·艾合买提1,阿不来提·买买提2,巴特尔·巴克1*,阿丽腾·吐尔孙哈力1,萨吉旦·阿卜杜克日木1,祖力克艳·麻那甫1
(1 新疆农业大学 草业与环境科学学院, 乌鲁木齐830052;2 和田地区林管站, 新疆和田848000)
以越冬期间库尔勒香梨花芽、树干、枝条等器官为材料,测定了不同器官形成层组织抗氧化酶(SOD、CAT、POD)活性、可溶性蛋白含量、相对电导率等抗寒指标,同时监测了果园气温和树干阳阴面形成层温度,并采用隶属函数评价不同器官抗寒性,分析越冬期气温对新疆库尔勒香梨不同器官抗寒指标和抗寒性的影响。结果表明:(1)在库尔勒香梨越冬期间,不同器官同一抗寒指标和同一器官不同抗寒指标随气温、树干阳阴面形成层温度差的变化趋势有所不同,但总体上抗寒指标均与气温呈负相关关系,而与树干阳阴面形成层温度差均呈正相关关系。(2)各器官形成层可溶性蛋白含量与其抗氧化酶活性呈正相关关系,SOD、CAT活性与POD活性呈正相关关系,并以CAT与POD活性相关性最强。(3)利用隶属函数法综合分析结果显示,贡献率最大的是CAT活性和可溶性蛋白含量,不同器官抗寒性强弱顺序为花芽组织>树干阴面形成层>枝条形成层>树干阳面形成层。研究发现,库尔勒香梨各器官形成层POD和CAT活性在越冬期间较低气温和较强烈形成层温度变化时较高,并以SOD对低温伤害和形成层温度变化最敏感;整个越冬期抗寒性强的器官表现出较高的可溶性蛋白含量和较低的相对电导率;形成层温度变化与抗寒生理指标变化之间具有较好的相关性,在一定范围内能够反映机体受到的低温冻害程度。
越冬期;库尔勒香梨;器官;生理指标;抗寒性
库尔勒香梨是新疆梨 (PyrussinkiangensisYu.) 和西洋梨的自然杂交后代[1],西洋梨原产欧洲东部到东南部,及高加索、波斯北部等地,有2 000多年的栽培历史。香梨有降血压、清热镇凉的作用,梨皮和梨叶、花、根均可入药,有润肺、消炎、清热、解毒等功效。库尔勒香梨是新疆的名、优、特色水果,栽培历史已有1500多年。库尔勒市香梨种植面积达2.93×104hm2(库尔勒市香梨研究中心,2012),成为该地区农民增收的主要渠道。
冻害是全球果树生产中一种常见的自然灾害[2],低温是果树引种和栽培的限制因子。库尔勒香梨为多年生果树,冻害严重影响香梨在越冬期间的安全越冬及春季开花坐果,严重时导致树木死亡毁林,从而造成巨大的经济损失。国内外关于果树和植物抗寒性研究结果认为,细胞膜膜透性、渗透调节物质、丙二醛、抗氧化酶[3]都可用作抗寒性的鉴定指标。越冬初期最低气温、最低气温持续时间、太阳辐射等气象因子直接或者间接影响着细胞正常结构和功能及相关生理指标的诱导和合成,从而扰乱机体进行正常低温驯化或者抗寒锻炼,并影响抗寒锻炼质量和植物抗寒性。大量研究发现,与未经历低温驯化相比,正常经历低温驯化的植物抗寒性可大幅提高[4],低温驯化与越冬抗寒性有紧密的联系,植物经过低温驯化后,增加了细胞膜不饱和脂肪酸的含量,从而提高了细胞膜的抗冻性;同时,低温驯化还提高植物的抗氧化能力,增加了细胞内可溶性物质等的含量,增强了抗冻能力[5]。迄今,国内外关于抗寒锻炼与抗寒性评价的研究主要集中在苜蓿[6]、花椒[7]、核桃[8]、扁桃[9]、柽柳[10]、石榴[11]、枣树[12]、葡萄[13]等植物,以及果树在人工低温胁迫或者自然低温状态下某一个器官抗寒性和生理指标变化。电解质渗出率、半致死温度(LT50)、隶属函数法和主成分析法都是抗寒性鉴定常用的方法。关于在自然状态下,库尔勒香梨不同器官主要生理指标变化及其气象因子对生理指标影响的研究相对少见。因此、本研究针对库尔勒香梨越冬伤害,在自然状态下分析不同越冬期间果树树干阳阴面形成层、枝条、花芽等器官和组织的SOD、CAT、POD活性,以及可溶性蛋白含量和电导率等指标的变化,并利用隶属函数进行抗寒性综合评价,试图揭示越冬期气象因子与不同器官保护酶、渗透调节物、抗寒性变化之间的关系,为减轻和补救冻害伤害提供科学依据。
1 材料和方法
1.1实验材料
实验于从2014年11月至2015年4月在新疆库尔勒市托布里其乡梨园(N 41.67°,E 85.92°)进行,实验材料为23年生、健康、长势较好的库尔勒香梨树。
1.2研究方法
1.2.1野外取样和预处理于库尔勒香梨冬眠不同阶段,即从冬眠初期到次年活动期,在香梨阳阴面树干形成层、一年生枝条和花芽等器官进行采样,分别于2014年12月2日、2014年12月31日、2015年1月20日、2015年2月11日和2015年3月31日采样。采样后立即用纱布和锡箔纸包裹放入液氮罐送回实验室,并转入-80 ℃的低温冰箱冷藏。取出样品时先把样品放在-40 ℃的低温冰箱,自然升温到0 ℃以后,按照要求分别测定样品生理参数。
1.2.2生理参数的测定主要测定树干阳阴面形成层、枝条形成层和花芽组织的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性及相对电导率、可溶性蛋白含量等与抗逆性相关的主要生理指标。测定方法如下:POD 活性的测定采用愈创木酚法参照郝再斌主编的《植物生理实验技术》[14];CAT 活性的测定采用紫外吸收法,SOD 活性的测定采用氮蓝四唑法,可溶性蛋白含量采用考马斯亮蓝G- 250染色法,均参照李合生主编的《植物生理生化试验原理与技术》[15];相对电导率测定采用电导仪法[16]。
1.2.3气象因子及树干形成层温度监测与预处理整个越冬期连续监测果园离地面2 m处的空气温度(型号AV-ST)、太阳辐射(型号AV-20P)、地面反射辐射(型号AV-20P)、风速(型号AV-30WS)等气象因子及离地面50cm高处树干形成层(利用电偶温度传感器,型号AV-AT)温度变化[17],每15 min记录一次数据,所监测数据采用美国Avelon公司生产的AR5型数据采集器存储。根据所监测的15 min的气象因子分别计算每小时、日值、月值等。
1.2.4抗寒性综合评价应用 模糊数学中隶属函数法[18-20]进行综合评判,SOD、CAT、POD、可溶性蛋白含量采用算式为:U(Xijk) = (Xijk-Xmin)/(Xmax-Xmin) ,而相对电导率采用算式为U(Xijk)=1- (Xijk-Xmin)/(Xmax-Xmin)。
式中,U(Xijk) 为第i个器官第j个温度阶段,第k项指标的隶属度,且U(Xijk) ∈[0,1];Xijk表示第i个器官第j个温度阶段,第k个指标测定值;Xmax、Xmin分别为所有参试种中第k项指标的最大值和最小值。
1.2.5数据处理与分析实验数据采用SPSS20、Excel 2013等软件进行分析,差异显著性分析采用Tukey’s多重测验,采用Pearson 相关系数来分析相关性。
2 结果与分析
2.1香梨越冬期果园气象因子动态分析
香库尔勒香梨越冬期果园实测气象因子的分析结果表明(表1),随着冬眠的加深,果园气温日较差先下降后上升,但各月份之间的差异不大;树干阳阴面形成层温差具有先下降后上升的变化趋势,其在12月和1月之间没有很大的差别。 12月15日出现-27.51 ℃极端低温,此日的阳阴面形成层温差与气温日较差分别为11.6 ℃和21.25 ℃。果园平均气温在越冬期先下降然后逐渐上升。太阳辐射从11月至翌年2月保持逐步下降的趋势,并以3月份太阳辐射最强;地面反射辐射先上升后下降再上升,12月地面反射辐射最大,11月最小,虽然11月太阳辐射较高,但次月果园地上被叶片覆盖,导致地面反射辐射减弱。库尔勒市区在12月份和1月份之间果园积雪量达到5~10 cm,由此可见地面反射辐射的上升是由雪导致的。
库尔勒香梨越冬期间,果园最低温度出现时间主要集中在12月和次年1月份(表2)。其中,气温低于-20 ℃的总日数为28 d,低于-22 ℃的有14 d,低于-24 ℃的有4 d,低于-26 ℃的只有1 d,且12月低温出现较频繁。从极端低温持续时间来看,整个越冬期-22 ℃以下低温持续时间5 h以上的日数为14 d;最低气温和极端低温出现时间为20:00-8:00(新疆时间,当地时间与北京时间相差2.5 h)。本实验-24 ℃以下低温持续时间超过5 h的日数为3 d,其中在12月16~18日-24 ℃以下低温持续时间为11 h,冻害伤害程度远远超过前人报道的造成中度冻害阈值[21]。
2.2库尔勒香梨越冬期不同器官抗氧化酶随气温的变化
图1,A显示,随着气温的降低,库尔勒香梨整个越冬期不同器官和组织SOD活性均先急剧上升,经历最低气温后下降,此后不再回升,下降后各器官SOD活性均高于越冬初期(12月2日)。与12月2日的SOD活性相比,库尔勒香梨12月31日阳阴面形成层、枝条、花芽的酶活性明显上升及其间差异达到了极显著水平(P<0.01),并以阳面形成层和花芽的差异最性大,枝条的差异性最小;与12月2日相比,库尔勒香梨1月20日和2月11日枝条和花芽的酶活性达到显著性差异水平。可见,库尔勒香梨阳面形成层、花芽和枝条SOD活性变化与平均气温、阳阴面形成层温差值均呈负相关,而阴面形成层酶活性变化与阳阴面形成层温差呈负相关。

表1 越冬期间果园实测气象因子的变化
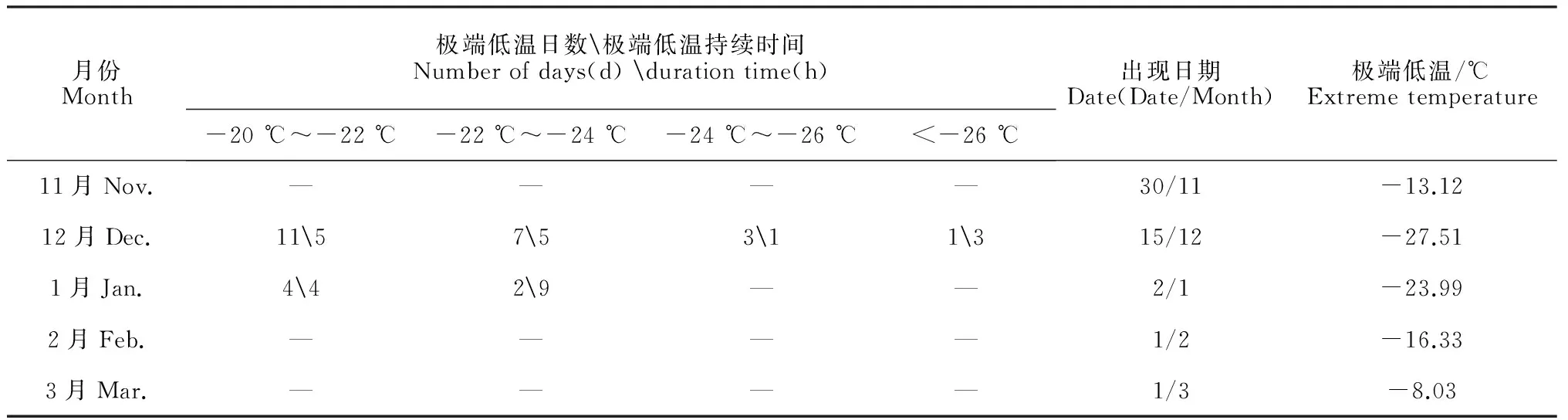
表2 果园实测极端低温和极端低温持续时间
注:极端低温持续时间是代表极端低温出现日的低温持续时间
Note: Extreme lowest temperature duration time represents the duration time on the day extreme lowest temperature appeared

图中数据为平均值±标准差,柱上标有 *和** 分别表示越冬期在0.05和0.01 水平与对照(越冬初期,12月2日)存在显著性差异;下同图1 越冬期果园气温变化与库尔勒香梨不同器官SOD、CAT和POD活性之间的关系The data are means+ SD;* and ** indicate significant differences between during and earlier (2nd December) over-wintering period at the level of 0.05 and 0.01,respectively.The same as belowFig. 1 The relation between the changes of orchard temperature and SOD,CAT and POD activities in different organs during over-wintering period
同时,越冬期库尔勒酥梨各器官(组织)CAT 活性的变化趋势与其SOD活性不同,表现出“升-降-升-降”的趋势(图1,B)。其中,与越冬初期(12月2日)相比,库尔勒酥梨各器官(组织)1月20日和3月31日的CAT活性均显著和极显著降低,而12月31日和2月11日的CAT活性也有不同程度升高,但均未达到显著差异水平。在经历最低气温后(12月31日),阴面形成层CAT活性高于阳面形成层,并以花芽CAT活性最低,但与12月2日相应活性差异没达到显著水平。阳阴面形成层、枝条和花芽CAT活性与平均气温、阳阴面形成层温度差均呈负相关,其中相关性最强的是阳面形成层酶活性。
另外,越冬期库尔勒酥梨各器官(组织)POD活性变化趋势与以上两种酶均有所不同,它不仅在不同采样期各器官和组织间有明显差异,而且还在同一个采样期各器官和组织间也有很大的差别(图1,C)。在经历最低气温之前的12月2日,酥梨花芽POD活性大于阳阴面形成层和枝条的酶活性,并以阴面酶活性最小;在经历最低气温之后的12月31日,阳阴面形成层和花芽的POD活性分别比12月2日极显著和显著上升,而枝条酶活性降低并不回升,且与12月2日差异达极显著水平;在2月11日,阳阴面形成层和花芽POD活性比12月2日分别极显著和显著升高,而其枝条的POD活性则比12月2日极显著降低。
以上结果说明越冬期库尔香梨同一种器官或组织不同抗氧化酶酶活性与气温变化之间的相关性关系有所不同,不同器官或组织同一种抗氧化酶酶活性随气温的变化趋势也具有明显的差别,但总体来说不同器官在最低气温出现时间段表现出整个越冬期最高的酶活性。不同器官和组织SOD活性在整个越冬期保持比对照高的酶水平,该酶在库尔勒香梨适应和抵抗低温冻害起到重要的作用。
2.3越冬期库尔勒香梨不同器官可溶性蛋白含量和相对电导率随气温的变化
越冬期库尔勒香梨不同器官(组织)可溶性蛋白含量变化具有“升-降-升-降”的波动性特征,并与CAT活性具有相似的变化趋势(图2,A)。其中,在12月2日,酥梨花芽可溶性蛋白含量明显较高,而枝条的含量相对较低;经历最低气温后,12月31日酥梨阳阴面形成层、枝条、花芽可溶性蛋白含量明显增高,且阳面增加幅度最大,其中的阳面形成层和花芽可溶性蛋白含量与12月2日差异均达到极显著性差异水平,阴面形成层和枝条可溶性蛋白含量与12月2日差异均达到显著性差异水平;另外,花芽可溶性蛋白含量在1月20日和3月31日均极显著低于12月2日,其他取样时间其余器官(组织)的可溶性蛋白含量均与12月2日无显著差异。
同时,越冬期库尔勒香梨不同器官(组织)的相对电导率具有先逐渐上升后下降的变化趋势(图2,B),阴、阳面形成层和枝条均在2月11日达到最大值,而花芽则在12月31日达到最大值,且整个越冬期花芽保持较低的相对电导率和最小的变化幅度,这可能是与花芽鳞片结构有关。其中,在12月2日,香梨阴面形成层相对电导率大于阳面,而以花芽相对电导率最低;经历最低气温后的12月31日,不同器官(组织)相对电导率明显增大,且阳面和花芽相对电导率与12月2日相比均达到极显著性差异水平;在2月11日,阳、阴形成层、枝条相对电导率比12月2日均极显著性上升,花芽电导率上升幅度也达到显著差异水平。
以上结果说明可溶性蛋白含量、抗氧化酶活性与库尔香梨抗寒性之间存在密切的关系,库尔勒香梨经历越冬期最低气温后不同器官和组织表现出越冬期最高的酶活性和可溶性蛋白含量,可溶性蛋白不仅对抗氧化酶的合成起到重要作用,还通过调节细胞渗透势减轻低温对细胞的伤害,因此,12月31日出现的低温逆境强度虽然最大,但不同器官受伤害程度较低。
2.4越冬期果园气温与库尔勒香梨生理指标的相关性分析
从表3可以看出,越冬期果园气温与库尔勒香梨器官(组织)生理指标均呈负相关,其中相关性最强的是相对电导率,最弱的是POD活性,这可能是因为POD活性对低温伤害反应比较迟钝,而细胞膜对低温伤害较敏感,低温使细胞膜透性增大,渗透调节物质外渗,电导率升高的原因。同时,在库尔勒香梨器官(组织)生理指标之间,保护酶活性、可溶性蛋白含量与相对电导率分别呈正相关,这可能是细胞受到伤害时保护酶和可溶性蛋白通过升高活性和含量来降低低温有害作用的原因;各保护酶活性间相互呈正相关,其中CAT与POD活性相关性最强,这可能是这三种指标协同降低或解除低温伤害的原因。另外,形成层温度变化可以直接反映诱导和刺激抗寒性指标合成的温度逆境和融冻交替幅度,香梨阳阴面形成层温度差与所有抗寒性指标均呈正相关,其中与SOD、CAT活性和可溶性蛋白含量之间的相关性最好,这可能是因为SOD活性对形成层温度变化最先发出反应,而CAT活性和可溶性蛋白在较强烈的形成层温度变化的条件下才表现出较高酶活性和较高含量。
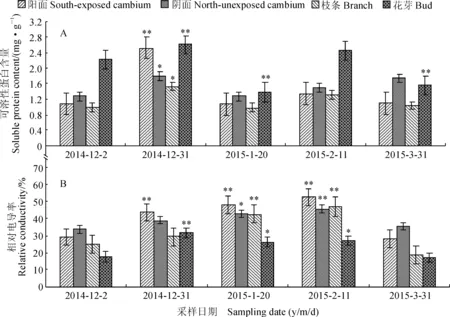
图2 越冬期果园气温变化和不同器官可溶性蛋白含量和相对电导率之间的关系Fig. 2 The relation between the changes of orchard air temperature and soluble protein content and relative conductivity in different organs during over-wintering period
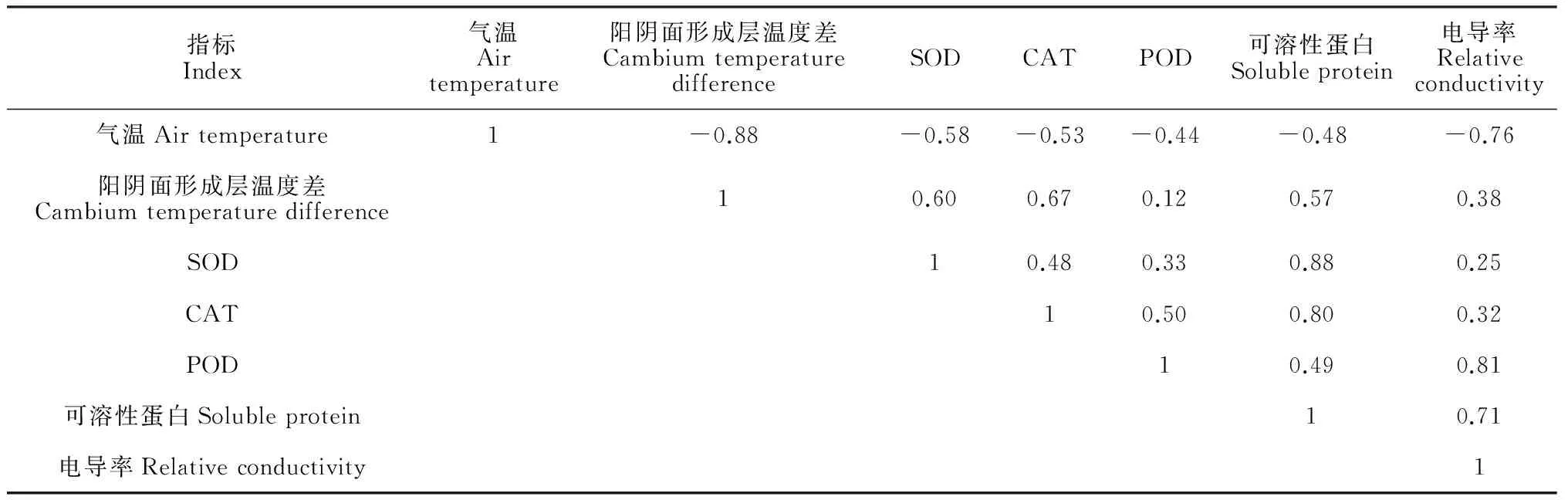
指标Index气温Airtemperature阳阴面形成层温度差CambiumtemperaturedifferenceSODCATPOD可溶性蛋白Solubleprotein电导率Relativeconductivity气温Airtemperature1-0.88-0.58-0.53-0.44-0.48-0.76阳阴面形成层温度差Cambiumtemperaturedifference10.600.670.120.570.38SOD10.480.330.880.25CAT10.500.800.32POD10.490.81可溶性蛋白Solubleprotein10.71电导率Relativeconductivity1
注:* 和 ** 分别表示在0.05和0.01水平上显著,
Note: * and ** indicate significant differences at the level of 0.05 and 0.01, respectively
2.5库尔勒香梨不同器官抗寒性的生理评价
参照前人[19]研究的方法,结合大田实际情况,按照平均隶属度将抗寒性分为3级。Ⅰ级,平均隶属度为0.60~ 1. 00,为高抗寒品种;Ⅱ级,平均隶属度为0. 30 ~ 0. 59,为中抗寒品种;Ⅲ级,平均隶属度为0 ~0.29,为低抗寒品种。依据以上标准和表4可知,库尔勒香梨不同器官抗寒性表现为花芽>阴面形成层>枝条形成层>阳面形成层,这均与它们的生理指标测定结果和实际的受冻害情况吻合。说明隶属函数法能较好地评价库尔香梨不同器官的抗寒性。
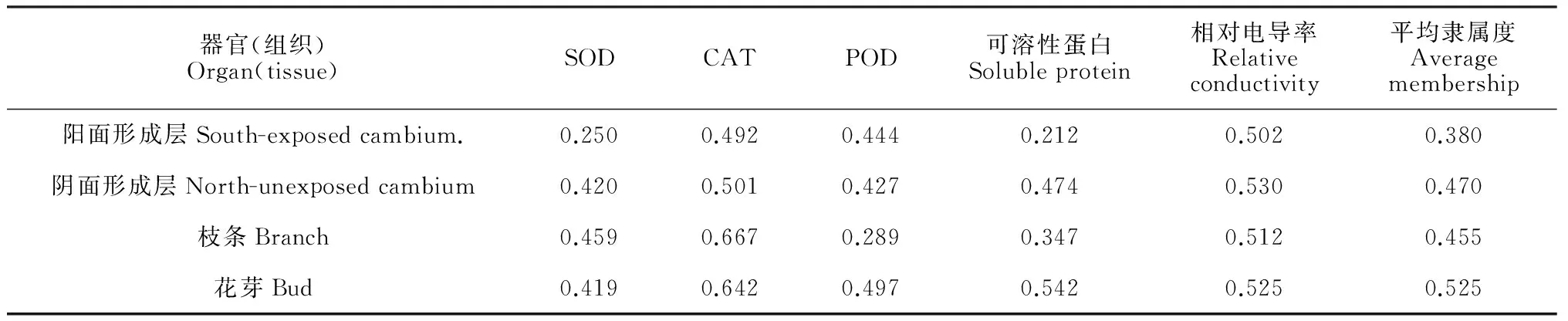
表4 不同器官(组织)抗寒性的综合评价
虽然不同器官抗寒性有差别,但总体上都属于中抗寒性,由此可以断定库尔勒香梨属于中抗寒性品种。不同器官(组织)中,花芽抗寒性最强,这除了生理指标外,还可能与花芽的鳞片结构有关;阳面形成层抗寒性最弱,这可能是因为阳面形成层受到融冻交替机械伤害程度比其他器官(组织)高,遭到细胞膜结构损伤,电解质外渗,代谢活动絮乱,致使其抗寒性降低。
3 讨 论
低温胁迫条件下,细胞中SOD、CAT、POD活性、可溶性蛋白含量、相对电导率与库尔勒香梨不同器官抗寒性有密切的关系,它们在一定条件下反映不同器官抗寒性的强弱,不同器官对低温胁迫的敏感性和抗寒性有所差别。
本研究表明,经历2014年最低气温后,库尔勒香梨不同器官SOD活性急剧上升,并上升到整个越冬期的最高水平,此后下降不回升并且保持较小的变化幅度,这结果与前人在麻黄[22]、核桃[23]、石榴[11]上的研究结果类似。低温胁迫条件下形成的多余活性氧自由基诱导SOD活性的上升,本研究中出现超过造成中度冻害阈值的极端低温和极端低温出现时间,造成大量活性氧自由基产生和累积,打破了SOD解除活性氧自由基伤害作用的动态平衡,引起细胞膜结构损伤,细胞膜渗透性增大,导致大量电解质外渗,相对电导率增大,细胞丧失结构和功能上的整体性,影响SOD诱导合成,从而引起低温胁迫后SOD活性降低而没有上升。这表明对低温造成细胞尤其是细胞膜伤害最敏感的保护酶是SOD,由于SOD是一种诱导酶[24],在连续出现的强烈胁迫条件下,不能表现出高活性。
同期CAT 活性的变化趋势具有波动性与SOD不同,最低气温出现后先上升后降低再上升又降低,不同器官之间酶活性差别不大。在低温胁迫条件下,CAT和SOD协同解除活性氧自由基对细胞的伤害。在本实验进行过程中,从12月15日至翌年1月初连续出现本年极端低温,它引起CAT活性上升,但连续低温逆境必定会损伤细胞膜;此外从1月10日随着气温逐步上升,树干阳阴面形成层温差升高,融冻交替对细胞和细胞组织机械伤害作用增大,进一步加重细胞膜伤害程度,可能导致其CAT活性降低;2月11日,在SOD酶活性较低,整个越冬期电解质外渗量最高的情况下,CAT表现出高的酶活性。这证明在较大电解质外渗的情况下,CAT表现出高的酶活性,有利于解除过氧化氢对细胞的进一步伤害。
同期POD活性变化趋势与CAT基本相似,具有波动性,但不同器官之间有很大的差别,阳面形成层、花芽组织、阴面形成层与枝条形成层之间的差异达到极显著性水平。整个越冬期花芽一直保持高的保护酶活性,而枝条形成层保持很低的保护酶活性,阳面形成层保护酶活性变化幅度最大。总体上,库尔勒香梨越冬期的最高保护酶活性出现在2月份,这与高福元等的“SOD活性的最高值出现在12~1月份,POD活性最高值为2月份”的实验结果类似[25]。12月中旬至1月初,经历最低气温后阳面形成层和花芽组织保护酶活性先升高后降低,且阳面形成层升高幅度比花芽组织大,这可能是因为树干阳面受到的融冻交替机械伤害作用比其他器官大,逆境胁迫程度高,导致形成层酶活性下降幅度大于花芽,这与田景华等的实验结果相似[26]。
另外,本实验中库尔勒香梨越冬期组织保护酶活性与其相对电导率呈显著正相关,这可能如Zhang和Kirkham 所述[27]的保护酶,尤其是POD就像一把“双刃剑”, 在低温胁迫初期表现为保护效应,亦可在低温胁迫后期表现为伤害效应,参与活性氧的生成的原因。同时,组织可溶性蛋白含量与CAT活性具有相同的变化趋势,且不同器官之间的差异大,并以花芽组织可溶性蛋白含量最高,枝条形成层最低,阳面形成层可溶性蛋白含量变化幅度最大,在低温逆境胁迫最强烈时出现最大值。本实验可溶性蛋白含量与相对电导率呈负相关,相对电导率是反映植物抗性强弱快捷和准确的方法,香梨花芽组织2月份可溶性蛋白含量大而相对应的电导率低,这进一步说明可溶性蛋白含量高的器官抗寒性强,它在增强机体抗寒性及其减轻逆境伤害起很重要的作用。
值得一提的是,本实验越冬期间除了气温、太阳辐射、气温日较差等气象因子外,还将气象因子变化与树木本身生物和物理特性共同决定的树干阳阴面形成层温度差列为库尔勒香梨抗寒性指标的影响因子,形成层温度变化与生理指标变化之间具有较好的相关性,在一定范围内能够反映机体受到的低温冻害程度。
4 结 论
越冬期库尔勒香梨组织SOD活性是对低温和低温伤害最敏感的保护酶;在细胞膜受到伤害,电解质大量外渗的情况下,仍然能表现出较高酶活性的保护酶是CAT和POD;越冬期不同器官CAT活性差别不大,而POD活性差别达到极显著性差异水平。果园气温与香梨抗寒性呈正相关,而形成层温度变化幅度与抗寒性指标均呈正相关,其中相关性较好的是SOD、CAT活性和可溶性蛋白含量。越冬期间香梨不同器官相对电导率均于2月份达到最高值,并以阳面形成层变化幅度最大,花芽组织变化最小;抗寒性强的器官可溶性蛋白含量高,相对电导率低。库尔勒香梨越冬期不同器官抗寒性强弱顺序表现为花芽组织>树干阴面形成层>枝条形成层>树干阳面形成层,总体来说,库尔勒香梨属于中等抗寒性品种。
[1]张钊,王野苹. 香梨品种种源问题的探讨[J]. 果树学报, 1993,10(2): 113-115.
ZHANG Z,WANG Y P. The issue of fragrant pear varieties provenance[J].JournalofFruitScience, 1993,10(2): 113-115.
[2]黄敏, 陈杰忠. 果树抗寒性研究进展(综述)[J]. 亚热带植物科学, 2011, 40(1): 80-84.
HUANG M, CHEN J Z.Research progress on cold-resistance of fruit trees[J].SubtropicalPlantScience, 2011,40(1): 80-84.
[3]潘晓云, 曹琴东, 王根轩. 膜脂过氧化作为扁桃品种抗寒性鉴定指标研究[J]. 生态学报, 2002, 22(11): 1 902-1 911.
PAN X Y, CAO Q D, WANG G X. Evaluation of lipid peroxidation for use in selection of cold hardiness cultivars of almond[J].ActaEcologicaSinica, 2002, 22(11): 1 902-1 911.
[4]CASTONGUAY Y, BERTRAND A, MICHAUD R,etal. Cold-induced biochemical and molecular changes in alfalfa populations selectively improved for freezing tolerance[J].CropScience, 2011,51(5): 2 132-2 144.
[5]CASTONGUAY Y, DUBÉ MP, CLOUTIER J,etal. Molecular physiology and breeding at the crossroads of cold hardiness improvement[J].PhysiologiaPlantarum, 2013, 147(1): 64-74.
[6]刘志英, 李西良, 李峰,等. 紫花苜蓿非秋眠型标准品种种子萌发期耐盐性评价[J]. 植物生态学报, 2015, 39(6): 635-648.
LIU Z Y, LI X L, LI F,etal. Mechanisms underlying the effects of fall dormancy on the cold acclimation and winter hardiness ofMedicagosativa[J].ChineseJournalofPlantEcology, 2015, 39(6): 635-648.
[7]吕小军, 杨途熙, 何小红,等. 冬季低温对花椒抗寒性生理指标的影响[J]. 西北农业学报, 2013, 22(7): 143-148.
LÜ X J, YANG T X, HE X H,etal. Influence of low temperature stress on the cold-resistance physiological indexes ofZanthoxylumbungeanumin winter[J].ActaAgriculturaeBoreali-OccidentalisSinica,2013, 22(7): 143-148.
[8]相昆, 张美勇, 徐颖,等. 不同核桃品种耐寒特性综合评价[J]. 应用生态学报, 2011, 22(9): 2 325-2 330.
XIANG K, ZHANG M Y, XU Y,etal. Cold-tolerance of walnut cultivars: a comprehensive evaluation[J].ChineseJournalofAppliedEcology, 2011, 22(9): 2 325-2 330.
[9]李斌, 刘立强, 罗淑萍,等. 扁桃花芽的抗寒性测定与综合评价[J]. 经济林研究, 2012, 30(3): 16-21.
LI B,LIU L Q,LUO S P,etal. Determination and comprehensive evaluation on cold resistance flower bud in almond[J].NonwoodForestResearch, 2012, 30(3): 16-21.
[10]司剑华, 卢素锦. 低温胁迫对5种柽柳抗寒性生理指标的影响[J]. 中南林业科技大学学报:自然科学版, 2010, 30(8): 78-81.
SI J H, LU S J.Effects of low temperature stress on cold-resistance physiological indexes of five Tamarixl in Qinghai[J].JournalofCentralSouthUniversityofForestry&Technology, 2010, 30(8): 78-81.
[11]张艳侠, 罗华, 侯乐峰,等. 五个石榴品种的抗寒性评价[J]. 浙江农业学报, 2015, 27(4): 549-554.
ZHANG Y X, LUO H, HOU L F,etal. Cold resistance evaluation of five pomegranate varieties[J].ActaAgriculturaeZhejiangensis, 2015, 27(4): 549-554.
[12]高京草, 王长柱, 王进国,等. 枣树抗寒性测定方法研究[J]. 西北林学院学报,2011, 26(5): 72-75.
GAO J C, WANG C Z, WANG J G,etal. Determination methods of cold resistance of Chinese jujube[J].JournalofNorthwestForestryUniversity, 2011, 26(5): 72-75.
[13]王依, 靳娟, 罗强勇, 等. 4个酿酒葡萄品种抗寒性的比较[J]. 果树学报, 2015, 32(4):612-619.
WANG Y, JIN J, LUO Q Y,etal.Comparison of cold resistance among 4 grapevine cultivars[J].JournalofFruitScience, 2015, 32(4): 612-619.
[14]郝再彬,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨出版社,2002.
[15]李合生.植物生理生化试验原理与技术[M].北京:高等教育出版社,2000.
[16]冯献宾, 董倩, 李旭新,等. 黄连木和黄山栾树的抗寒性[J]. 应用生态学报,2011,22(5): 1 141-1 146.
FENG X B, DONG Q, LI X X,etal. Cold resistance ofPistaciachinensisandKoelreuteriaintegrifoliola[J].ChineseJournalofAppliedEcology, 2011, 22(5): 1 141-1 146.
[17]巴特尔·巴克, 海利力·库尔班, 茹鲜·木沙,等. 库尔勒香梨树干阳阴面形成层温度的对比分析[J]. 中国农业气象, 2011, 32(2): 185-189.
BATUR B, HILIL K,RUSHAN M,etal. Comparative study of cambium temperature of north-unexposed and south-exposed bark of Korla fragrant pear tree[J].ChineseJournalofAgrometeorology, 2011, 32(2): 185-189.
[18]李轶冰, 杨顺强, 任广鑫,等. 低温处理下不同禾本科牧草的生理变化及其抗寒性比较[J]. 生态学报, 2009, 29(3): 1 341-1 347.
LI T B, YANG S Q, REN G X,etal. Changes analysis in physiological properties of several gramineous grass species and cold-resistance comparison on under cold stress[J].ActaEcologicaSinica,2009,29(3): 1 341-1 347.
[19]马文涛, 樊卫国. 贵州野生柑橘的抗寒性测定和综合评价[J]. 西北植物学报, 2014, 34(10): 2 063-2 069.
MA W T,FAN W G. Determination and comprehensively evaluation on cold-tolerance of wild citrus from Guizhou[J].ActaBot.Boreal-Occident.Sin, 2014, 34(10): 2 063-2 069.
[20]潘晓云, 曹琴东, 王根轩. 膜脂过氧化作为扁桃品种抗寒性鉴定指标研究[J]. 生态学报, 2002, 22(11): 1 902-1 911.
PAN X Y, CAO Q D, WANG G X.Evaluation of lipid peroxidation for use in selection of cold hardiness cultivars of almond[J].ActaEcologicaSinica, 2002, 22(11): 1 902-1 911.
[21]樊丁宇, 卢春生, 闫鹏,等. 库尔勒气象站与郊区果园的冬季低温比较及建模[J]. 新疆农业科学, 2013, 50(2): 249-253.
FAN D Y, LU C S, YAN P,etal. Study on the winter low temperatures comparison and build models between Korla weather station and suburbs orchards[J].XinjiangAgriculturalSciences, 2013, 50(2): 249-253.
[22]刘芬, 姜清彬, 马英姿,等. 7个短枝木麻黄种源耐寒评价及综合分析[J]. 中南林业科技大学学报, 2015, 35(6): 40-44.
LIU F, JIANG Q B, MA Y Z,etal. Evaluation and comprehensive analysis of cold tolerance on sevenCasuarinaequisetifoliaprovenances[J].JournalofCentralSouthUniversityofForestry&Technology,2015, 7(6): 40-44.
[23]周斌, 张金龙, 冯纪年,等. 短期低温胁迫对核桃抗氧化酶活性的影响[J]. 西北林学院学报, 2015, 30(3): 51-53.
ZHOU B,ZHANG J L,FENG J N,etal. Antioxidant enzymes activities of walnut tree under short term cold stress[J].JournalofNorthwestForestUniversity,2015, 30(3): 51-53.
[24]陈善福, 舒庆尧. 植物耐干旱胁迫的生物学机理及其基因工程研究进展[J]. 植物学报, 1999, 16(5): 555-560.
CHEN S F, SHU Q Y. Biological mechanism of and genetic engineering for drought stress tolerance in plants[J].ChineseBulletinofBotany, 1999, 16(5): 555-560.
[25]高福元, 张吉立, 刘振平. 冬季低温对4种彩叶植物SOD、POD活性影响的研究[J]. 中国农学通报, 2010, 26(5): 169-173.
GAO F Y,ZHANG J L,LIU Z P.Studies on effects of four species of color-leafed plants on SOD,POD activity of the cold-resistance in winter[J].ChineseAgriculturalScienceBulletin,2010,26(5): 169-173.
[26]田景花, 王红霞, 张志华,等. 温度对设施桃花器官发育的影响[J]. 应用生态学报, 2015, 26(5): 1 320-1 326.
TIAN J H, WANG H X, ZHANG Z H,etal. Effects of chilling stress on antioxidant system and ultrastructure of walnut cultivars[J].ChineseJournalofAppliedEcology, 2015, 26(5):1 320-1 326.
[27]ZHANG J, KIRKHAM M B.Drought-stress-induced changes in activities of superoxide dismutase, catalase, and peroxidase in wheat species[J].PlantCellPhysiology, 1994,35(5): 785-791.
(编辑:裴阿卫)
Changes of Cold Hardiness Indexes of Korla Fragrant Pear’s Different Organs with Air Temperature during Over-wintering Period AKREM Ahmet1, ABLET Mamat2,BATUR Bake1*,ALTUN Tursunhali1,
SAJIDA Abdukarim1,ZULKIYE Manaf1
(1 College of Grassland and Environmental Science, Xinjiang Agricultural University, Urumqi 830052,China; 2 Forest Management Station, Hotan Prefecture, Hotan,Xinjiang 848000,China)
During over wintering period, with the flower bud, trunk cambium and branch as material, we determined the cold hardiness indexes, antioxidant enzyme activities (SOD, CAT, POD), soluble protein content and relative conductivity, of different organs and tissues, simultaneously monitored the orchard air temperature and trunk cambium temperature, evaluated the cold resistance of different organs by using membership function method, analyzed the effect of air temperature on cold hardiness indexes and cold resistance of Xinjiang Korla fragrant pear’s different organs. Results showed that: (1) There was a difference between the changing trend of different organs same cold hardiness indexes and the same organ different cold hardiness indexes with the changes of air temperature, but generally the air temperature and cold hardiness indexes were negatively correlated; the cambium temperature difference and cold hardiness indexes were positively correlated. (2) Soluble protein content and cold hardiness indexes were positively correlated; SOD,CAT and POD activities are positively correlated, among them CAT and POD had relatively good correlation level. (3) While comprehensively evaluated the cold hardiness of different organs by using subordination function method CAT activity and soluble protein content had the biggest contribution. The cold hardiness sequence of different organs was flower bud> north-unexposed cambium >branch> south-exposed cambium. It was found that the POD and CAT activities expressed relatively high under the condition of relatively low temperature and intensively cambium temperature changes, SOD was the most sensitive protective enzyme to cambium temperature changes and freezing injury; during whole winter, the organ with the strong cold resistance contained relatively higher soluble protein content and lower relative conductivity; there was relatively well correlation between the changes of cambium temperature and cold hardiness indexes. Under certain condition it can indicate the certain organism cold tolerance.
over-wintering period, Korla fragrant pear, organ, physiological indexes, cold tolerance
1000-4025(2016)07-1408-09
10.7606/j.issn.1000-4025.2016.07.1408
2016-02-01;修改稿收到日期:2016-06-15
国家自然科学基金(31260289);新疆维吾尔自治区土壤学重点学科
艾克来木·艾合买提(1990-),男,维吾尔族,在读硕士研究生,主要从事干旱区资源与环境研究。E-mail: akeram27@163.com
巴特尔·巴克,教授,硕士生导师,主要从事干旱区生态与环境研究。 E-mail: bateerbake@163.com
Q945.79
A

