miR-338基因簇与食管癌发病风险的病例对照研究
高志奎,刘 冉,尹立红,浦跃朴
miR-338基因簇与食管癌发病风险的病例对照研究
高志奎,刘冉*,尹立红,浦跃朴
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏南京210009)
目的: 探讨miR-338基因簇在食管癌组织中的表达模式及其与食管癌发病风险的关系。方法:选取86例经病理确诊的食管癌患者,分别提取食管癌和癌旁组织总RNA,采用实时荧光定量PCR法检测hsa-miR-338-3p、hsa-miR-338-5p与hsa-miR-657的表达,应用配对样本t检验分析癌和癌旁组织中miRNA表达差异,Pearson相关分析检验基因簇各miRNA表达的相关性,logistic回归分析miRNA异常表达对食管癌发病风险的影响。结果:hsa-miR-338-3p与hsa-miR-338-5p在食管癌组织中的表达均较癌旁组织降低(P均<0.05),hsa-miR-657在食管癌和癌旁组织中表达的差异无统计学意义(P>0.05),hsa-miR-338-3p与hsa-miR-338-5p表达显著相关(r=0.754,P<0.05),hsa-miR-338-5p的低表达增加了食管癌的发病风险(OR=1.264,P<0.05),可能是食管癌的危险因素。结论:miR-338 基因簇可能抑制了食管癌的发生,hsa-miR-338-5p可能成为食管癌诊断的潜在标志物。
miR-338;基因簇;食管癌;生物标志物
【ABSTRACT】OBJECTIVE: T o i nvestigate t he e xpression l evel o f m iR-338 c luster i n e sophageal c arcinoma a nd i dentifythe relationship between miR-338 cluster and esophageal carcinoma. METHODS:A total of 86 cases of patients withconfirmed esophageal carcinoma were selected,real time RT-PCR were performed to detect the expression of hsa-miR-338-3p,hsa-miR-338-5p and hsa-miR-657. We used paired t-test to analyze the expression of miRNA in tumor and adjacentnon-tumor tissues,Pearson correlation analysis to examine the correlation of the expression of each miRNA and logisticregression a nalysis t o a nalyze t he e ffect o f a bnormal e xpression o f m iRNAs o n t he r isk o f e sophageal c ancer. R ESULTS:hsamiR-338-3p and hsa-miR-338-5p were downregulated in tumor tissues compared with adjacent non-tumor tissues(P<0.05),and no statical difference was found of the expression of hsa-miR-657 between the two tissues (P>0.05). Theexpression of hsa-miR-338-3p and hsa-miR-338-5p were significantly correlated (r=0.754,P<0.05),and low expressionof hsa-miR-338-5p was the risk factor for esophageal carcinoma (OR=1.264,P<0.05). CONCLUSION:miR-338 clustermay play an important role in the formation process of esophageal carcinoma. In addition hsa-miR-338-5p may represent themiR-338 c luster t o b e a u seful b iomarker f or d iagnosis.
【KEY WORDS】miR-338;cluster;esophageal carcinoma;biomarker
microRNA(miRNA)是一类可参与内源性靶基因调节的非编码RNA,长度约为22~28个核苷酸[1],已有大量研究证实其异常表达可能导致肿瘤的发生,影响其发展和预后[2-3]。miRNA在其启动子和操纵子的作用下进行表达,通常多个miRNA基因在染色体上聚集排列形成基因簇[4]。
由于位置的特殊性,一些成簇分布的miRNA受到共同的调控并以多顺反子的形式转录[5]。其编码产物在功能上可能会存在某种协同或者拮抗作用。有研究证实,一些miRNA基因簇在功能上比单个miRNA具有更高效的作用[6]。目前研究较多的miR-17-92、miR-143-145基因簇在多种动物、组织中影响肿瘤的发生发展,基因簇编码的各成熟miRNA发挥了一种协同作用[7-10]。
我们前期的食管癌miRNA芯片结果显示miR-338-3p在癌组织中表达下调[11],miRbase数据库(http://www.mirbase.org/)资料显示miR-338基因簇是一个在动物中高度保守的基因簇,hsa-miR-338-3p、hsa-miR-338-5p、hsa-miR-657编码基因共同参与组成miR-338基因簇。上述3个miRNA的编码基因均位于AATK基因内含子区,基因簇长度为673 bp,miR-338 基因簇可能在相同的启动子和调控子的作用下表达,在食管癌的发生发展中共同发挥重要作用。
有关miR-338基因簇的研究多局限于组成基因簇的单一成熟miRNA,本研究旨在通过检测miR-338基因簇编码的各miRNA在食管癌和癌旁组织中的表达,进而分析该基因簇的表达与食管癌发病的关系并初步探讨miR-338基因簇的表达模式。
1 材料与方法
1.1人体组织样本及一般资料
选取淮安市第一人民医院2009—2011年86例术后病理诊断食管癌患者。其中男性54例(62.8%),女性32例(37.2%),患者平均年龄(61.13±7.56)岁。收集外科手术切除的食管癌组织及对应癌旁组织标本,将组织剪至0.5 cm3大小,于-80 ℃保存备用。
1.2主要试剂和设备
Trizol试剂购自Invitrogen公司,SYBR Green Mix 购自Toyobo公司;MMLV购自Promega公司;dNTP 购自天根公司;核糖核酸酶抑制剂购自Thermo公司;Bulge-LoopTMmiRNA引物购自锐博公司。
梯度基因扩增仪、低温高速离心机购自Eppendorf公司;Step one-Plus荧光定量PCR仪购自ABI公司。
1.3实验方法
使用Trizol提取组织总RNA,real time PCR测定成熟miRNA的表达,RiboBio Bulge-LoopTM引物进行逆转录及PCR。
呼伦忙给他赔不是,说老人不懂规矩,还望多多担当包涵,并保证这样的事情不会再一次发生。对方倒是客气,说没事没事,只需补栽几棵草也不麻烦。如果这草坪他自己说了能算,就让老人种上几棵豆角。谁家没有老人呢?只要能哄老人开心,草坪全部铲光了都没有关系。只是草坪是大家的,如果邻居们纷纷效仿,这草坪岂不成了菜园子?呼伦说那是那是。点头哈腰地将物业管理人员送走,转身刚想发作,见丈母娘正可怜巴巴地盯着自己,一副低头认罪听候处理的样子,也就不忍心再动干戈,忙摆摆手说没事没事,一头扎进书房,把自己包得像一只过冬的狗熊。
1.3.1逆转录取RNA模版0.5 µg,RT引物工作液1 µL,加无核酸酶水5.5 µ L,70 ˚ C 加 热10 m in,立即置于冰上2 min;随后加入5×RT Buffer 2.5 µL,2.5 mmol/L dNTPs 1 µL,200 U/µL MMLV 0.25 µL,40 U/µL 核糖核酸酶抑制剂0.25 µL,无酶水3 µL,置于PCR仪,42℃、1 h ,70 ℃ 、10 m in,逆转录产物用于定量PCR。
1.3.2实时荧光定量PCR反应体系:SYBR®Green PCR Master mix 4.5 µL,cDNA 1 µL,上、下游引物各0.4 µL,无酶水3.7 µL。反应程序:95 ℃预热5 min;95 ℃、15 s,60 ℃、30 s,72 ℃、30 s;40个循环,每个循环72 ℃收集荧光。熔解曲线:60~95 ℃每升温0.3 ℃ 收集荧光。
PCR产物的定量校正:选取U6为内参,同一样本miRNA与U6的CT值 相减,得到该样本miRNA的相对表达量∆CT值 。∆CT值 越大,表明实际表达量越低。
1.4统计分析
数据分析使用SAS 9.2完成,癌组织和癌旁组织中miRNA表达水平差异的分析采用配对样本t检验方法,各miRNA表达水平的相关性分析采用Pearson相关分析方法,miRNA异常表达与食管癌患病关系的分析采用logistic回归分析方法,检验水准α=0.05。
2 结果
2.1miR-338基因簇成熟miRNA的表达
对癌组织和癌旁组织中成熟miRNA的相对表达量进行配对样本t检验(见表1),与癌旁组织相比,食管癌组织中hsa-miR-338-3p、hsa-miR-338-5p显著低表达,其表达量(2-∆∆CT)分别是癌旁组织的0.621和0.506,hsa-miR-657在两种组织中的表达差异则无统计学意义。
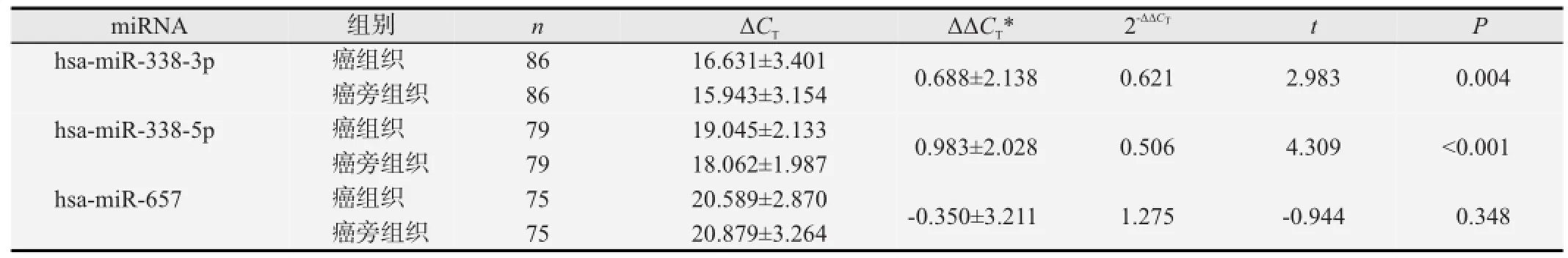
表1 食管癌中miR-338基因簇的相对表达
对hsa-miR-338-3p、hsa-miR-338-5p和hsa-miR-657的相对表达量∆CT进 行Pearson相关分析(见图1),结果显示3组miRNA相互之间表达的相关性均具有统计学意义(P<0.05)。hsa-miR-338-3p与hsa-miR-338-5p表达高度相关 (r=0.754,P<0.05);hsa-miR-657与hsamiR-338-3p的相关系数为0.653,与hsa-mi-338-5p的相关系数为0.500。
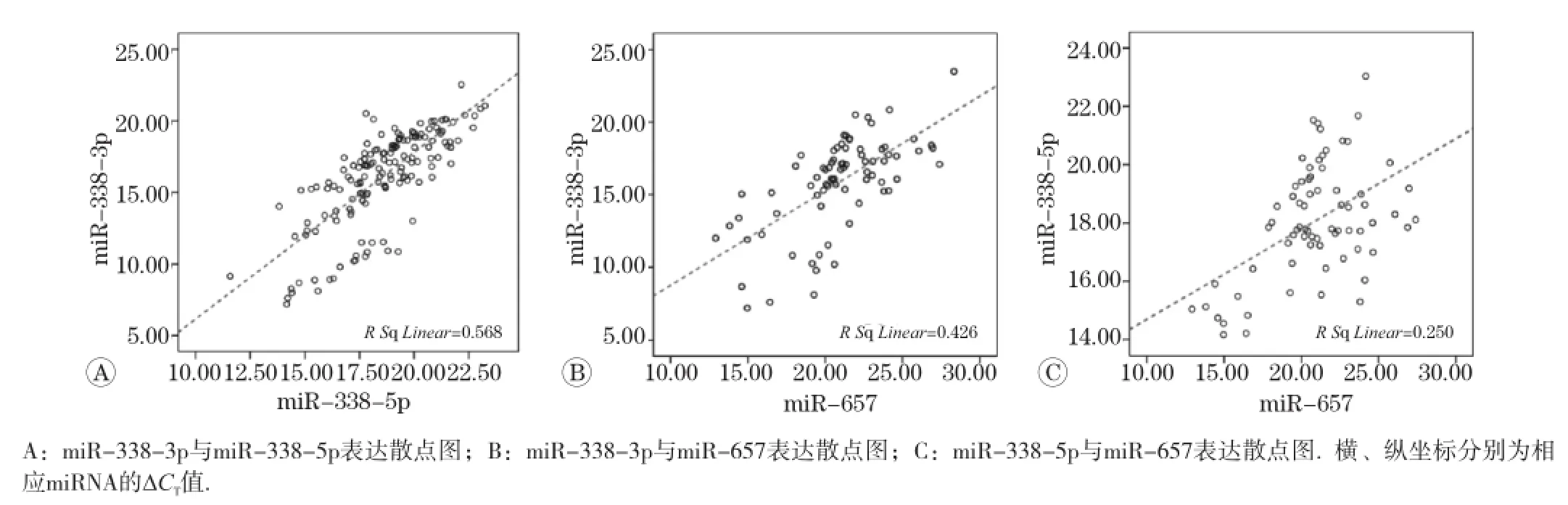
图1 miRNA表达的相关性分析
2.3miRNA表达与食管癌患病风险
为了评估miRNA异常表达与食管癌患病之间的关系,对数据进行1∶1配对条件logistic回归分析(见表2)。结果显示hsa-miR-657的表达未引起食管癌发病风险的改变,hsa-miR-338-5p、hsa-miR-338-3p表达的降低会增加食管癌的发病风险。
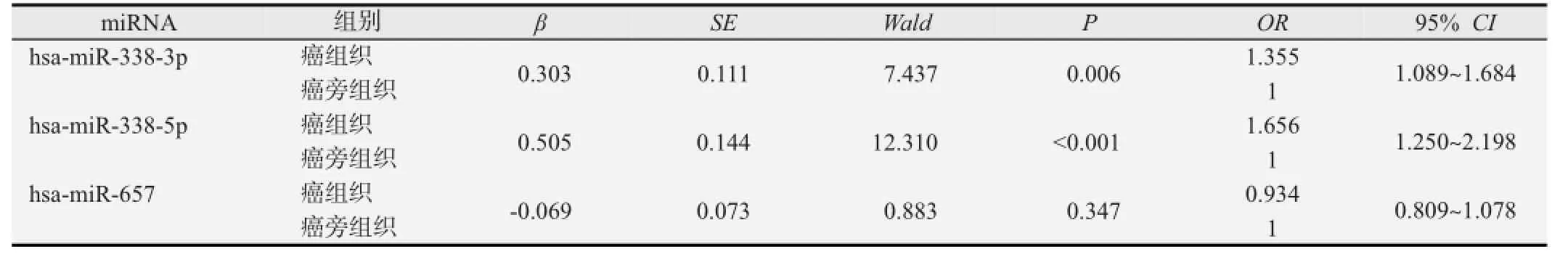
表2 miRNA异常表达与食管癌患病风险的条件logistic回归分析
对hsa-miR-338-3p、hsa-miR-338-5p进行多因素logistic回归分析(见表3),最终hsa-miR-338-5p进入方程,hsa-miR-338-5p低表达会引起食管癌发病风险升高(OR=1.264,P<0.05)。
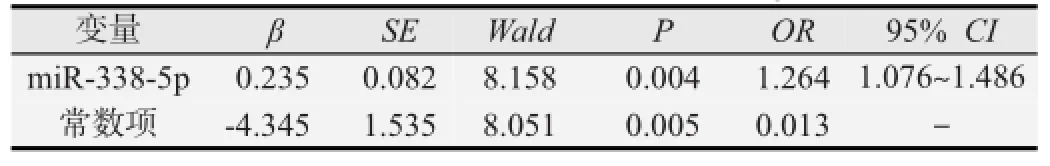
表3 miR-338基因簇与食管癌发病风险的条件logistic回归分析
3 讨论
有研究表明miR-338-3p在多种癌组织和细胞中下调表达并发挥重要作用。在结直肠癌细胞中,miR-338-3p可以抑制Smoothened蛋白表达,进而抑制细胞的侵袭和迁移能力[12]。在胃癌细胞中,miR-338-3p可直接作用于ZEB2和MACC1,抑制上皮间质化过程[13]。Li等[14]研究发现miR-338-3p可以抑制食管癌细胞的增殖、迁移、侵袭和集落形成,在裸鼠中过表达miR-338-3p,种植肿瘤的生长受到抑制,本研究显示miR-338-3p在人食管癌中显著低表达(t=2.983,P<0.05),miR-338-3p可能在人食管癌的形成中发挥了抑制作用。
有研究发现miR-338-5p在结直肠癌组织和血浆中异常表达,肝癌患者血浆中miR-338-5p与AFP表达负相关,miR-338-5p可能成为结直肠癌和肝癌的早期诊断标志物[15-16]。对移植肾脏组织研究发现,miR-338-5p表达与移植患者的生存显著相关,miR-338-5p可以作用于TRAF3,引起BAFF信号的改变,从而引起移植肾脏后免疫反应的改变[17]。与多种癌组织中低表达趋势相一致,本研究发现miR-338-5p在人食管癌中显著低表达(t=4.309,P<0.05),其可能成为食管癌的诊断标志物。
Yan等[18]研究发现早期喉癌中miR-657异常表达,统计分析表明miR-657可以较好的区分早期喉癌和正常黏膜组织,其可能成为早期喉癌的诊断标志物。miR-657可以结合IGF2R的3'UTR区并参与调节Hep-G2细胞中IGF2R的表达,Lv等[19]分析认为其与2型糖尿病AACA序列的插入和缺失相关。Zhang等[20]研究发现肝癌组织中miR-657高表达,在免疫缺陷小鼠中过表达miR-657可见肝癌细胞的增殖以及克隆形成能力增强,实验证实miR-657可以作用于TLE1,通过NF-kappa B信号通路促进肝癌的形成。本研究并未发现食管癌和癌旁组织中miR-657的表达存在显著差异,推测可能是miR-657的组织、时间特异性表达所致。
我们应用Pearson相关对miR-338基因簇各miRNA的表达进行分析,结果显示,hsa-miR-338-3p、hsamiR-338-5p、hsa-miR-657在表达上高度相关(P<0.05),来自于同一前体的hsa-miR-338-3p与hsa-miR-338-5p相关系数高达0.754,位置上紧密排列的miR-338基因簇表达miRNA的过程可能受到某些共同的调控。多因素logistic分析显示hsa-miR-338-5p的低表达是食管癌的危险因素(OR=1.264,P<0.05),hsa-miR-338-3p并未进入最终方程,考虑是由于两者之间表达高度相关所致。
综上,miR-338基因簇可能作为一个整体,参与了复杂的分子信号调控网络,共同影响了食管癌的发生发展,hsa-miR-338-5p可能在该通路的调控中发挥了主要作用,其可能代表miR-338基因簇成为食管癌诊断的标志物。miR-338基因簇调控食管癌的分子机制有待于进一步实验的研究。
[1] Reinhart BJ,Slack FJ,Basson M,et al. The 21-nucleotide let-7 RNA regulates developmental timing in caenorhabditis elegans [J]. Nature,2000,403(6772):901-906.
[2] Chen HH,Huang WT,Yang LW,et al. The PTEN-AKT-mTOR/RICTOR pathway in nasal natural killer cell lymphoma is activated by miR-494-3p via PTEN but inhibited by miR-142-3p via RICTOR [J]. Am J Pathol,2015,185(5):1487-1499.
[3] Li L,Chen YY,Li SQ,et al. Expression of miR-148/152 family as potential biomarkers in non-small-cell lung cancer[J]. Med Sci Monit,2015,21:1155-1161.
[4] Yue J,Tigyi G. Conservation of miR-15a/16-1 and miR-15b/16-2 clusters [J]. Mamm Genome,2010,21(1/2):88-94.
[5] Yu J,Wang F,Yang GH,et al. Human microRNA clusters:genomic organization and expression profile in leukemia cell lines[J]. Biochem Biophys Res Commun,2006,349(1):59-68.
[6] Li Y,Li W,Ying Z,et al. Metastatic heterogeneity of breast cancer cells is associated with expression of a heterogeneous TGFβ-activating miR424-503 gene cluster [J]. Cancer Res,2014,74(21):6107-6118.
[7] Lai M,Xiao C. Functional interactions among members of the miR-17-92 cluster in lymphocyte development,differentiation and malignant transformation[J]. Int Immunopharmacol,2015,28(2):854-858.
[8] Krysan K,Kusko R,Grogan T,et al. PGE2-driven Expression of c-Myc and OncomiR-17-92 contributes to apoptosis resistance in NSCLC[J]. Mol Cancer Res,2014,12(5):765-774.
[9] Villadsen SB,Bramsen JB,Ostenfeld MS,et al. The miR-143/-145 cluster regulates plasminogen activator inhibitor-1 in bladder cancer [J]. Br J Cancer,2012,106(2):366-374.
[10] Zhang J,Sun Q,Zhang Z,et al. Loss of microRNA-143/145 disturbs cellular growth and apoptosis of human epithelial cancers by impairing the MDM2-p53 feedback loop[J]. Oncogene,2013,32(1):61-69.
[11] Yang M,Liu R,Sheng J,et al. Differential expression profiles of microRNAs as potential biomarkers for the early diagnosis of esophageal squamous cell carcinoma [J]. Oncol Rep,2013,29(1):169-176.
[12] Xue Q,Sun K,Deng HJ,et al. MicroRNA-338-3p inhibits colorectal carcinoma cell invasion and migration by targeting smoothened[J]. Jpn J Clin Oncol,2014,44(1):13-21.
[13] Huang N,Wu Z,Lin L,et al. MiR-338-3p inhibits epithelial-mesenchymal transition in gastric cancer cells by targeting ZEB2 and MACC1/Met/Akt signaling[J]. Oncotarget,2015,6(17):15222-15234
[14] Li X,Li Z,Yang G,et al. MicroRNA-338-3p suppresses tumor growth of esophageal squamous cell carcinoma in vitro and in vivo[J]. Mol Med Rep,2015,12(3):3951-3957.
[15] Yong FL,Law CW,Wang CW. Potentiality of a triple microRNA classifier:miR-193a-3p,miR-23a and miR-338-5p for early detection of colorectal cancer[J]. BMC Cancer,2013,13(2):280.
[16] Chen Y,Chen J,Liu Y,et al. Plasma miR-15b-5p,miR-338-5p,and miR-764 as biomarkers for hepatocellular carcinoma [J]. Med Sci Monit,2015,21:1864-1871.
[17] 马旭怡. miR-338-5p靶向作用于TRAF3参与肾移植术后抗体介导的免疫排斥[D]. 苏 州:苏州大学,2014.
[18] Yan W,Chen M,Tao Z,et al. Identification of predictive biomarkers for early diagnosis of larynx carcinoma based on microRNA expression data[J]. Cancer Genet,2013,206 (9/10):340-346.
[19] Lv K,Guo Y,Zhang Y,et al. Allele-specific targeting of hsa-miR-657 to human IGF2R creates a potential mechanism underlying t he a ssociation o f A CAA-insertion/deletion p olymorphism with type 2 diabetes [J]. Biochem Biophys Res Commun,2008,374(1):101-105.
[20] Zhang L,Yang L,Liu X,et al. MicroRNA-657 promotes tumorigenesis in hepatocellular carcinoma by targeting transducin-like enhancer protein 1 through nuclear factor kappa B pathways [J]. Hepatology,2013,57(5):1919-1930.
A case-control study on the risk of esophageal carcinoma and miR-338 cluster
GAO Zhikui,LIU Ran*,YIN Lihong,PU Yuepu
(Key Laboratory of Environmental Medicine Engineering of Ministry of Education, School of Public Health, Southeast University, Nanjing 210009, Jiangsu, China)
R730.2
A
1004-616X(2016)02-0107-04
1 0.3969/j.issn.1004-616x.2016.02.005
2015-11-17;
2016-01-04
国家自然科学基金(81172747,81573108,81573191)
作者信息: 高志奎,E-mail:gaozhikuijy@163.com。*
,刘冉,E-mail:ranliu@seu.edu.cn

