中药筋脉通对糖尿病大鼠背根神经节神经元超微结构影响的研究
杨 丹 梁晓春 屈 岭 吴群励 吴亚楠 石 玥 戴 威
中药筋脉通对糖尿病大鼠背根神经节神经元超微结构影响的研究
杨丹梁晓春屈岭吴群励吴亚楠石玥戴威
目的 观察中药筋脉通对链尿佐菌素(streptozotocin,STZ)诱导的糖尿病(diabetes mellitus,DM)大鼠背根神经节(dorsal root ganglia,DRG)感觉神经元超微结构的影响。方法 雄性SD大鼠18只,腹腔内注射STZ诱导建立糖尿病大鼠模型,随机分为糖尿病组、筋脉通组与牛磺酸组,每组6只大鼠,并设正常对照组6只。成模后每天1次灌胃给药,持续16周。药物干预16周后,用电子Von Frey仪检测机械痛阈值,取大鼠背根神经节,按常规方法制成切片后,在电镜下观察背根神经节神经元超微结构的病理学改变。结果 糖尿病大鼠的机械痛阈值较正常组显著明显下降(P<0.01),背根神经节感觉神经元超微结构出现重度损伤,神经元细胞中线粒体数量显著减少(P<0.01),并且线粒体肿胀及空泡化比率、凋亡率显著升高(P<0.01);中药筋脉通可显著提高机械痛阈值(P<0.01),减轻神经元的损伤,提高神经元中线粒体的数量(P<0.05),并且降低线粒体的肿胀及空泡化比率及凋亡率(P<0.01),且中药筋脉通的疗效优于牛磺酸(P<0.01)。结论 中药筋脉通对抑制糖尿病大鼠背根神经节感觉神经元及其线粒体超微结构的损伤而对糖尿病所致周围神经病变起到一定的保护作用。
糖尿病周围神经病变; 背根神经节神经元; 筋脉通; 超微结构; 线粒体
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一[1],随着病程的进展,可有30% ~90%的糖尿病患者存在周围神经病变。DPN早期主要表现为感觉功能障碍,临床表现为四肢末端对称性的神经性疼痛和/或感觉异常,晚期可出现下肢的溃疡,糖尿病足,甚至导致截肢。临床研究证实中药筋脉通可改善糖尿病患者的临床症状[2]。背根神经节(dorsal root ganglia,DRG)神经元是初级感觉神经元,负责将外界疼痛刺激转换为内在神经冲动并将其传导至脊髓。本研究应用链脲佐菌素(streptozotgcin,STZ)诱导大鼠1型糖尿病周围神经损伤模型,观察周围神经损伤后糖尿病大鼠机械疼痛阈值和背根神经节感觉神经元及神经元中线粒体超微结构的病理学改变,并从对感觉神经元超微结构的影响方面,探讨中药筋脉通对糖尿病周围神经病变的保护作用。
1 材料与方法
1.1材料
1.1.1动物清洁级 雄性SD大鼠,体质量270~310 g, 购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2009-0017。
1.1.2主要药物和试剂 筋脉通胶囊(由菟丝子、女贞子、桂枝、水蛭、延胡索、细辛、荔枝核等7味药物组成),中国医学科学院北京协和医院院内制剂,由北京九龙制药厂加工生产,每粒含生药0.35 g,生产批号:061019;牛磺酸(牛磺酸组 rine)(Sigma-Aldrich,美国);精蛋白鲜胰岛素注射液(江苏万邦生化医药股份有限公司,中国),原位末端标记法[terminal dexynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]凋亡试剂盒(Roche,美国)。
1.2实验方法
1.2.1动物模型 建立及分组给药适应性饲养1周后,根据随机数字表法将大鼠随机分为正常对照组和造模组。造模前禁食不禁水12小时,造模组大鼠按60 mg/kg的剂量,一次性左下腹腔内注射0.45%的STZ溶液。正常对照组按60 mg/kg的剂量,一次性左下腹腔内注射0.1 mol/L枸橼酸盐缓冲液。72小时后用血糖仪测尾尖静脉血血糖,凡血糖≥16.7 mmol/L者为造模成功,作为糖尿病(糖尿病)大鼠。根据随机数字表法将造模成功的18只糖尿病大鼠随机分为3组:模型对照组、筋脉通组及牛磺酸组,每组各6只。腹腔内注射枸橼酸盐缓冲液的大鼠,72小时后测尾尖静脉血血糖,血糖<7.0 mmol/L的大鼠,作为正常对照组,共6只,体质量与鼠龄均相匹配,且均为雄性。糖尿病大鼠每天皮下注射精蛋白锌胰岛素注射液1~3 IU,维持血糖在30 mmol/L以下,防止因血糖过高无法存活至实验终点。成模后即开始灌胃给药,每天1次,连续16周,筋脉通及牛磺酸组均按成人剂量15倍给药,即筋脉通组给药量1.31 g/(kg·d)(给药剂量为生药量),牛磺酸组给药量1.20 g/(kg·d)。糖尿病组和正常对照组灌服蒸馏水10 mL/(kg·d)。
1.2.2检测血糖 分别于药物干预前、干预后4周、8周、12周及16周取尾尖静脉血,用血糖仪测定血糖。
1.2.3检测机械痛阈值 应用电子Von Frey仪在药物干预16周后、处死大鼠前进行测定。将大鼠置于升高的金属网上,盖以透明的有机玻璃罩。大鼠适应环境15分钟,待大鼠的梳理和探究活动基本消失后,用探头纤维垂直剌激大鼠后肢足底中部,使探头纤维稍成S形,观察是否出现缩足反应。大鼠在刺激后出现快速的缩足反应,记为阳性反应,并记录电子屏幕上的受力数值(g)。身体活动所引起的缩足反应则不记作阳性反应。第一次测量后,待大鼠适应环境3~5分钟,再次测量。每只大鼠每侧足底测量3次,并记录。取平均值作为大鼠的机械痛阈值。
1.2.4 电镜标本的制备 各组大鼠均于灌胃16周后处死,用12%的乌拉坦以1 mL/100 g体质量进行腹腔注射麻醉后,暴露坐骨神经,用玻璃分针钝性分离,将神经完整拉出,切取膨大的背根神经节组织,分别用2.5%戊二醛前固定、1%锇酸后固定2小时;乙醇梯度脱水、纯丙酮脱水;按照丙酮与环氧树脂 Epon812包埋剂浸透,再用纯环氧树脂Epon812浸透2~3小时;环氧树脂Epon812包埋、聚合、固化处理形成包埋块;制成超薄切片,用200目铜网捞片,电子双重染色;JEM1010透射电子显微镜观察背根神经节神经元超微结构并拍照。在30,000倍电镜下每组选取5个DRG神经元计数其中的线粒体个数及其变性线粒体个数,计算线粒体变性率。
1.2.5荧光标记原位末端转移酶标记法检测背根神经节细胞凋亡 将背根神经节组织梯度脱水后制备成蜡块,经切片、脱蜡后,按照TUNEL试剂盒所示的操作步骤进行操作,切片经脱水、透明、封片、镜检,激光共聚焦显微镜下观察并用Leica正常对照focal图像分析软件照相。每组任意选择5个视野,计数凋亡细胞数,计算凋亡比率。
1.3统计学分析
应用SPSS 21.0统计软件,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD方法。以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠血糖值比较
药物干预前后各组大鼠血糖情况如表1所示:药物干预前造模各组大鼠即糖尿病组、筋脉通组及牛磺酸组血糖与正常组相比显著升高(P<0.01),药物干预前糖尿病组、筋脉通组及牛磺酸组各组之间的血糖无统计学差异(P>0.05)。
药物干预16周后糖尿病组、筋脉通组及牛磺酸组的大鼠血糖与正常组相比均显著升高(P<0.01),糖尿病组、筋脉通组及牛磺酸组各组之间的大鼠血糖在药物干预16周后无统计学差异(P>0.05)。正常组、糖尿病组、筋脉通组及牛磺酸组各组大鼠的血糖在药物干预16周后与干预前比较无统计学差异(P>0.05)。

表1 药物干预前、后各组大鼠血糖的比较(x±s,mmol/L)
2.2各组大鼠的机械痛阈值比较
糖尿病模型组大鼠的机械痛阈值较正常组出现显著下降(P<0.01)。各治疗组的机械痛阈值较糖尿病组有不同程度的回升:筋脉通组及牛磺酸组两治疗组的左侧机械痛阈值较糖尿病组升高(P<0.05),且两治疗组间比较,差异无统计学意义(P>0.05);筋脉通组及牛磺酸组两治疗组的右侧机械痛阈值较糖尿病组显著提高(P<0.01),且组间比较,差异无统计学意义(P>0.05)。见表2。
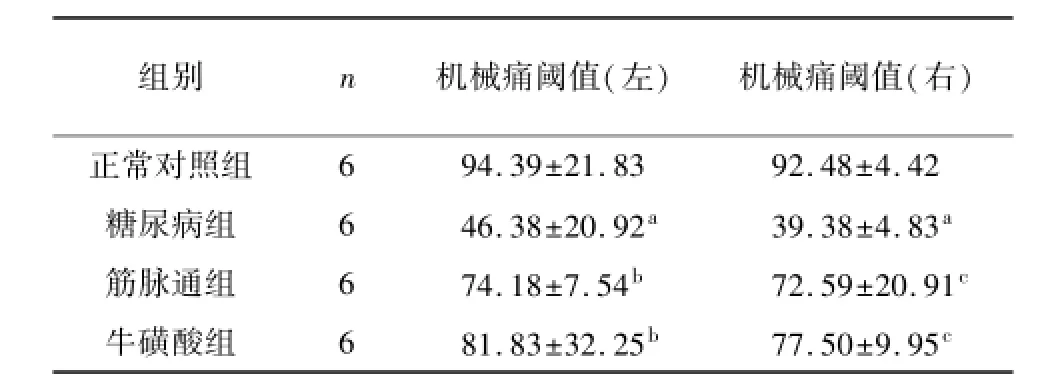
表2 各组大鼠机械痛阈测量表(x±s,g)
2.3大鼠背根神经节超微结构损伤的抑制作用比较
正常对照组:DRG细胞神经髓鞘均匀一致,呈同心圆形排列,胞浆均匀。细胞核大,核膜规整,常染色质丰富且分布均匀,核仁清晰居中。胞质内富含粗面内质网、线粒体,溶酶体少或无,粗面内质网大小、形态均正常,内质网管腔清晰细长,表面核糖体密集。线粒体含量丰富且结构正常,线粒体内外膜、线粒体嵴结构完整清晰,分布均匀。
糖尿病组:DRG细胞神经髓鞘排列紊乱疏松,出现板层分离现象,皱缩和裂隙,DRG细胞内超微结构出现重度损伤。病理学异常表现如下:背根神经节细胞水肿,细胞核明显变小,核膜明显皱褶,部分模糊,核仁偏向一侧。粗面内质网肿胀扩张,线粒体肿胀变性,线粒体外膜破坏,线粒体嵴断裂、稀疏、甚至消失,大部分呈空泡样变、甚至溶解,溶酶体明显增多。
筋脉通组及牛磺酸组:筋脉通及牛磺酸两治疗组DRG细胞超微结构出现轻度损伤,背根神经节细胞呈现轻度水肿,部分神经节细胞可见细胞核膜破坏,内质网略增大,线粒体数目减少且轻度肿胀,细胞结构改变较糖尿病组轻,损伤程度介于正常组与糖尿病组之间。见图1。

图1 大鼠背根神经节超微结构损伤的抑制作用比较(×30,000)
2.4各组大鼠背根神经节超微结构下线粒体数量比较
对相同倍数视野下每个DRG神经元中线粒体进行计数。如表3所示,各组单个DRG神经元中线粒体的平均数目。正常对照组单个DRG神经元中含有线粒体的数目为(225±21)个。糖尿病组单个DRG神经元中含有线粒体的数目为(136±19)个,较正常对照组显著下降(P<0.01)。筋脉通组DRG神经元中含有线粒体的数目为(182±23)个,较糖尿病组显著升高(P=0.012)。牛磺酸组DRG神经元中含有线粒体的数目为(170±20)个,较糖尿病组显著升高(P=0.041)。筋脉通组与牛磺酸组两组中线粒体数目比较,无统计学差异(P>0.05)。

表3 超微结构下各组大鼠单个DRG 神经元线粒体数量及变性率比较(x±s)
2.5各组大鼠背根神经节超微结构下线粒体变性率比较
如表3所示,正常对照组DRG神经元中线粒体肿胀且线粒体棘消失、空泡化的线粒体出现率为(18.70±2.21)%,糖尿病组DRG神经元中线粒体肿胀且线粒体棘消失、空泡化的线粒体出现率为(66.68±4.27)%,糖尿病组变性线粒体的比率较正常对照组显著增加(P<0.01)。
筋脉通组DRG神经元中线粒体肿胀且线粒体棘消失、空泡化的线粒体出现率为(39.89±2.57)%,牛磺酸组DRG神经元中肿胀及空泡化的线粒体出现率为(51.89±5.96)%,两治疗组DRG神经元中线粒体的变性率均较糖尿病组显著下降(P<0.01),并且筋脉通组变性线粒体出现率显著低于牛磺酸组(P<0.01)。
2.6各组大鼠背根神经节细胞调亡比较
每组随机选取5个视野,TUNEL荧光检测结果显示:正常对照组DRG细胞凋亡较少;糖尿病组DRG凋亡明显增加,各治疗组介于两者之间。计算细胞的凋亡率并分析如下,见表4:与正常对照组相比,糖尿病组的细胞调亡率显著升高(P<0.01),筋脉通与牛磺酸组两治疗组与正常对照组相比,细胞凋亡率无统计学差异(P<0.01);与糖尿病组相比,筋脉通与牛磺酸组两治疗组的细胞调亡率均降低,其中筋脉通组降低显著(P<0.01),牛磺酸组较糖尿病组细胞调亡率降低具有统计学差异(P<0.05);两治疗组间细胞调亡率比较无统计学差异(P>0.05)。
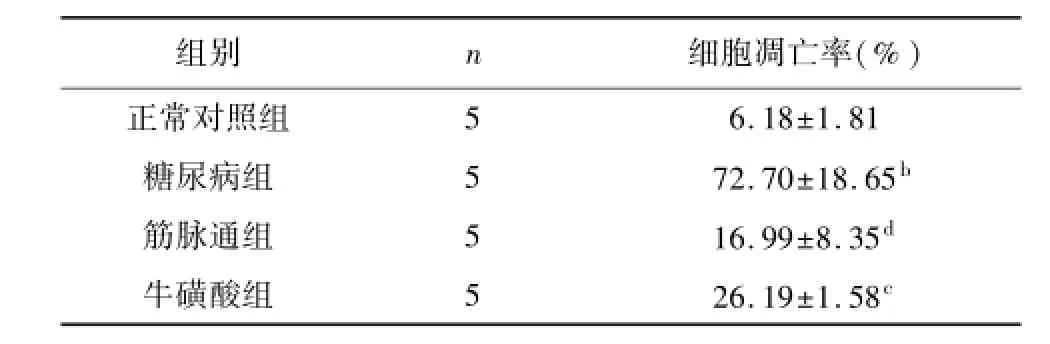
表4 各组大鼠背根神经节细胞凋亡率比较(x±s)
3 讨论
DPN的发病机制十分复杂,持续的高糖状态所致复杂的下游代谢途径参与到疾病的发病过程中,包括多元醇通路活性的增加、非酶糖基化终产物的形成、氧化应激作用的增强、神经营养支持功能的受损以及蛋白激酶C的活化和/或丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的活性[3-5]。而高糖所致线粒体途径活性氧(reactive oxygen species,ROS)的生成与以上这些机制均有关联,表明线粒体功能障碍及其在氧化应激中所起的触发作用,可见线粒体在DPN病因学中发挥了重要的媒介作用及在糖尿病神经病变的神经元中扮演着调节者的角色[6-8]。
DRG是外周感觉神经传入中枢神经的第一站,其结构和功能对于神经传导的影响尤为重要。糖尿病神经病变是以周围神经DRG神经元的退行性改变为特征的,线粒体是细胞内对缺氧最敏感的细胞器,因此DRG中线粒体尤其会受到影响。在神经细胞中,线粒体的地位尤其重要。线粒体为神经元的各项活动提供能量,并且几乎是能量的唯一提供者。线粒体并被认为是糖尿病中与神经元相关并发症的关键调控者[7]。由于DRG中的线粒体是高糖环境下神经元产生ROS的主要来源,因此它们更易受到损伤。过量ROS的生成可促进氧化应激反应,通过DNA、蛋白的修饰作用或通过诱导的线粒体凋亡通路,促使线粒体功能障碍和线粒体退行性改变[9-11]。可见,糖尿病时高糖可通过 ROS的生成、线粒体损伤和凋亡促使神经的损伤和死亡[12]。大量证据表明,糖尿病神经病变发生时,神经元中的线粒体受到损害[13]。
如何保护高糖状态下神经元及其线粒体结构从而发挥其生理功能的研究,已成为DPN治疗的策略之一。前期实验结果表明[2],筋脉通能够显著减轻糖尿病周围神经病变患者临床症状,改善病变神经传导速度。本实验将暴露于高糖环境下的背根神经节神经元及其线粒体作为糖尿病周围神经病变的模型进行研究,对损伤神经相应感觉神经元及其线粒体的超微结构变化进行了观察。实验结果证实糖尿病可导致大鼠缩足阈值下降,出现痛觉过敏。而筋脉通可提高大鼠的机械痛阈值,改善DPN所导致的痛觉过敏。
对大鼠DRG的超微结构观察发现,高糖环境可导致背根神经节细胞的坏死及其DRG感觉神经元的退行性改变的病理学变化,高糖可显著减少DRG内线粒体数量,增加背根节内DRG神经元内肿胀和空泡化线粒体的出现率。筋脉通可使DPN大鼠DRG内线粒体数量增加,感觉神经元线粒体的肿胀及空泡化变性程度减轻,进一步从筋脉通对DRG及其线粒体的超微结构影响的角度,探讨了其可能的作用机制,中药筋脉通可能通过抑制糖尿病所致感觉神经元中线粒体的退行性病变,从而保护背根神经发挥其正常的生物学功能,维持神经正常的感觉、传导功能,同时通过抑制糖尿病大鼠DRG细胞内源性途径即线粒体途径的细胞的凋亡而发挥神经保护作用。
综上所述,糖尿病可导致背根神经节神经元及其线粒体坏损伤并降低糖尿病大鼠的机械痛阈值,筋脉通可改善上述病理学改变并提高其机械痛阈值。本研究提供了中药筋脉通治疗糖尿病周围神经病变的超微结构方面的证据。
[1] Callaghan BC,Cheng HT,Stables CL,et al.Diabetic neuropathy:clinical manifestations andcurrenttreatments[J].Lancet Neurol,2012,11(6):521-534.
[2] 梁晓春,崔丽英,郭赛珊,等.筋脉通治疗糖尿病周围神经病变的临床观察[J].中国中西医结合杂志,1999,19(9):517-519.
[3] Yagihashi S,Yamagishi S,Wada R.Pathology and pathogenetic mechanisms of diabetic neuropathy:correlation with clinical signs and symptoms[J].Diabetes Res Clin Pract,2007,77(Suppl 1):S184-S189.
[4] Calcutt NA,Jolivalt CG,Fernyhough P.Growth factors as therapeutics for diabetic neuropathy[J].Curr Drug Targets,2008,9(9):47-59.
[5] Tomlinson DR,Gardiner NJ.Glucose neurotoxicity[J].Nat Rev Neurosci,2008,9(1):36-45.
[6] Brownlee M.Biochemistry and molecular cell biology of diabeticcomplications[J].Nature,2001,414(6865):813-820.
[7] FernyhoughP,HuangTJ,VerkhratskyA.Mechanismof mitochondrial dysfunction in diabetic sensory neuropathy[J].J Peripher Nerv Syst,2003,8(4):227-235.
[8] Verkhratsky A and Fernyhough P.Mitochondrial malfunction and Ca2+dyshomeostasis drive neuronal pathology in diabetes[J]. Cell Calcium,2008,44(1):112-122.
[9] Kang D,Hamasaki N.Alterations of mitochondrial DNA in common diseases and disease states:aging,neurodegeneration,heart failure,diabetes,and cancer[J].Curr Med Chem,2005,12(4):429-441.
[10] ZeevalkGD,Bernard LP,Song C,et al.Mitochondrial inhibition and oxidative stress:reciprocating players in neurodegeneration[J].Antioxid Redox Signal,2005,7(9-10):1117-1139.
[11] BealMF.Mitochondriatakecenterstageinagingand neurodegeneration[J].Ann Neurol,2005,58(4):495-505.
[12] VincentAM,FelanEL.New insights into the mechanisms of diabetic neuropathy[J].Rev Endocr Metab Disord,2004,5(3):227-236.
[13] Vincent AM,Edwards JL,McLean LL,et al.Mitochondrial biogenesis and fission in axons in cell culture and animal models of diabetic neuropathy[J].Acta Neuropathol,2010,120(4):477-489.
(本文编辑:董历华)
Effects of Jinmaitong on ultrastructure of DRG neurons in STZ-DM rats
YANG Dan,LIANG Xiao-chun,QU Ling,et al. Department of Traditional Chinese Medicine,PUMC Hospital,PUMC&CAMS,Beijing 100730,China
LIANG Xiao-chun,E-mail:xcliang@vip.sina.com
Objective To study the effects of Jinmaitong on ultrastructure of dorsal root ganglion(DRG)neurons in STZ-induced diabetic rats.Methods The STZ-induced diabetic rats were randomly divided into 4 groups including normal control group(Con),Diabetic group(DM),JMT group(JMT)and Taurine group(Tau).Six rats were in each group.All rats were given intragastric administration for 16 weeks and then culled.The mechanical withdrawal threshold was tested by electronic Von Frey instrument before death.The DRG of the rats was collected and used for transmission electron microscopy. Results Compared with the control group,the mechanical pain threshold of the DM group was significantly decreased(P<0.01).The ultrastructure of mitochondria in DRG neurons of the DM group was severely damaged.The number of mitochondria in neurons was significantly decreased(P<0.01),and the rate of swelling mitochondria and mitochondria vacuolar degeneration in DRG neurons was significantlyincreased of the DM group(P<0.01).The mechanical pain threshold and the number of mitochondria of two treatment groups were significantly improved compared with the DM group.The rate of swelling mitochondria and mitochondria vacuolar degeneration of two treatment groups were decreased strikingly(P<0.01),and the JMT group was more effective than the Tau group(P<0.01).Conclusion JMT could ameliorate the peripheral neuropathy by improving the pathological morphology of mitochondria in DRG neurons.
Diabetic peripheral neuropathy; Dorsal root ganglia; Jinmaitong;Ultrastructure; Mitochondria
R285.5
A
10.3969/j.issn.1674-1749.2016.06.003
北京市自然科学基金(7122147)
100730 中国医学科学院北京协和医学院北京协和医院中医科转化医学中心(杨丹、梁晓春、屈岭、吴群励、吴亚楠、石玥);中国医学科学院基础医学研究所电镜室(戴威)
杨丹(1980-),女,博士,主治医师。研究方向:糖尿病慢性并发症的中西医结合临床研究。E-mail:jsj000jsj@163.com
梁晓春(1956-),女,博士,教授,博士生导师。中国中西医结合学会常务理事,中国中西医结合学会内分泌代谢病专业委员会副主任委员,北京中西医结合学会糖尿病专业委员会主任委员。研究方向:中西医结合防治糖尿病慢性并发症。E-mail:xcliang@vip.sina.com
2015-12-27)

